Introducción: El butirato, principal ácido graso de cadena corta (AGCC) producido en el colon por fermentación de fibras dietéticas, desempeña funciones esenciales en la homeostasis intestinal y en la modulación inmunometabólica. En situaciones clínicas que alteran la microbiota intestinal o limitan el aporte de fibra, la suplementación oral con butirato surge como una estrategia complementaria.
Objetivo: Revisar la evidencia disponible sobre la suplementación oral con butirato en patologías intestinales y extraintestinales, analizando resultados clínicos, formulaciones y perspectivas terapéuticas.
Métodos: Se realizó una revisión narrativa de ensayos clínicos publicados en humanos que evaluaron suplementos de butirato, incluyendo diferentes formas farmacéuticas (sales, microencapsulados, triglicéridos). Se consideraron estudios en enfermedad inflamatoria intestinal (EII), síndrome de intestino irritable (SII), estreñimiento, diverticulosis y patologías extraintestinales como obesidad, enfermedad pulmonar obstructiva crónica (EPOC), hipertensión y artritis reumatoide.
Resultados: La suplementación con butirato en patologías intestinales mostró beneficios en reducción de síntomas, mejora de la mucosa y disminución de episodios de diverticulitis, con buena tolerabilidad y seguridad. En colitis ulcerosa y enfermedad de Crohn, se observaron efectos positivos como complemento a tratamientos convencionales. En patologías extraintestinales, los ensayos sugieren beneficios en obesidad pediátrica, EPOC y artritis reumatoide, aunque los resultados son heterogéneos y limitados por el número reducido de participantes y la variabilidad en las dosis.
Conclusión: El butirato oral es seguro y potencialmente eficaz en diversas condiciones clínicas, pero se requieren estudios más amplios y estandarizados para definir indicaciones, dosis y formulaciones óptimas.
Palabras clave: Butirato, ácidos grasos de cadena corta, microbiota intestinal, suplementación oral, enfermedad inflamatoria intestinal.
ABSTRACT
Oral Butyrate Supplementation in Intestinal and Extra-Intestinal Disorders: A Narrative Review of Clinical Evidence
Background: Butyrate, a key short-chain fatty acid (SCFA) produced by colonic fermentation of dietary fibers, plays a crucial role in gut homeostasis, epithelial integrity, and immune modulation. In clinical settings where fiber intake or microbiota function is compromised, oral butyrate supplementation has emerged as a potential therapeutic strategy.
Objective: To review current clinical evidence on oral butyrate supplementation in intestinal and extra-intestinal disorders, focusing on efficacy, safety, and future perspectives.
Methods: A narrative review was conducted including clinical trials in humans assessing oral butyrate or its derivatives (salts, microencapsulated forms, and triglycerides) in inflammatory bowel disease (IBD), irritable bowel syndrome (IBS), functional constipation, diverticulosis, pediatric obesity, chronic obstructive pulmonary disease (COPD), hypertension, and rheumatoid arthritis.
Results: In IBD, oral butyrate showed clinical improvement and mucosal healing as an adjunct therapy. In IBS and functional constipation, supplementation significantly reduced abdominal pain and improved bowel habits. In diverticulosis, it decreased diverticulitis episodes. Extra-intestinal applications, such as pediatric obesity and COPD, demonstrated metabolic and functional benefits, while no significant effect was observed on blood pressure in hypertensive patients. Butyrate supplementation was safe and well tolerated in all studies reviewed.
Conclusions: Oral butyrate represents a promising and safe complementary approach for several clinical conditions. However, heterogeneity in dosing, formulation, and study design warrants further large-scale, standardized trials to establish optimal therapeutic use.
Keywords: Butyrate, short-chain fatty acids, oral supplementation, gut microbiota, inflammatory bowel disease.
INTRODUCCIÓN
Los ácidos grasos de cadena corta (AGCC) son metabolitos generados en el colon a partir de la fermentación de fibras dietéticas por la microbiota intestinal, destacando entre ellos el acetato, propionato y butirato (1). Este último constituye la principal fuente energética de los colonocitos, favoreciendo la integridad de la mucosa intestinal y regulando la permeabilidad epitelial, la respuesta inmunitaria y la inflamación local (2,3). En cuanto a los efectos del butirato sobre la mucosa colónica, se han identificado principalmente los siguientes: inhibición de la inflamación y la carcinogénesis, refuerzo de varios componentes de la barrera de defensa del colon y disminución del estrés oxidativo. También se ha encontrado que el butirato actúa en la inhibición de la activación del factor nuclear kappa B y la desacetilación de histonas (4).
La producción endógena de butirato depende de la disponibilidad de sustratos fermentables, como el almidón resistente, los fructooligosacáridos, la inulina y las pectinas, presentes en frutas, verduras, cereales integrales y legumbres. Estudios recientes han evidenciado que determinados prebióticos y fibras específicas pueden modular la abundancia de bacterias productoras de butirato, como Faecalibacterium prausnitzii, cuya disminución se asocia a enfermedades inflamatorias intestinales (5). En condiciones clínicas que alteran la microbiota (antibióticos, quimioterapia, radioterapia) o limitan el aporte de fibra (dietas restrictivas), la producción endógena de butirato puede verse comprometida (6-8). En este contexto, la suplementación oral con butirato surge como una estrategia complementaria para preservar la homeostasis intestinal.
En la Figura 1 se muestran varios enfoques dietéticos para incrementar el butirato intestinal y principales acciones del mismo: control de la permeabilidad intestinal, inmunomodulación, cambios en la microbiota intestinal.
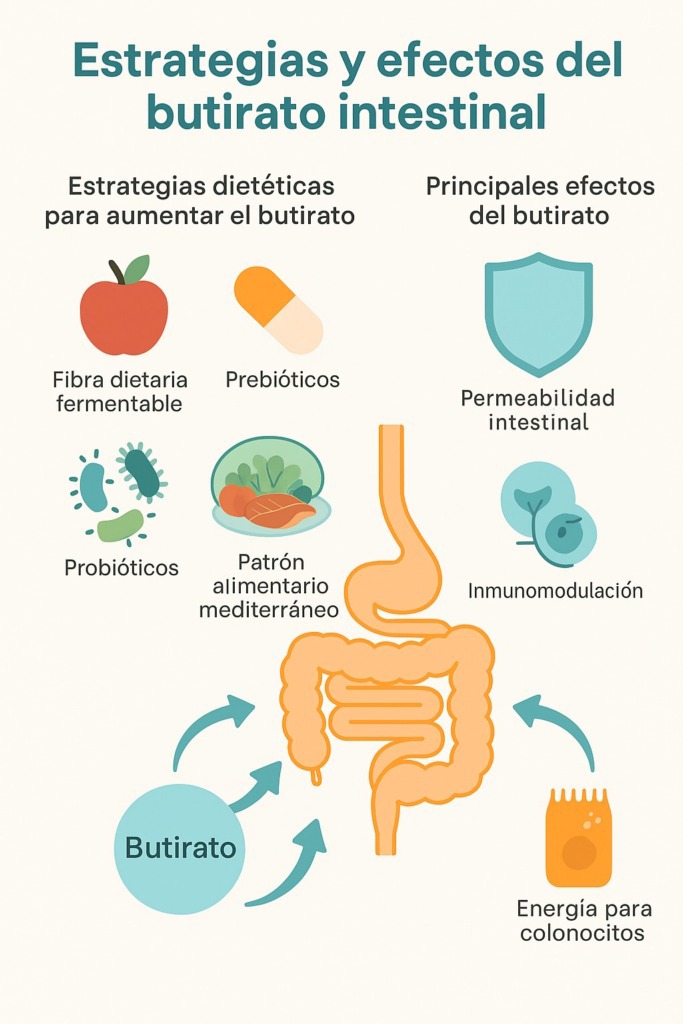
Figura 1. Estrategias para mejorar la producción de butirato intestinal y sus principales acciones a nivel intestinal. Fuente: imagen elaborada a partir de la web de ELiE Health Solutions
Más allá del tracto digestivo, se ha propuesto que el butirato podría desempeñar un papel en patologías extraintestinales relacionadas con inflamación sistémica, disbiosis y permeabilidad intestinal aumentada, como la obesidad, la enfermedad pulmonar obstructiva crónica (EPOC) y la artritis reumatoide (10, 20-24).
El presente trabajo revisa la evidencia clínica sobre la suplementación oral con butirato en diferentes patologías, sus mecanismos propuestos y los desafíos pendientes para su implementación terapéutica.
OBJETIVOS
Revisar la evidencia clínica disponible sobre el uso de suplementos nutricionales de butirato en:
- Patologías intestinales: enfermedad inflamatoria intestinal, síndrome de intestino irritable, estreñimiento funcional y diverticulosis.
- Patologías extraintestinales: obesidad pediátrica, EPOC, hipertensión arterial y artritis reumatoide.
MATERIALES Y MÉTODOS
Se realizó una revisión narrativa basada en ensayos clínicos en humanos publicados en bases de datos biomédicas. Se incluyeron estudios que evaluaron la suplementación oral con butirato, en forma de sales (principalmente butirato de sodio y calcio), microencapsulados o como triglicérido (tributirina). Tabla 1.
La búsqueda bibliográfica se llevó a cabo en las bases de datos Medline (PubMed) y SciELO. La estrategia se construyó a partir de los términos ácido butírico, butirato y tributirina. Se consideraron artículos en español e inglés, sin restricción de fecha de inicio, hasta mayo de 2025. Los criterios de inclusión contemplaron ensayos clínicos en humanos con administración oral de butirato o sus derivados, en el contexto de patologías intestinales o extraintestinales. Se excluyeron estudios realizados en animales, modelos in vitro y aquellos con suplementación combinada en los que no era posible atribuir los efectos específicamente al butirato. Entre las variables analizadas se incluyeron la dosis administrada, la duración del tratamiento, la tolerabilidad, los efectos sobre la sintomatología y los cambios en biomarcadores.
RESULTADOS
1. Patologías intestinales
Enfermedad inflamatoria intestinal. En enfermedad de Crohn leve a moderada, la administración de 4 g/día de butirato durante 8 semanas mejoró parámetros clínicos (11). En colitis ulcerosa, la suplementación con butirato asociada a inulina o como formulación microencapsulada mostró reducción de la actividad clínica, mejoría endoscópica y disminución de biomarcadores inflamatorios en ensayos recientes (12-14).
Síndrome de intestino irritable. En un ensayo aleatorizado, 66 pacientes recibieron 300 mg/día de butirato durante 4 semanas, observándose reducción significativa del dolor abdominal frente a placebo (15).
Constipación funcional. Estudios en pacientes con estreñimiento funcional evidenciaron mejoras sintomáticas con butirato (16).
Diverticulosis. La suplementación redujo la incidencia de episodios de diverticulitis en un seguimiento de 12 meses (17).
2. Patologías extraintestinales
Obesidad pediátrica. Un ensayo en niños de 5 a 17 años con un índice de masa corporal (IMC) superior al percentil 95 mostró que el butirato redujo marcadores inflamatorios y mejoró parámetros metabólicos (20).
EPOC y sarcopenia. La administración de 300 mg/día durante 12 semanas mejoró masa muscular y parámetros funcionales en pacientes con EPOC (21).
Hipertensión. Un ensayo aleatorizado en 23 pacientes hipertensos no evidenció efecto del butirato sobre la presión arterial (9,22).
Artritis reumatoidea. Dos estudios recientes reportaron reducción de la actividad clínica y modulación del microbioma con la suplementación de butirato como coadyuvante del metotrexato (23, 24).
En cuanto a la tolerabilidad y seguridad, en todos los ensayos revisados, el butirato fue bien tolerado y no se reportaron efectos adversos graves.
DISCUSIÓN
La suplementación oral con butirato se perfila como una herramienta dietética prometedora en la modulación de la inflamación intestinal y en la preservación de la integridad epitelial. En EII, la evidencia disponible, aunque limitada, sugiere beneficios clínicos al complementar terapias convencionales. No obstante, la heterogeneidad en dosis, duración y formulaciones dificulta la estandarización de recomendaciones. En patologías funcionales como SII y estreñimiento, los resultados son consistentes en la mejora de síntomas, lo que refuerza el papel del butirato como modulador del eje intestino-cerebro.
En el ámbito extraintestinal, los ensayos en obesidad pediátrica y EPOC son alentadores, mientras que en hipertensión los resultados son negativos, lo que subraya la necesidad de estudios más amplios para definir indicaciones concretas.
Las principales limitaciones identificadas en esta revisión incluyen el reducido número de estudios y participantes, la heterogeneidad en las formulaciones utilizadas (sales, microencapsulados y tributirina), así como la ausencia de ensayos a largo plazo y de evaluaciones de costo-efectividad. Los ensayos clínicos disponibles muestran una notable variabilidad en relación con la dosis administrada (300 mg/día a 4 g/día), la formulación empleada y la duración de la intervención (4 semanas a 12 meses). Esta diversidad metodológica limita la posibilidad de establecer recomendaciones estandarizadas.
Las perspectivas futuras incluyen ensayos multicéntricos con protocolos homogéneos, estudios para evaluar la interacción entre microbiota, metabolitos y respuesta clínica, y el desarrollo de formulaciones con liberación controlada y mayor biodisponibilidad por parte de la industria.
CONCLUSIONES
El butirato oral representa una estrategia terapéutica complementaria, con un perfil de seguridad favorable y resultados preliminares alentadores en patologías intestinales y extraintestinales. Sin embargo, la evidencia disponible aún es insuficiente para definir con precisión la dosis, la duración óptima del tratamiento y los criterios de selección de pacientes. Para establecer su verdadero potencial clínico, se requieren ensayos multicéntricos, con diseños metodológicamente sólidos, poblaciones más amplias y protocolos homogéneos que permitan generar recomendaciones basadas en evidencia robusta.
Tabla 1. Ensayos analizados
| Patología / Contexto | Diseño | N (pacientes) | Intervención | Duración | Resultados principales | Referencia |
| Enfermedad de Crohn | Ensayo abierto | 13 | 4 g/día (2 g cada 12 h) butirato oral | 8 semanas | Mejoría clínica significativa | (11) |
| Colitis ulcerosa leve-moderada | Ensayo abierto | 20 | 900 mg butirato + 250 mg inulina | NR | Mejoría sintomática y endoscópica | (12) |
| Colitis ulcerosa activa | ECA doble ciego | 36 | 600 mg/kg/día butirato sódico | 12 semanas | Reducción de inflamación y biomarcadores | (13) |
| Colitis ulcerosa leve-moderada | ECA multicéntrico | 100 | 600 mg/día butirato microencapsulado | 8 semanas | Remisión clínica y mejoría endoscópica | (14) |
| SII | ECA | 66 | 300 mg/día butirato | 4 semanas | Disminución del dolor abdominal | (15) |
| Estreñimiento funcional | ECA | 57 | 300 mg/día butirato (150 mg c/12 h) | 12 semanas | Reducción de la incidencia de estreñimiento | (16) |
| Diverticulosis | ECA | 73 | 300 mg/día butirato sódico | 12 meses | Disminución de episodios de diverticulitis | (17) |
| Pacientes críticos (tributirina) | Ensayo clínico | NR | Fórmulas enterales con tributirina | NR | Mejora en tolerancia GI y reducción de complicaciones | (18,19) |
| Obesidad pediátrica | ECA cuádruple ciego | 54 | 20 mg/kg/día butirato sódico | 6 meses | Reducción de inflamación y parámetros metabólicos | (20) |
| EPOC (sarcopenia) | ECA doble ciego | 131 | 300 mg/día butirato | 12 semanas | Mejora de fuerza muscular y parámetros funcionales | (21) |
| Hipertensión | ECA doble ciego | 23 | Cápsulas de butirato sódico | NR | Sin cambios significativos en presión arterial | (22) |
| Artritis reumatoidea | ECA + estudio combinado | 30 | 1 g butirato TID + metotrexato | 4 meses | Reducción de actividad clínica y modulación del microbioma | (23,24) |
Referencias
- Canani RB, Costanzo MD, Leone L, Pedata M, Meli R, Calignano A. Potential beneficial effects of butyrate in intestinal and extraintestinal diseases. World J Gastroenterol 2011; 17(12):1519-28.
- Olveira Fuster G, González-Molero I. Probióticos y prebióticos en la práctica clínica. Nutr Hosp 2007; 22(Sup 2).
- Hamer HM, Jonkers D, Venema K, Vanhoutvin S, Troost FJ, Brummer RJ. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther 2008; 27(2):104-19.
- Bart van der Hee and Jerry M. Wells. Microbial Regulation of Host Physiology by Short-chain Fatty Acids. Trends in Microbiology, August 2021, Vol. 29, No. 8
- García-Peris P, Velasco C, Lozano M.A, Moreno Y, Paron L, de la Cuerda C, et al. Effect of a mixture of inulin and fructo-oligosaccharide on Lactobacillus and Bifidobacterium intestinal microbiota of patients receiving radiotherapy: a randomised, double-blind, placebo-controlled trial. Nutr Hosp 2012;27(6):1908-15
- Cresci G, Nagy LE, Ganapathy V. Lactobacillus GG and tributyrin supplementation reduce antibiotic-induced intestinal injury. JPEN J Parenter Enteral Nutr. 2013 Nov; 37(6):763-74.
- García de Lorenzo, Mateos A. 1.º Workshop en Farmaconutrición en el Paciente Crítico. Fresenius Kabi.
- Sossai P. Butyric acid: what is the future for this old substance? Swiss Med Wkly 2012; 142:w13596.
- Tilves C, Yeh HC, Maruthur N, Juraschek SP, Miller E, White K, Appel LJ, Mueller NT. Increases in Circulating and Fecal Butyrate are Associated With Reduced Blood Pressure and Hypertension: Results From the SPIRIT Trial. J Am Heart Assoc. 2022 Jul 5; 11(13):e024763.
- Manrique Vergara, David, & González Sánchez, María Eugenia. (2017). Ácidos grasos de cadena corta (ácido butírico) y patologías intestinales. Nutrición Hospitalaria, 34(Supl. 4), 58-61
- Di Sabatino A, Morera R, Ciccocioppo R, Cazzola P, Gotti S, Tinozzi FP, et al. Oral butyrate for mildly to moderately active Crohn’s disease. Aliment Pharmacol Ther. 2005; 22(9):789-94.
- Assisi RF; GISDI Study Group. Combined butyric acid/mesalazine treatment in ulcerative colitis with mild-moderate activity. Minerva Gastroenterol Dietol. 2008; 54(3):231-8.
- Firoozi D, Masoumi SJ, Hosseini Asl SMK, Labbe A, Razeghian-Jahromi I, Fararouei M, et al. Effects of short-chain fatty acid-butyrate supplementation on expression of circadian-clock genes, sleep quality, and inflammation in patients with active ulcerative colitis: a double-blind randomized controlled trial. Lipids Health Dis. 2024; 23(1):216.
- Karlowicz K, Lewandowski K, Tulewicz-Marti E, Domżał-Magrowska D, Talar-Wojnarowska R, Małecka-Wojciesko E, et al. Efficacy and safety of microencapsulated butyrate add-on therapy in induction of remission in patients with mild-to-moderate Ulcerative Colitis: a multicenter, double-blind, randomized, placebo-controlled clinical study. J Crohn’s Colitis. 2024; 18(Suppl_1):i1608.
- Załęski A, Banaszkiewicz A, Walkowiak J. Butyric acid in irritable bowel syndrome. Prz Gastroenterol. 2013; 8(6):350-3.
- Pituch A, Walkowiak J, Banaszkiewicz A. Butyric acid in functional constipation. Prz Gastroenterol. 2013; 8(5):295-8.
- Krokowicz L, Stojcev Z, Kaczmarek BF, Kociemba W, Kaczmarek E, Walkowiak J, et al. Microencapsulated sodium butyrate administered to patients with diverticulosis decreases incidence of diverticulitis: a prospective randomized study. Int J Colorectal Dis. 2014; 29(3):387-93.
- Scheppach WM. Intestamin and acute pancreatitis. Clin Nutr. 2003; 22(Suppl 1):32.
- Beale RJ, Sherry T, Lei K, Campbell-Stephen L, McCook J, Smith J, et al. Early enteral supplementation with key pharmaconutrients improves Sequential Organ Failure Assessment score in critically ill patients with sepsis: outcome of a randomized, controlled, double-blind trial. Crit Care Med. 2008; 36(1):131-44.
- Coppola S, Nocerino R, Paparo L, Bedogni G, Calignano A, Di Scala C, et al. Therapeutic effects of butyrate on pediatric obesity: a randomized clinical trial. JAMA Netw Open. 2022;5(12):e2244912.
- Qaisar R, Karim A, Muhammad T, Ahmad F. Butyrate supplementation reduces sarcopenia by repairing neuromuscular junction in patients with chronic obstructive pulmonary disease. Respir Med. 2024; 222:107510.
- Verhaar BJH, Wijdeveld M, Wortelboer K, Rampanelli E, Levels JHM, Collard D, et al. Effects of oral butyrate on blood pressure in patients with hypertension: a randomized, placebo-controlled trial. Hypertension. 2024; 81(10):2124-36.
- He J, Wang N, Li Y, Wang R, Tan X, Zhufeng R, et al. Efficacy, safety and mechanism of butyrate in the treatment of rheumatoid arthritis (RA) [abstract]. Arthritis Rheumatol. 2024; 76 (suppl 9).
- Blank R, Boix-Amoros A, Reilly ER, Bu K, Cunningham I, Nayak RR, et al. Effects of butyrate supplementation in modulation of gut microbiome and its metabolites in new-onset rheumatoid arthritis. J Clin Transl Sci. 2025; 9(Suppl 1):138.
Revista Microbioma 3
DIRECCIÓN GENERAL:
MSc. Bq. Lorena Keller
EDITORES EN JEFE:
MSc. Bq. Lorena Keller
PhD. Md. Jorge Iván Marín Uribe
EDITORAS ASOCIADAS:
Lic. Guadalupe Benavídez
Dra. Paula Mendive
COMITÉ CIENTÍFICO/EDITORIAL:
Luis Miguel Becerra, Colombia
Juan Gabriel Vargas Asensio, Costa Rica
Vicente Navarro-López, España
Martín Vázquez, Argentina
Guadalupe Benavídez, Argentina
Jorge Ramírez Antolin, España
César Ochoa, Colombia







No comments! Be the first commenter?