Fecha de recepción: 7 de noviembre de 2024 Fecha de aceptación: 2 de diciembre de 2024
Resumen
La sinaptogénesis es el proceso por el que se forman las conexiones entre neuronas, o entre una neurona y otra célula del sistema nervioso. Este proceso es fundamental para el desarrollo y aprendizaje, y se produce a lo largo de la vida de una persona. En el ser humano comienza al principio de la gestación, pero ocurre con mayor rapidez desde dos meses antes del nacimiento hasta dos años después del nacimiento.
Palabras clave
Sinaptogénesis – Neurodesarrollo – Etapa prenatal – Etapa perinatal – Plasticidad sináptica.
Acosta GB. “Sinaptogénesis: haciendo caminos”. Psicofarmacología 2025;137:25-30.
Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El desarrollo sináptico comienza en la etapa prenatal, específicamente durante el tercer trimestre de gesta- ción. En este periodo, el cerebro del feto empieza a formar las primeras sinapsis, especialmente en áreas como la corteza cerebral y otras regiones subcorticales. Este inicio temprano de la sinaptogénesis es fundamen- tal para preparar el cerebro para las funciones básicas y los estímulos sensoriales que recibirá al nacer.
La formación de sinapsis aumenta significativamente durante las últimas semanas del embarazo y se inten- sifica en el período perinatal y postnatal, alcanzando un pico durante los primeros dos años de vida, lo que permite un desarrollo cognitivo y motor rápido.
Fases de la sinaptogénesis: etapa prenatal y perinatal
- Etapa prenatal
La sinaptogénesis comienza en el cerebro humano durante el desarrollo prenatal, específicamente en el
tercer trimestre de gestación. Este periodo es crítico para la formación inicial de sinapsis y la preparación del cerebro para el nacimiento.
Desarrollo inicial de sinapsis:
- Corteza cerebral: En el tercer trimestre, la corteza cerebral empieza a desarrollar un número significativo de sinapsis, lo cual es fundamental para la organiza- ción de las redes neuronales que controlan las funcio- nes básicas, como la respiración y la actividad sensorial primaria (1).
- Factores de crecimiento neuronal: Durante esta eta- pa, factores como el factor neurotrófico derivado del cerebro, más conocido por sus siglas en inglés BDNF (Brain-Derived Neurotrophic Factor), y el Factor de Cre- cimiento Nervioso (NGF) desempeñan funciones clave en la formación y estabilización de las sinapsis (2). El BDNF es una proteína, cuyo gen se encuentra en el cro- mosoma 11, que resulta ser la neurotrofina que tiene mayor expresión en el cerebro de los mamíferos, en es-
pecial en la corteza cerebral y el hipocampo. El BDNF se enlaza con al menos dos receptores de la superficie de las células, los cuales son capaces de responder a este factor de crecimiento, son los receptores de tirosi- na quinasa B (TrkB) y el receptor de baja afinidad para el factor de crecimiento nervioso (LNGFR). El factor neurotrófico modula la actividad de varios receptores de neurotransmisores, incluyendo receptores nicotínicos.
- Receptores de tirosina quinasa B (TrkB): El TrkB está codificado por el gen NTRK2. La activación de la vía BDNF-TrkB es importante para el desarrollo de la me- moria a corto plazo y el crecimiento neuronal (3).
- LNGFR: No se tiene muy clara cómo es la interacción entre el BDNF y el receptor LNGFR. Las investigaciones han apuntado que esta interacción es la que estaría de- trás de la inhibición de la muerte neuronal (3).
Plasticidad prenatal:
- Experiencias prenatales: La actividad espontánea de las neuronas, junto con las señales que recibe el feto, contribuyen a la formación de las sinapsis. Aunque el entorno intrauterino está más protegido, se ha demos- trado que factores como el estrés materno y la nutrición pueden influir en el desarrollo sináptico (4).
- Plasticidad preparatoria: Durante la etapa prenatal, la plasticidad cerebral permite la formación de sinapsis en preparación para los estímulos postnatales. Esto signifi- ca que el cerebro está “preconfigurado” para adaptarse rápidamente al ambiente externo tras el nacimiento.
- Etapa perinatal
El periodo perinatal, que abarca las últimas semanas de gestación y las primeras semanas después del naci- miento, es crucial para la consolidación de las sinapsis y la preparación para las interacciones sensoriales y mo- toras inmediatas del recién nacido.
Aumento rápido de sinapsis:
- Expansión sináptica: La cantidad de sinapsis en el cerebro aumenta de manera drástica en las semanas justo antes y después del nacimiento. Este crecimiento es impulsado por la exposición a los estímulos sensoria- les y la activación de redes neuronales específicas (5).
- Interacciones sensoriales: La llegada de estímulos auditivos y visuales tras el nacimiento potencia la forma- ción de sinapsis en las áreas corticales correspondien- tes, lo que refuerza la conectividad sináptica y permite la rápida adaptación del cerebro a nuevas experiencias.
Factores de influencia:
- Nutrición neonatal: La disponibilidad de nutrientes, especialmente ácidos grasos esenciales como el ácido docosahexaenoico (DHA), es crucial para la sinaptogé- nesis. La lactancia materna, por ejemplo, está asociada con un mejor desarrollo sináptico debido a su contenido en ácidos grasos poliinsaturados (6).
- Ambiente postnatal inmediato: Las interacciones con los cuidadores y la exposición a un entorno enriquecido contribuyen a la estabilización y consolidación de si- napsis, lo que favorece el desarrollo de las capacidades cognitivas y emocionales.
Evidencia clínica y relevancia
Alteraciones en la Sinaptogénesis Prenatal y Perinatal:
- Estrés materno y hormonas del estrés: La exposición al cortisol y otras hormonas de estrés en el útero puede influir negativamente en la sinaptogénesis y aumentar el riesgo de trastornos del neurodesarrollo (7).
- Desnutrición materna: La deficiencia de nutrientes esenciales durante el embarazo, como el hierro y el ácido fólico, está relacionada con una menor densidad sináptica y con un mayor riesgo de trastornos del desa- rrollo, incluidos el déficit cognitivo y conductual.
En el Cuadro 1 se detallan los factores genéticos, am- bientales y nutricionales que influyen en la sinaptogé- nesis y sus implicancias clínicas.
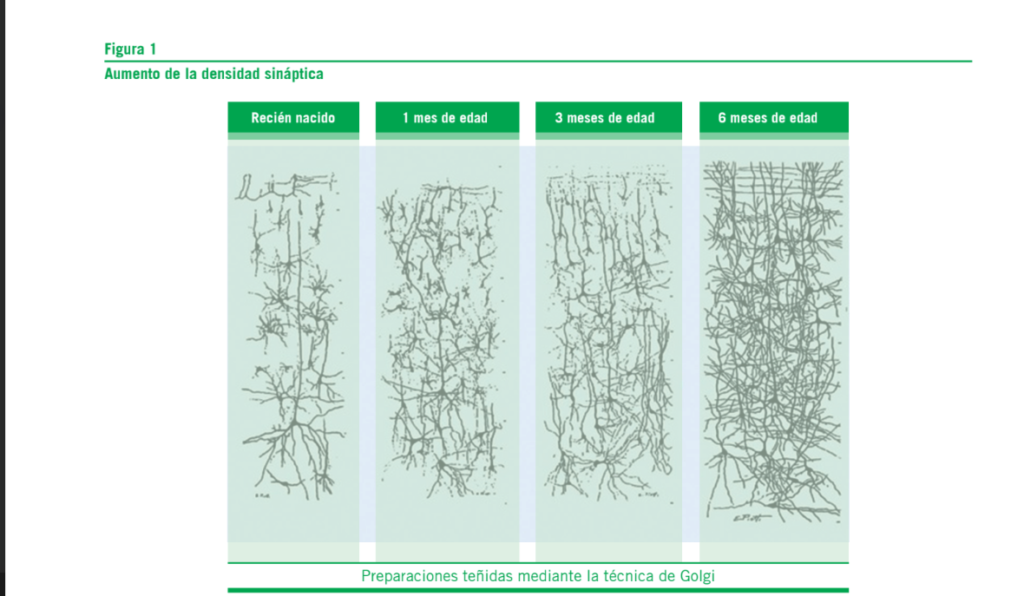
La Figura 1 ilustra el incremento de la densidad sináptica desde el tercer trimestre de gestación hasta los primeros me- ses postnatales.
Desarrollo sináptico en la etapa prenatal
El desarrollo sináptico comienza en el tercer trimestre de gestación y es un proceso clave para la formación de las pri- meras conexiones neuronales. Durante este tiempo, el cerebro fetal establece sinapsis en regiones como la corteza cerebral y áreas subcorticales, preparando al sistema nervioso para las funciones motoras, sensoriales y cognitivas esenciales tras el
nacimiento. Inmediatamente después de nacer, se produce un incremento espectacular del número de conexiones o sinapsis en todo el cerebro humano. Al cumplir el primer año de vida, el cerebro de un niño tiene casi el doble de conexiones si se lo compara con el de un adulto (9, 10). Esta sobreabundancia de conexiones gradualmente decrece a lo largo de la infancia, a medida que muchos de ellas son “podadas” y desaparecen. Existen diversos factores que contribuyen a esta disminución, como por ejemplo la influencia de las experiencias tempranas en la vida. La actividad de un camino neural, determinada por la experiencia, decide si una conexión se debilitará o se estabilizará como parte de una red permanente. Éste es un factor clave para la “plasticidad” del cerebro en desarrollo: su adaptabilidad respecto a la experiencia, que le confiere un valor inestimable para la supervivencia
Evidencia del inicio de la sinaptogénesis prenatal
- Desarrollo sináptico temprano: Las primeras sinapsis apare- cen en la corteza y otras regiones cerebrales hacia la semana 25-27 de gestación. Estas conexiones iniciales se desarrollan bajo la influencia de factores neurotróficos y señales de creci- miento neuronal (1).
- Proliferación y diferenciación neuronal: La sinaptogénesis se intensifica rápidamente a partir del tercer trimestre, contri- buyendo al establecimiento de redes neuronales que soporta- rán las funciones básicas al nacimiento (5).
Factores que influyen en la sinaptogénesis prenatal
- Factoresgenéticosymoleculares:
- Proteínas como las neurexinas y neuroligina juegan un pa- pel esencial en la formación y estabilización de sinapsis (11).
- Factoresambientalesynutricionales:
- La nutrición materna adecuada, incluyendo nutrientes como el hierro y los ácidos grasos esenciales, es crucial para el desarrollo sináptico óptimo (12).
- El estrés materno y la exposición a hormonas de estrés como el cortisol pueden afectar la sinaptogénesis y aumentar el riesgo de alteraciones del neurodesarrollo (13, 4).
Importancia clínica
La sinaptogénesis prenatal es esencial para la preparación del cerebro del recién nacido y su capacidad de responder a estímulos sensoriales. Alteraciones en este proceso pueden asociarse con trastornos del neurodesarrollo y afectan la capa- cidad cognitiva y conductual.
- Impacto de la sinaptogénesis alterada: La insuficiencia en la formación o estabilización de sinapsis durante el periodo prenatal puede contribuir a condiciones como la microcefalia y el retraso cognitivo (1).
- Prevención y cuidados prenatales: Mantener un adecuado estado nutricional y minimizar el estrés materno son estrate- gias importantes para optimizar la sinaptogénesis prenatal y reducir el riesgo de trastornos del desarrollo (12) .
Mecanismo de influencia de factores neu- rotróficos y señales de crecimiento
- Factoresneurotróficosysufunción:
- Definición y ejemplos: Los factores neurotróficos son pro- teínas que promueven la supervivencia, diferenciación y man- tenimiento de las neuronas. Se incluyen el Factor Neurotró- fico Derivado del Cerebro (BDNF), el Factor de Crecimiento Nervioso (NGF) y las Neurotrofinas (NT-3, NT-4/5).
Cuadro 1
Factores Críticos en la Sinaptogénesis Prenatal y Perinatal
| Categoría | Factores clave | Impacto en la sinaptogénesis | Implicancias clínicas |
| Genéticos | Genes como Neurexina y Neuroligi- na, esenciales para la formación y estabilización de sinapsis. | Mutaciones en estos genes se aso- cian con trastornos del neurodesa- rrollo como TEA y esquizofrenia. | Trastornos del nerodesarrollo, difi- cultad en la comunicación neuronal y problemas de aprendizaje. |
| Ambientales | Estrés materno y exposición al cortisol, que afectan la plasticidad sináptica y la expresión de BDNF. | El estrés prenatal altera la regulación del eje HHA y reduce la densidad sináptica en áreas críticas como el hipocampo. | Mayor riesgo de ansiedad, depresión y Trastorno por Déficit de Atención con Hiperactividad (TDAH) en la descendencia. |
| Nutricionales | Ácidos grasos esenciales (DHA), hierro y folatos, que son necesarios para la formación y mantenimiento de sinapsis. | Deficiencias nutricionales afectan la densidad sináptica, la plastici- dad y la conetividad neuronal en el cerebro fetal. | Riesgo de retraso cognitivo, pro- blemas conductuales y déficits de memoria en la infancia. |
- Mecanismo de acción: Estos factores se unen a recepto- res específicos en la superficie neuronal, como los receptores Trk (receptores de tirosina quinasa), desencadenando casca- das de señalización intracelular. Esta señalización activa vías como la MAPK/ERK y la PI3K/AKT, promoviendo la supervi- vencia celular y la formación de sinapsis estables (14).
- Acciónsobrelasinaptogénesis:
- Crecimiento axonal y dendrítico: Los factores neurotróficos estimulan el crecimiento y la ramificación de axones y den- dritas, facilitando que las neuronas encuentren y establezcan contacto con sus células diana.
- Estabilización sináptica: Tras la formación inicial del con- tacto sináptico, la presencia continua de factores como el BDNF refuerza la sinapsis mediante la potenciación a largo plazo (LTP), promoviendo la plasticidad sináptica y la conso- lidación de las conexiones (15).
- Señalesdecrecimientoneuronal:
- Guía axonal: Moléculas como las ephrinas, semaforinas y netrinas guían el crecimiento axonal mediante señales de atracción o repulsión. Estas señales actúan sobre los conos de crecimiento de los axones, estructuras dinámicas en las pun- tas de los axones que detectan y responden a estas señales para dirigir el axón hacia su objetivo correcto (16).
- Formación de contactos sinápticos: Una vez que los axo- nes alcanzan sus objetivos, se forman contactos sinápticos que son inicialmente inestables. Las señales de contacto y las interacciones con moléculas de adhesión, como cadhe- rinas y protocadherinas, facilitan la estabilización de estas conexiones (17).
- Cascadasdeseñalizaciónintracelular:
- Vías de señalización MAPK/ERK y PI3K/AKT: Estas vías son fundamentales para la traducción de las señales externas en respuestas celulares internas. La activación de la vía MAPK/ ERK contribuye a la expresión de genes que promueven la síntesis de proteínas sinápticas, mientras que la vía PI3K/ AKT favorece la supervivencia neuronal y la plasticidad (14).
Relevancia del mecanismo en el desarrollo prenatal
El equilibrio y la disponibilidad de estos factores neurotró- ficos y señales de crecimiento son críticos para un desarrollo sináptico adecuado. Una deficiencia en la expresión o función de estos factores puede resultar en una menor cantidad de sinapsis o en sinapsis disfuncionales, contribuyendo a tras- tornos del desarrollo neurológico como el autismo y la esquizofrenia (18).
La proliferación y diferenciación neuronal son procesos que preceden y acompañan a la sinaptogénesis, asegurando que el cerebro tenga la cantidad adecuada de neuronas y que es- tas estén preparadas para establecer conexiones funcionales. La sinaptogénesis se intensifica rápidamente en el tercer tri- mestre de gestación, coincidiendo con un período crítico de proliferación y diferenciación neuronal que contribuye al esta- blecimiento de redes neuronales funcionales.
Proliferación neuronal
- Definición y contexto: La proliferación neuronal es el pro- ceso mediante el cual las células progenitoras se dividen y ge- neran nuevas neuronas en la zona ventricular del tubo neural. Este proceso es especialmente activo en el segundo trimestre y continúa en menor medida hasta el tercer trimestre.
- Importancia en la sinaptogénesis: La proliferación de neuro- nas proporciona la base necesaria para la formación de sinap- sis. A medida que se generan nuevas neuronas, estas migran a sus destinos específicos en el cerebro y comienzan a desarrollar dendritas y axones, preparándose para la sinaptogénesis (19).
Diferenciación neuronal
- Proceso de diferenciación: Durante la diferenciación, las cé- lulas neuronales adquieren características específicas que les permiten realizar funciones especializadas. Este proceso impli- ca la expresión de proteínas específicas y el desarrollo de los componentes estructurales de la neurona, como las dendritas y axones, que son necesarios para la formación de sinapsis.
- Influencia en la sinaptogénesis: La diferenciación permite a las neuronas formar conexiones funcionales. Las neuronas que alcanzan sus posiciones finales en la corteza cerebral y otras áreas del cerebro comienzan a formar sinapsis con otras células cercanas, creando las bases de las redes neuronales que sosten- drán funciones cognitivas y motoras básicas al nacimiento (5).
Intensificación de la sinaptogénesis en el tercer trimestre
- Aumento de la sinaptogénesis: En el tercer trimestre, la sinaptogénesis se intensifica significativamente debido al aumento de la actividad neuronal y al ambiente enriquecido intrauterino. Durante este periodo, las neuronas recién for- madas y diferenciadas establecen rápidamente conexiones sinápticas en respuesta a las señales neurotróficas y al creci- miento general del cerebro.
- Formación de redes neur|onales: Las sinapsis formadas du- rante esta etapa permiten que se desarrollen circuitos neuro- nales básicos que serán esenciales para la función del recién nacido. Por ejemplo, los reflejos básicos y las respuestas sen- soriales comienzan a consolidarse en esta etapa, preparándo- se para la adaptación al entorno externo tras el nacimiento.
Mecanismos moleculares implicados
- Factores de crecimiento y neurotrofinas: Proteínas como el BDNF y el NGF no solo apoyan la supervivencia de las neuronas, sino que también promueven la diferenciación y la sinaptogéne- sis. Estas moléculas actúan sobre los receptores de tirosina qui- nasa (Trk), activando cascadas de señalización que estimulan la extensión de axones y la formación de sinapsis (14).
- Plasticidad dependiente de la actividad: Durante el tercer trimestre, la actividad eléctrica espontánea de las neuronas también juega un papel crucial en la estabilización de las si- napsis. Las sinapsis que reciben más actividad se fortalecen, mientras que las que tienen menor actividad pueden ser eli- minadas posteriormente durante la poda sináptica postnatal.
Relevancia para el desarrollo postnatal
El establecimiento de redes neuronales sólidas durante el tercer trimestre es crucial para la preparación del cerebro para el nacimiento. Estas conexiones iniciales permiten que el re- cién nacido tenga respuestas básicas a estímulos sensoriales y pueda iniciar un rápido aprendizaje y adaptación en el en- torno postnatal.
- Desarrollo cognitivo y sensorial inicial: Las sinapsis forma- das en esta etapa contribuyen a la capacidad del recién nacido para procesar información sensorial y responder a ella, sentan- do las bases para el desarrollo cognitivo y motor temprano (5).
- Potencial de adaptación postnatal: Un cerebro con una si- naptogénesis adecuada en el tercer trimestre tiene una mayor capacidad de adaptación y aprendizaje tras el nacimiento, fa- cilitando la plasticidad cerebral y el desarrollo de funciones más complejas durante la infancia y la niñez.
Las neurexinas y neuroligina son proteínas clave que desem- peñan un papel fundamental en la formación, estabilización y función de las sinapsis, lo que es crucial para el desarrollo y la plasticidad cerebral. A continuación, se explica su impor- tancia en el proceso de sinaptogénesis:
Función de las neurexinas
- Definición y estructura: Las neurexinas son proteínas de membrana que se encuentran en la terminal presináptica de las neuronas. Existen en múltiples isoformas (neurexinas a y
b), que se generan mediante un complejo proceso de “spli-
cing” alternativo (18).
- Rol en la formación sináptica: Las neurexinas actúan como moléculas de adhesión que median la interacción entre la neuro- na presináptica y la postsináptica. Estas proteínas son esencia- les para organizar la maquinaria sináptica en la terminal presi- náptica, facilitando la liberación de neurotransmisores (11, 18).
- Interacciones con Neuroligina: Las neurexinas forman com- plejos con las neuroligina en la hendidura sináptica, lo que ayuda a estabilizar la sinapsis y a mantener la alineación ade- cuada entre las neuronas pre y postsinápticas (11).
Función de las neuroligina
- Definición y Estructura: Las neuroligina son proteínas de membrana localizadas en la superficie postsináptica de las neuronas. También presentan diversas isoformas que se aso- cian con tipos específicos de sinapsis, como las sinapsis exci- tatorias e inhibitorias.
- Estabilización de la sinapsis: Las neuroligina se unen a las neurexinas para formar un puente de adhesión sináptica. Esta in- teracción contribuye a la diferenciación de la sinapsis, aseguran- do que las proteínas receptoras y las proteínas de señalización es- tén correctamente posicionadas en la membrana postsináptica.
- Regulación de la función sináptica: Las neuroligina no solo estabilizan las sinapsis, sino que también participan en la mo- dulación de la eficacia sináptica. Las interacciones neurexi- na-neuroligina son fundamentales para la plasticidad sináptica y la capacidad del cerebro para adaptarse a nuevas experiencias.
Mecanismo de acción en la formación y es- tabilización de sinapsis
- Interacción neurexina-neuroligina: Durante la formación de una nueva sinapsis, las neurexinas en la membrana presináptica se unen a las neuroligina en la membrana postsináptica. Esta unión induce la acumulación de proteínas de andamiaje, como PSD-95 en la sinapsis excitatoria, que ayuda a anclar los receptores de neurotransmisores (como los receptores de glutamato).
- Señalización bidireccional: La interacción neurexina-neu- roligina facilita una señalización bidireccional que activa cas- cadas de señalización intracelular en ambas neuronas. Esta señalización conduce a cambios en la organización del cito- esqueleto y la estabilización de la sinapsis, promoviendo su maduración y funcionalidad (20).
Relevancia clínica
- Trastornos del neurodesarrollo: Mutaciones en los genes que codifican las neurexinas y neuroligina se han asociado con diversos trastornos del neurodesarrollo, como el Trastorno del Espectro Autista (TEA) y la esquizofrenia. Estas altera- ciones pueden llevar a un desequilibrio en la proporción de sinapsis excitatorias e inhibitorias, afectando la comunicación neuronal y la función cerebral global (11).
- Implicaciones terapéuticas: La comprensión de las inte- racciones neurexina-neuroligina ha abierto nuevas vías para el desarrollo de tratamientos que modulen la formación y es- tabilización de sinapsis, lo que podría tener aplicaciones en la intervención de trastornos como el TEA y otras condiciones relacionadas con la conectividad sináptica.
Referencias bibliográficas
- 1. I. Kostovic, G. Sedmak, M. Judas, Neural histology and neurogenesis of the human fetal and infant brain. Neuroimage. 2019 (188) 743-
773.
- 2. B. Lu, BDNF and activity-dependent synap- tic modulation, Learn. Mem. 10 (2003) 86–98.
- 3. C. Qi, L.D. Luo, I. Feng, S. Ma, Molecular mechanisms of synaptogenesis. Front Synaptic Neurosci. 14 (2022) 939793.
- 4. C. Monk, C. Lugo-Candela, C. Trumpff, Fe- tal programming of infant behavioral reactivity, Neuropsychopharmacology, 37(2012) 195-
206.
- 5. P.R. Huttenlocher, Synaptic density in human frontal cortex – developmental changes and effects of aging, Brain Res. 163(1979)195- 205.
- 6. S. Asadi, F.H. Bloomfield, J.E. Harding JE, Nutrition in late preterm infants, Semin Perina- tol. 43 (2019) 15116.
- 7. C. Buss, S. Entringer, J.M. Swanson, P.D. Wadhwa, The role of stress in brain develop-
ment: The gestational environment’s long-term effects on the brain, Cerebrum (2012) 4.
- 8. J.L. Conel, The Postnatal Development of the Human Cerebral Cortex, Cambridge, MA, Harvard University Press (1939–1967)
- 9. P.R. Huttenlocher, C. de Courten, The de- velopment of synapses in striate cortex of man, Human Neurobiology, 6 (1987) 1–9.
- 10. P.R. Huttenlocher, A.S. Dabholkar, Regio- nal differences in synaptogenesis in human ce- rebral cortex, Journal of Comparative Neurology 387 (1997) 167–78.
- 11. T.C. Sudhof, Neuroligins and neurexins link synaptic function to cognitive disease. Na- ture 455(2008) 903-911.
- 12. S.M. Schulzke, S.K. Patole, K. Simmer K, Long-chain polyunsaturated fatty acid su- pplementation in preterm infants, Database Syst Rev. 16 (2011) CD000375.
- 13. M. Galbally, S.J. Watson, M. Lappas,
E.R. de Kloet, E. van Rossum, C. Wyrwoll, P. Mark, A.J. Lewis. Fetal programming pathway from maternal mental health to infant cortisol functioning: The role of placental 11beta-HSD2
mRNA expression, Psychoneuroendocrinolo- gy127 (2021):105-197.
- 14. E.J. Huang, L.F. Reichardt LF, Trk recep- tors: roles in neuronal signal transduction, Annu Rev Biochem. 72 (2003) 609-642.
- 15. H. Park, M.M., Neurotrophin regulation of neural circuit development and function, Nat Rev Neurosci. 14(2013) 7-23.
- 16. A. Vallstedt, K. Kullander, Dorsally derived spinal interneurons in locomotor circuits. Ann N Y Acad Sci. 1279 (2013)32-42.
- 17. H. Togashi, K. Abe, A. Mizoguchi, K. Takaoka, O. Chisaka, M. Takeichi, Cadherin-me- diated cell-cell adhesion and signaling, Biochem Biophys Res Commun. 296(2002)1095-1101.
- 18. B. Kolb, R. Mychasiuk, A. Muhammad,
Y. Li, D. O. Frost, R. Gibb, Experience and the developing prefrontal cortex. Proc Natl Acad Sci U S A. 17 (2012)186-93.
- 19. P. Rakic, Specification of cerebral cortical areas, Science 1988;241(4862):170-176.
- 20. A.M. Craig, Y. Kang, Neurexin-neuroligin signaling in synapse development, Curr Opin Neurobiol. 17(2007) 43-52.






No comments! Be the first commenter?