Las alucinaciones son alteraciones de la percepción sensorial sin un estímulo externo evidente. Estas son cuadros complejos que involucra un procesamiento informativo cortical-subcortical total casi similar al sueño REM. Habría dos tipos de alucinaciones según el mecanismo y contexto involucrado, las oníricas y las psicóticas. Las primeras serían como un sueño vívido en el que el sujeto percibe que lo que le sucede no es real. Este tipo sería provocado por alucinógenos de mecanismo serotonérgico o glutamatérgico. Las segundas presentan contenidos desordenados pero muy nítidos por lo que el sujeto no se da cuenta que está alucinando. Este tipo serían las típicas de la esquizofrenia o las causadas por sustancias de mecanismo dopaminérgico. Teniendo en cuenta que los receptores CB1 pueden formar heterodímeros con receptores 5-HT2A y D2 postulamos si este pudiese ser el mecanismo molecular por el cual los compuestos cannábicos inducen alucinaciones.
Palabras clave
CB1 – 5-HT2A – D2 – Alucinaciones – Cannabis.
Serra HA. “Nuevas hipótesis sobre efectos alucinógenos del cannabis, una revisión sobre posibles mecanismos circuitales y moleculares ”. Psicofarmacología 2024;136:4-12. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
Las alucinaciones son alteraciones de la percepción sensorial sin un estímulo externo evidente, pero para quien las padece son reales en forma más o menos convincente, esto significa que estos individuos le atribuyen al proceso una fuente externa a pesar de su génesis interna (1). Hay un sesgo en la definición del término tal vez por desconocimiento fisiopatológico, porque desde el punto de vista semántico un síndrome vertiginoso o un miembro fantasma son alucinaciones; y, sin embargo, no son consideradas tales, sino que el interés
en las alucinaciones suele centrarse cuando se dan en la esfera auditiva o visual acompañando a las enfermedades mentales.
Según Behrendt la percepción surge de la sincroni- zación de las oscilaciones bioeléctricas gamma (ritmos electroencefalográficos registrados en la frecuencia de 40-50 Hz) en las redes talamocorticales establecidas con las cortezas sensoriales primarias, y sugiere que en los pacientes con esquizofrenia la modulación de tal actividad gamma talamocortical está alterada; esto permitiría que tales oscilaciones funcionen aun en ausencia de estímulos sensoriales concretos provocando fenómenos alucinatorios (2).
Sin embargo, un cuadro alucinatorio es un fenómeno complejo que involucra no solo las cortezas primarias sensitivas sino un procesamiento cortical-subcortical total, tal vez equivalente al procesamiento durante el sueño REM. Por ello, el atribuir la alucinación única- mente a las redes talamocorticales cuenta solo una parte de la historia ya que la actividad de estas redes se complementa con la de otros dos fenómenos indi- solublemente asociados, la valoración-expectativa auto- mática subcortical ante la percepción de nueva infor- mación o la reformulación de la preexistente y el foco atencional o spot que otorga al procesamiento continuo su diferenciación particular o concientización.
La valoración-expectativa y todo el despliegue emo- cional-actitudinal que la rodea estaría dada por inte- racción de los circuitos mesolimbocorticales y amig- dalinos, mientras que el foco atencional se debería preferentemente a la activación colinérgica proveniente de los núcleos basales del cerebro anterior más la de los sistemas aminérgicos del tronco encefálico (3, 4). Para resumir lo antedicho, nuestro sistema nervioso en las buenas y en las malas sería una suerte de sincicio funcional que procesa toda la información en un conti- nuum espacio-tiempo flexible y dinámico (5).
El consumo recreativo de cannabis va en aumento. Existen pruebas que dicho consumo en la población general causa sintomatología psicótica, entre ellas alucinaciones (6-9), relación que es específica y no depende de la presencia previa de otro cuadro psiquiátrico (10). Subsecuentemente se demostró que el responsable de estos cuadros era el fitocannabinoide psicoactivo Δ9-te- trahidrocannabinol (THC), uno de los componentes mayoritarios del cannabis (11). Como contrapartida, los preparados con mayor contenido de cannabidiol (CBD), el otro componente mayoritario, producirían supuesta- mente menos síntomas psiquiátricos entre los consumi- dores. Tal apreciación condujo a sugerir que el CBD ex- hibía propiedades antipsicóticas antagonizando al THC
(12) lo que se explicaría porque el THC es un agonista total CB1 mientras que el CBD es un agonista parcial
(13). Sin embargo, dos revisiones sistemáticas mostra- ron que no era recomendable usar cannabis medicinal o CBD en pacientes con esquizofrenia (14, 15).
De acuerdo con el mecanismo fármaco-toxicológico y al contexto donde aparecen, podrían considerarse dos tipos de alucinaciones, las oníricas y las psicóticas
(16). Las primeras tienden a experimentarse como un sueño vívido en el que el sujeto percibe que está aluci- nando o lo que padece no es real. Este tipo sería desen- cadenado por alucinógenos de mecanismo serotonérgi- co (agonistas parciales puros o selectivos 5-HT2A como
la psilocibina) o glutamatérgico (bloqueantes parciales
del canal NMDA sobre el sitio sigma como la fenciclidi- na). Las segundas tienden a ser desordenadas, pero con contenido tan nítido que el sujeto no se da cuenta que está alucinando, sino que las vivencia como reales. Este tipo serían las típicas de la esquizofrenia o las desenca- denadas por sustancias de mecanismo dopaminérgico (agonistas totales D2 como el LSD y otras ergolinas). Teniendo en cuenta que los receptores CB1 pueden for- mar heterodímeros con los 5-HT2A y D2 (17, 18), nos preguntamos si este sería el mecanismo por el cual los compuestos cannábicos inducen alucinaciones y en base a esto cuál sería el tipo resultante más frecuente.
Por lo tanto, el objetivo principal de este trabajo es brindar una explicación molecular sobre la génesis de las alucinaciones en el contexto del consumo de cannabis. Secundariamente, se pretende analizar como interac- túan los distintos receptores acoplados a las proteínas G (GPCR) en un entorno circuital e integrar los fenómenos descriptos bajo la visión de la biología de sistemas.
El manejo y procesamiento de la información por los neurocircuitos, un panorama general
La información en general va circulando continua- mente por toda la corteza y estructuras subcorticales. Independientemente de su modalidad (sensorial, pro- cedural, cognitiva) va procesándose según las necesi-
dades del organismo para modelar su comportamiento y devenir, a la vez que se guarda lo importante y se va descartando el resto, así el olvido deja lugar a nuevos recuerdos. La nueva información ingresa por las corte- zas somestésicas primarias y olfatoria y tiende a conver- ger con mayor o menor grado de procesamiento hacia cortezas asociativas, emocionales y superiores mientras va fusionándose con la preexistente mediante la parti- cipación de los distintos ductos corticoestriatales (3) y el hipocampo.
Toda vez que los seres humanos procesamos infor- mación se produce automáticamente una valoración-ex- pectativa de la misma. Su relevancia surge cuando se extrae del ciclo automático y se coloca en un plano consciente, tal vez porque toda valoración va acompa- ñada de cierta carga de ansiedad ya que la amígdala advierte sobre posibles peligros ambientales, aun cuan- do no existan realmente. Si la expectativa se cumple sin importar su relevancia, hay una saliencia gratifican- te con hipertimia producto de la actividad del estriado ventral y su influencia sobre las cortezas emocionales (y según lo aprendido los individuos nos adjudicamos recompensas, aparece el buen humor y se calma nues- tra ansiedad) o a lo sumo, si el resultado del proceso es muy negativo, se da una extinción. Si, por el contrario, la expectativa no se cumple, hay una saliencia negati- va por no anulación amigdalina con hipotimia que es directamente proporcional a la relevancia adjudicada (aquí, los individuos podemos extinguir por reemplazo la ansiedad si consideramos que la importancia es baja, o podemos continuar ansiosos y temerosos, o en el peor de los casos, padecer fobias, mal humor, ira y frustra- ción intensa si creíamos que la relevancia era alta).
La rápida confluencia de toda información sobre las estructuras subcorticales como amígdala, estriado ven- tral e hipocampo y su valoración automática es una he- rencia evolutiva animal que, al provocar un alerta ins- tantáneo en el hipotálamo y tronco encefálico para la eventual lucha o huida, o bien una activación del estria- do ventral para eventualmente frenar el alerta o gratifi- car una situación dada, genera las condiciones necesa- rias para la supervivencia ante la hostilidad del entorno (resiliencia). Por demás, bajo nuevas hipótesis, en el ser humano el fracaso de este procesamiento primitivo en favor del estrés continuo sería un condicionante de los trastornos de ansiedad y del humor, mientras que su fracaso en favor de la gratificación continua sería un
elemento hacia las adicciones.
La corteza recibe información de la propia corteza, del tálamo, de los núcleos aminérgicos mesencefálicos (sis- tema modulador difuso), del sistema activador colinérgi- co del cerebro anterior y desde el hipotálamo lateral; la procesa y la devuelve de nuevo a la corteza, al tálamo, al cuerpo estriado, al hipocampo y amígdala, a varios nú- cleos del tronco y a las astas anteriores de la médula espinal, todo esto a través de los distintos tractos de sus- tancia blanca (19). Esta maraña de procesamiento está conformada por neuronas largas de proyección glutama- térgicas excitatorias o células principales que correspon- den al 80-85% del total, interneuronas GABAérgicas in- hibitorias cortas que suman el 15-20% restante, y fibras aferentes, eferentes y de interconexión (20). Debe recor- darse que las interneuronas GABAérgicas más abundan- tes son las células en Cesta que están integradas a los circuitos aferentes corticales para filtrar aún más la infor- mación y mejorar los mecanismos atencionales, y dentro de este subgrupo, las CCK positivas son las que expresan la mayoría receptores cannabinoides CB1 (21).
Al tomar en cuenta lo mencionado bajo una con- cepción unificadora, una determinada tarea procesal que encare el sistema sería llevada a cabo por grupos neuronales redundantes de tal modo que su pérdida parcial (por diversos procesos fisiológicos y/o patológi- cos) podría ser compensada aceptablemente, siempre y cuando se conserve una conectividad suficiente que no afecte el continuum de las redes establecidas entre todos sus componentes (22). No obstante, a los fines prácticos más allá del tal continuum debemos para el análisis enfocar la actividad de ciertas estructuras sin desmedro de las demás.
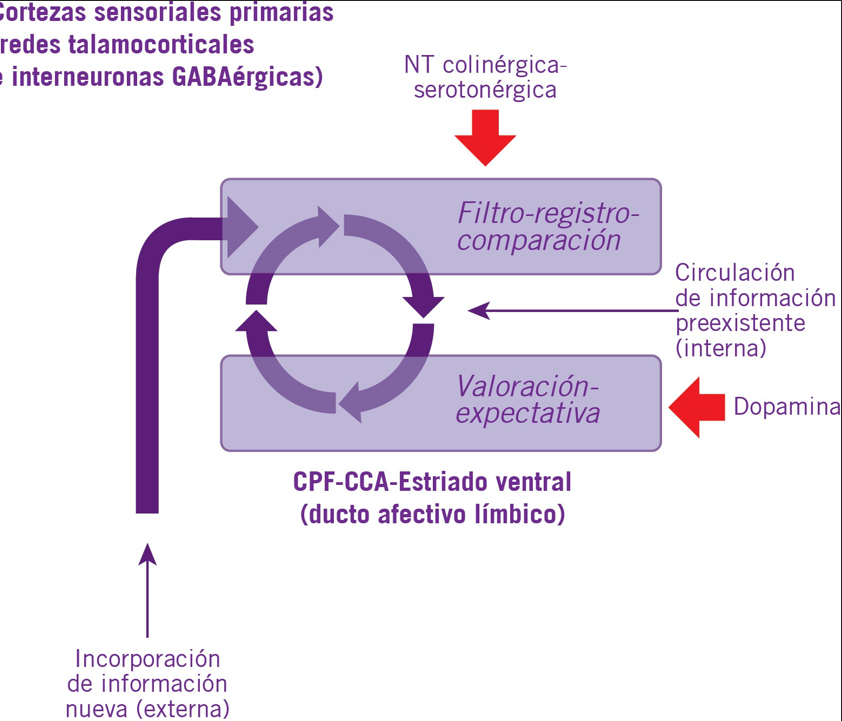
Así, las cortezas sensoriales primarias establecen el proceso principal de entrada de nueva información, mientras que la prefrontal y cingulada anterior hacen la valoración informativa automática por sus vínculos con el estriado ventral y otras estructuras del ducto afectivo límbico (Figura 1).
Las redes talamocorticales son conexiones de ida y vuelta que resultan sumamente importantes para la percepción e incorporación informativa en general (2). Su función es facilitar el flujo de información entre el tálamo y las cortezas a través de estímulos recíprocos y sincrónicos; estímulos que se filtran y direccionan gra-
cias a las interneuronas GABAérgicas mencionadas que operan en conjunto con los sistemas monoaminérgicos y colinérgicos, para producir constantemente estados cognitivos sobre la información circulante. La percep- ción y acceso de nueva información sensorial más la circulación constante de la información interna ya pro- cesada es un devenir continuo que construye nuestra conciencia reflexiva.
De la misma forma, distintas zonas en la corteza pre- frontal (CPF) y cingulada anterior (CCA) van alternado en la valorización-expectativa ante el devenir informa- tivo en un ida y vuelta indirecto con el estriado, es- pecialmente ventral, y tálamo-núcleos dopaminérgicos mesencefálicos (23). La CPF ventromedial evalúa situa- ciones rápidamente, a menudo justo antes o durante su ocurrencia; la corteza orbitofrontal (COF) compara
ideas preconcebidas con la realidad y en función de los resultados genera saliencias gratificantes, finalmente el área dorsal de la CCA es un nodo entre los circuitos de acción-motores con los de gratificación por prove- nientes de la COF (recompensa ligada a la selección de acciones y tareas). Los v ínculos con la cubierta del núcleo accumbens desde la CPF ventromedial o las re- giones centrales y laterales del estriado ventral desde la COF cierra el círculo permitiéndole a la CCA vincularse con el estriado dorsal para producir salidas cognitivo motoras y procedurales.
Aspectos moleculares y farmacodinámicos en la profundidad de los neurocircuitos
Como hemos comentado en la introducción, las alu- cinaciones inducidas por sustancias de abuso recono- cerían entre otros mecanismos serotonérgicos o dopa-
Figura 1
Modelo de incorporación y procesamiento informativo a lo largo de la vida. El lienzo en blanco que es nuestro cerebro se va llenando de información relevante para nuestro devenir y esta circula y se renueva con lo recientemente incorporado de tal manera de conformar nuestra conciencia reflexiva.
minérgicos (16). En esa línea, los agonistas parciales 5-HT2A como la psilocibina o los agonistas totales D2 como el LSD* y otras ergolinas, resultan alucinógenos potentes. Pero si el THC actúa sobre los receptores CB1 como sería posible que pudiese producir efectos atri- buibles a otros receptores.
Los receptores 5-HT2A, D2 y CB1 son receptores aco- plados a proteínas G (GPCR), la mayor superfamilia de receptores con más de 800 miembros (24). Los miem- bros de esta familia pueden asociarse en heterodímeros (17, 18, 25). Sin embargo, existen diferencias sustan- ciales en la ubicación y cantidades de estos receptores a lo largo del sistema nervioso central (SNC) por lo que pueden colocalizarse solamente en neuronas de regio- nes específicas.
Los receptores CB1 son los GPCR más abundantes del SNC, incluso equiparables en cantidad a los recep- tores ionotrópicos NMDA y GABAA (26). Sin embargo, su distribución no es pareja (27): la mayor cantidad se halla en la neocorteza, el hipocampo, la amígdala y el núcleo olfatorio anterior; le siguen el estriado, los núcleos septales y del cerebro anterior; por último, la menor cantidad de CB1 se halla en la corteza cerebe- losa, los núcleos antero dorsales y reticular del tálamo, la habénula, el hipotálamo anterior, ciertas regiones del tronco (sustancia gris periacuductal, núcleo dorsal del vago y área postrema) y el asta dorsal de la médula. En la corteza, hipocampo y amígdala el 90% se expresa específicamente en las interneuronas GABAérgicas CCK positivas (existiendo como una gran reserva de recepto- res ya que la mayoría es inactiva) y el 10% restante en las terminales excitatorias glutamatérgicas y aminérgi- cas como receptores presinápticos (21,26-28). En el estriado el 85% se expresa en todas las neuronas de proyección GABAérgicas espinosas medianas (MSSN), independientemente de su coexpresión fenotípica (vía directa o indirecta) y un 15% sobre interneuronas par- valbúmina positivas de regulación (27).
Los receptores 5-HT2A tienen una distribución más li- mitada en el SNC (29), aunque también la mayor can- tidad de ellos se expresa en la neocorteza, los núcleos mamilares hipotalámicos, las estructuras olfatorias, los núcleos pontinos y de los pares craneales; en menor me- dida se hallan en el hipocampo (células CA3), núcleo rojo, amígdala, estriado y sustancia negra pars compacta. En la corteza se encuentran sobre las células piramidales
*El LSD es tanto agonista parcial 5-HT2A como agonista D2.
de la capa V, en todo tipo de interneuronas GABAérgicas de las capas IV a VI, en otras células no piramidales de la capa VIb (postsinápticos) y también podrían ubicarse so- bre aferentes talámicos a la capa V (presinápticos) (30) y en astrocitos (31). En el estriado se hallan sobre las dendritas y somas de las MSSN y algunas neuronas del globo pálido (todos postsinápticos) (31) pero no sobre las neuronas grandes colinérgicas (32).
Los receptores D2 tienen una expresión central más limitada aún. Solo se hallan en el estriado, CPF, hipotá- lamo y acúmulos dopaminérgicos del tronco (especial- mente sustancia negra pars compacta, área tegmental ventral y área postrema). En el estriado tanto dorsal como ventral hallan sobre las MSSN de la vía indirecta como receptores postsinápticos, en sus aferentes gluta- matérgicos corticales como receptores presinápticos y en la propias terminales dopaminérgicas como autocep- tores presinápticos (33).
Los D2 y CB1 se acoplan a Gi por lo que su activación por sus ligandos endógenos, dopamina y 2-araquidonil- glicerol respectivamente, produce inhibición de la sín- tesis de AMPc (por inhibición de la adenilato ciclasa) e hiperpolarización (por apertura de canales de K+ opera- dos por proteínas G o GIRK y cierre de canales de Ca2+ tipo L) (34, 35). Por el contrario, los 5-HT2A se acoplan a Gq por lo que su activación por serotonina ocasiona la hidrólisis de fosfatidilinositol por la fosfolipasa A2 liberando inositol trifosfato (IP3) y diacilglicerol (DAG) que provocan una importante estimulación iónica (por aumento de Ca2+ citosólico) y metabólica (vía proteín kinasa C) (36).
Los receptores aminérgicos D2 y 5-HT2A por su loca- lización son moduladores de la actividad pre y postsi- náptica (sobre los terminales glutamatérgicos inhiben o estimulan la liberación de glutamato y sobre las den- dritas y somas postsinápticos la génesis de potenciales inhibitorios o excitatorios, respectivamente), y sobre las terminales de la vía mesolimbocortical los D2 inhiben la liberación de dopamina (37). En cambio, los CB1 pro- vocan inhibición celular inmediata, este mecanismo se aprovecha para inhibir en forma transináptica la neuro- transmisión glutamatérgica general a lo largo del SNC o facilitar la actividad de las neuronas principales en las estructuras que los contienen, por ejemplo, corteza o área tegmental ventral (26, 38, 39).
Los GPCR se oligomerizan; sin embargo, la forma más común es la dimérica. Esta forma homo o heterodiméri- ca da los receptores mayor estabilidad durante su vida útil y enriquece la capacidad de interacción con otras proteínas intracelulares como el citoesqueleto periódi- co, el organizador de la disponibilidad proteica de una membrana biológica (40). Los dímeros circulan mejor entre los compartimientos celulares y permanecen más tiempo en la membrana plasmática. Por el contrario, los monómeros sufren una rápida internalización-degra- dación. La unión de los agonistas favorece la estructura dimérica mientras que la de los antagonistas/agonistas inversos favorece la monomérica. De la misma forma el colesterol y otros lípidos de membrana son moduladores hacia la oligomerización o hacia la monomerización (41).
Los CB1 forman heterodímeros con otros GPCR como D2, 5-HT2A, Ox1 (orexina), A2A (adenosina) y los opioi- des MOR y DOR (17, 18, 42-44). Adicionalmente, los receptores 5-HT2A forman heterodímeros con 5-HT1A, 5-HT2C, mGlu2 (metabotropo glutamato), D2 y CRFR1 (hormona liberadora de ACTH) (25, 36). Y, por último, los receptores D2 forman heterodímeros con D1, D3, A2A, SST5 (somatostatina) y NTSR1 (neurotensina) (45, 46).
En los heterodímeros la respuesta final suele depen- der de uno de los agonistas presentes, predominancia que debe interpretarse como un sesgo en la selección de la señalización disponible para ellos (42). Por ejem- plo, junto a los CB1 los receptores 5-HT2A cambiarían su señal excitatoria Gq a inhibitoria Gi o Go como lo hacen en presencia de psilocibina (36) o los D2 pasa- rían de inhibir (respuesta Gi) a estimular las células postsinápticas (respuesta Gs que aumenta el AMPc). Adicionalmente podrían interactuar con otras proteínas intracelulares competidoras de la b-arrestina como CRI- P1a/b, SGIP1 y GASP1 retardando la endocitosis y otras señales CB1 a largo plazo que se desencadenan (43).
Los fitocannabinoides son agonistas CB1; debido a la presencia de anillos en su estructura se comportan como moléculas más rígidas que los agonistas endó- genos por lo que propiciarían dímeros sesgados, en principio parecidos a los naturales, pero no iguales. En suma, hay evidencias moleculares suficientes para considerar que los receptores CB1, D2 y 5-HT2A pue- dan asociarse en forma heterodimérica y justificar la aparición de alucinaciones en ciertos consumidores de cannabis.
Discusión y conclusiones
Si bien las alucinaciones pueden responder a múlti- ples causas tanto primarias, por ejemplo, deprivación sensorial, como secundarias, por ejemplo, consumo de sustancias de abuso o cuadros psicóticos (16), su de- sarrollo implica mecanismos complejos que probable- mente sean diferentes según el contexto. Para dilucidar su base neurobiológica con relación al consumo de can- nabis hemos presentado evidencias circuitales y farma- codinámicas que si bien sostienen ciertas posibilidades no hacen más que generar nuevas preguntas.
El determinar si son de tipo onírico, de tipo psicótico o de tipo mixto es una simplificación que permite con- siderar ciertos mecanismos fisiopatológicos que vale la pena explorar, pero para ello, deberían asumirse tres cosas y asociarlas:
- Qué es lo que ocurriría con la ideación durante el sueño REM ya que esto puede asemejarse a los fenó- menos alucinatorios.
- Cómo se procesaría el registro informativo de las per- cepciones por las redes talamocorticales y subcorticales.
- Cómo influirían los heterómeros CB1, 5-HT2A y D2, en el funcionamiento de tales redes.
La actividad onírica vívida ocurre durante el sueño REM. En esta etapa, el registro eléctrico cerebral es similar al de la vigilia (con ritmos rápidos y estrechos tipo beta y gamma). En ese instante se produciría entre todas las cortezas y regiones subcorticales un arreglo de información sensible, vital y necesaria para la supervi- vencia y homeostasis del organismo. Entonces, podría- mos especular que la función principal del dormir sería constituir o consolidar memorias útiles a largo plazo y borrar las innecesarias. Si los sueños dependen de las experiencias recientes y de los registros previos, lo que se sueña sería un ensamblaje de fragmentos discretos e incompletos de memorias que se fusionan para crear un nuevo relato o trama sintetizando la información. Como esta síntesis es libre, abierta y sin restricciones parece en muchas ocasiones delirante e ilógica. Es el delirio onírico que planteó Hobson que implica desorientación, amnesia, alucinosis visual y confabulación si los pa- cientes son despertados bruscamente o si exhiben cier- tos trastornos del sueño (47-49).
Si durante la vigilia se produce continuamente el re- gistro de lo nuevo y su comparación y valoración con lo
procesado (on line) para decidir-intuir lo supuestamen- te mejor, hechos que generan expectativa y cambios del humor. Durante el sueño REM el registro y comparación informativa desde el exterior se anula (off line), pero la selección y valoración informativa es más sólida pues se establecería el conexionado neuroplástico que se tradu- cirá en un aprendizaje efectivo.
Entonces podría decirse que la circuitería o redes res- ponsables del registro e incorporación informativa se- rían puramente corticales (redes talamocorticales), pero las responsables de su comparación-valoración serían corticales-subcorticales (circuitos mesolimbocorticales, ducto afectivo límbico), automatizándose en la vigilia y consolidándose en el sueño.
Teniendo en cuenta lo relatado, las alucinaciones de tipo onírico surgirían como una alteración del registro perceptual a nivel cortical, pero conservando el con- texto y la valoración informativa con lo cual el indivi- duo puede concebir que está alucinando. En cambio, las de tipo psicótico surgirían como una alteración de la circulación y valoración de la información interna (a nivel cortical-subcortical) con lo cual el individuo perci- be un exceso informativo inexistente o no relevante, que se traduciría en imágenes, voces o representaciones más
complejas no reales, pero sumamente relevantes para él (Figura 2).
El aspecto molecular de las alucinaciones apunta a la alteración directa de la neurotransmisión aminérgica o glutamatérgica en cualquiera de sus pasos (síntesis, al- macenamiento, liberación, efecto y terminación) por las sustancias de abuso. En el contexto del consumo de can- nabis, el THC, al ser agonista exógeno de los receptores CB1, es capaz de modificar estas neurotransmisiones y, en individuos predispuestos, provocar cuadros alucinato- rios puesto que los CB1 se hallan ampliamente distribui- dos en el SNC para modular el funcionamiento nervioso general.
Si bien el mecanismo final no se conoce aún, es po- sible especular con que la heterodimerización de los CB1 con receptores de “receptores que median cuadros alucinatorios” como los 5-HT2A y los D2 comprobada en modelos animales y células de prueba (17, 18, 26, 43) podría ser la base molecular que justifique las aluci- naciones por cannabis. Sin embargo, en la corteza los receptores CB1 y 5-HT2A casi no coinciden, los primeros se expresan en su gran mayoría sobre las interneuronas GABAérgicas en Cesta CCK positivas que suelen residir en las capas II a IV, mientras que los segundos se
Figura2
Los modelos de alucinación tras la falla de alguno de los procesamientos informativos: Izquierda, las alucinaciones oníricas serían producto de una falla en la incorporación de información nueva o reciente y propiciadas por un mecanismo serotonér- gico. Derecha, las alucinaciones psicóticas serían resultado de una falla en la valoración de información tanto reciente como reciclada y propiciadas por un mecanismo dopaminérgico. Los fitocannabinoides psicoactivos podrían causarlas a través de la heterodimerización CB1-D2 sobre la vía indirecta en el estriado ventral.
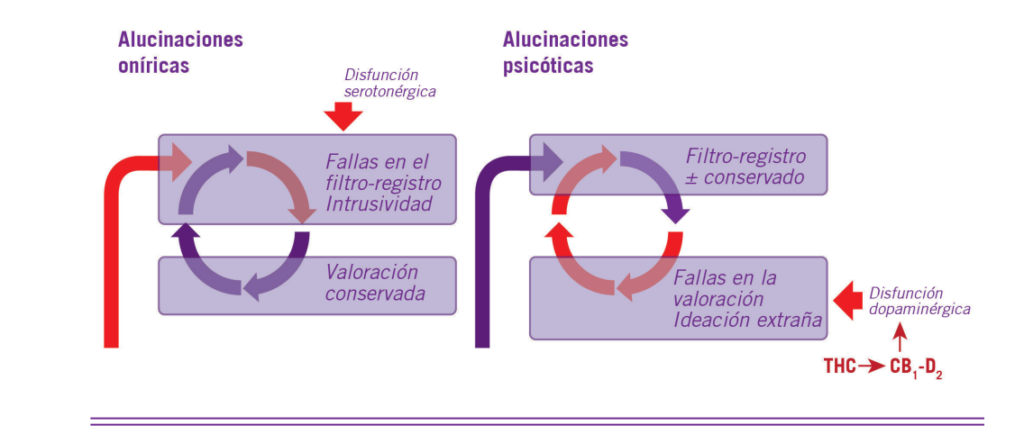
ubican sobre las células piramidales de la capa V y en todos los tipos de interneuronas GABAérgicas de las ca- pas IV a VI. En cambio, sí coinciden en el estriado dor- sal y ventral los tres tipos de receptores; especialmente los D2 y CB1 sobre las MSSN de proyección de la vía indirecta (postsinápticos) y las terminales dopaminérgi- cas (presinápticos) que las sirven (18, 33).
Ahora bien, los agonistas CB1 y D2 actuando solos producen inhibición celular vía Gi, pero como las alu- cinaciones tienen un corte excitatorio podría especular- se que los fitocanabinoides, como estructuras rígidas que son, promueven heterómeros CB1-D2 particulares y, a través de ellos, serían responsables de producir un agonismo sesgado desplazando las señales inhibitorias individuales a excitatorias globales vía Gs (25) que re- produzcan los efectos de otros alucinógenos.
La salida final del estriado por el globo pálido inter- no y estructuras asociadas es inhibitoria del tálamo y ciertas estructuras mesencefálicas (p ej., núcleo rojo, núcleos vestibulares) por lo que podría ser un filtro para el reciclaje informativo subcortical, filtro que permitie- se por ejemplo, que el ducto afectivo límbico inhiba los alertas ansiogénicos excesivos de la amígdala. Como esta salida es a su vez inhibida por la vía directa (con aumento del flujo informativo) y favorecida por la vía in- directa (con freno al flujo informativo), ambas controla- das por la dopamina a través de sus receptores D1 y D2
respectivamente (3), podría especularse entonces que los dímeros CB1-D2 causan una disfunción temporal de la vía indirecta (y falla del filtro propuesto) permitiendo la inserción en el devenir informativo de constructos sin valor aparente como si fuese información vital y ello con- tribuiría a que el efecto alucinógeno padecido sea de tipo psicótico remedando el ocasionado por ergolinas.
En suma, la biología de sistemas nos muestra tres niveles probables de operación del THC al inducir alu- cinaciones, el social-individual donde los individuos padecen el fenómeno alucinatorio con consecuencias dispares aunque potencialmente peligrosas para ellos o el entorno social; el orgánico-tisular donde los neurocir- cuitos subcorticales son forzados apreciar información vana o intrusivo-imperativa, y el celular-moleculardonde los posibles heterodímeros con el receptor CB1 causan las modificaciones excitatorias que interferirían en el procesamiento informativo.
Cualquiera sea el nivel estudiado sus vínculos con los demás son inextricables pues la disfunción de cualquie- ra de ellos repercute en el todo, causando los trastor- nos alucinatorios en individuos sensibles al consumo de cannabis. En principio, por los mecanismos y circuitos descriptos las alucinaciones serían psicóticas o, a lo sumo, mixtas psicótico-oníricas. El desplazamiento ha- cia una forma u otra sería función de las características vitales e idiosincráticas de los consumidores..
Referencias bibliográficas
- 1. Boska P. On the neurobiology of hallucina- tions. J Psychiatry Neurosci 2009; 34: 260-2.
- 2. Behrendt RP. Dysregulation of thala- mic sensory “transmission” in schizophrenia: Neurochemical vulnerability to hallucinations. J Psychopharmacol 2006; 20: 356-72. doi: 10.1177/0269881105057696.
- 3. Fadel DO, Zieher LM. Capítulo 4 Procesa- miento de la señalización en el sistema nervio- so central. En: Zieher LM, Alvano SA, Fadel DO, Iannatuono RF, Serra HA, eds. Psiconeurofar- macología Clínica y sus Bases Neurocientíficas 3ra ed. Buenos Aires: Ursino 2003; pp 49-78.
- 4. Fadel DO, Zieher LM, Serra HA. Capítulo
21 Neurotransmision colinergica. En: Zieher LM, Alvano SA, Fadel DO, Iannatuono RF, Se- rra HA, eds. Psiconeurofarmacología Clínica y sus Bases Neurocientíficas 3ra ed. Buenos Ai- res: Ursino 2003; pp 405-20.
- 5. Basar E, Düzgün A. The CLAIR model:
Extension of Brodmann areas based on brain oscillations and connectivity. Int J Psychophy- siol 2016; 103:185-98. doi: 10.1016/j.ijpsy- cho.2015.02.018.
- 6. van Os J, Bak M, Hanssen M, Bijl RV, de Graaf R, Verdoux H. Cannabis use and psy- chosis: A longitudinal population-based study. Am J Epidemiol 2002; 156: 319-27. doi: 10.1093/aje/kwf043.
- 7. Ben Amar M, Potvin S. Cannabis and psychosis: What is the link? J Psy- choactive Drugs 2007; 39: 131-42. doi: 10.1080/02791072.2007.10399871.
- 8. Henquet C, Krabbendam L, de Graaf R, ten Have M, van Os J. Cannabis use and expres- sion of mania in the general population. J Affect Disord 2006; 95: 103-10. doi: 10.1016/j. jad.2006.05.002.
- 9. Johns A. Psychiatric effects of cannabis. Br J Psychiatry 2001; 178: 116-22. doi:10.1192/ bjp.178.2.116.
- 10. Ferdinand RF, van der Ende J, Bon-
gers I, Selten JP, Huizink A, Verhulst FC. Cannabis–psychosis pathway independent of other types of psychopathology. Schizophr Res 2005; 79: 289-95. doi: 10.1016/j.
schres.2005.07.027.
- 11) D’Souza DC, Perry E, MacDougall L, Am- merman Y, Cooper T, Wu YT, Braley G, Gueor- guieva R, Krystal JH. The psychotomimetic effects of intravenous delta-9-tetrahydrocan- nabinol in healthy individuals: Implications for psychosis. Neuropsychopharmacology 2004;
29: 1558-72. doi: 10.1038/sj.npp.1300496.
- 12. Leweke FM, Rohleder C, Gerth CW, Hell- mich M, Pukrop R, Koethe D. Cannabidiol and amisulpride improve cognition in acute schi- zophrenia in an explorative, double-blind, ac- tive-controlled, randomized clinical trial. Front Pharmacol 2021; 12: 614811. doi: 10.3389/ fphar.2021.614811.
- 13. Friedman D, Devinsky O. Cannabinoids in the treatment of epilepsy. N Engl J Med 2015; 373: 1048-58. doi: 10.1056/NE-
JMral407304.
- 14. Hindley G, Beck K, Borgan F, Ginestet CE, McCutcheon R, Kleinloog D, Ganesh S, Radhakrishnan R, D’Souza DC, Howes OD. Psy- chiatric symptoms caused by cannabis cons- tituents: A systematic review and meta-analy- sis. Lancet Psychiatry 2020; 7:344-53. doi: 10.1016/S2215-0366(20)30074-2.
- 15. Ahmed S, Roth RM, Stanciu CN, Bru- nette MF. The impact of THC y CBD on schi- zophrenia: A systematic review. Front Psy- chiatry 2021; 12: 694394. doi: 10.3389/ fpsyt.2021.694394.
- 16. Jalal B. The neuropharmacology of sleep paralysis hallucinations: Serotonin 2A activa- tion and a novel therapeutic drug. Psychophar- macology-Berl 2018; 235: 3083-91. doi: 10.1007/s00213-018-5042-1.
- 17. Viñals X, Moreno E, Lanfumey L, Cordomí A, Pastor A, de La Torre R, Gasperini P, Na- varro G, Howell LA, Pardo L, Lluís C, Canela EI, McCormick PJ, Maldonado R, Robledo P. Cognitive impairment induced by delta9-tetra- hydrocannabinol occurs through heteromers be- tween cannabinoid CB1 and serotonin 5-HT2A receptors. PLoS Biology 2015; 13: e1002194. doi: 10.1371/journal.pbio.1002194.
- 18. Bagher AM, Laprairie RB, Toguri JT, Kelly MEM, Denovan-Wright EM. Bidirectional allos- teric interactions between cannabinoid receptor 1 (CB1) and dopamine receptor 2 long (D2L) heterotetramers. Eur J Pharmacol 2017; 813:
66-83. doi: 10.1016/j.ejphar.2017.07.034.
- 19. Bullock DN, Hayday EA, Grier MD, Tang W, Pestilli F, Heilbronner SR. A taxonomy of the brain’s white matter: Twenty-one major tracts for the 21st century. Cereb Cortex 2022; 32: 4524-48. doi: 10.1093/cercor/bhab500.
- 20. Meyer HS, Schwarz D, Wimmer VC, Sch- mitt AC, Kerr JND, Sakmann B, Helmstaedter
M. Inhibitory interneurons in a cortical column form hot zones of inhibition in layers 2 and 5A. Proc Natl Acad Sci 2011; 108: 16807-12. doi: 10.1073/pnas.11136481.
- 21. Tremblay R, Lee S, Rudy B. GABAergic interneurons in the neocortex: From cellular properties to circuits. Neuron 2016; 91: 260-
- doi: 10.1016/j.neuron.2016.06.033.
- 22. Herbet G, Duffau H. Revisiting the func- tional anatomy of the human brain: Toward a metanetworking theory of cerebral functions. Physiol Rev 2020; 100: 1181-228. doi: 10.1152/physrev.00033.2019.
- 23. Haber SN. Corticostriatal circuitry. Dia- logues Clin Neurosci 2016; 18: 7-21. doi: 10.31887/DCNS.2016.18.1/shaber.
- 24. Stevens RC, Cherezov V, Katritch V, Aba- gyan R, Kuhn P, Rosen H, Wüthrich K. The GPCR Network: A large-scale collaboration to determine human GPCR structure and func-
tion. Nat Rev Drug Discov 2013; 12: 25-34. doi: 10.1038/nrd3859.
- 25. Maroteaux L, Béchade C, Roumier A. Di- mers of serotonin receptors: Impact on ligand affinity and signaling. Biochimie 2019; 161:
23-33. doi: 10.1016/j.biochi.2019.01.009.
- 26. Busquets-García A, Bains J, Marsicano G. CB1 receptor signaling in the brain: Extracting specificity from ubiquity. Neuropsychophar- macology 2018; 43: 4-20. doi: 10.1038/ npp.2017.206.
- 27. Freund TF, Katona I, Piomelli D. Role of endogenous cannabinoids in synaptic sig- naling. Physiol Rev 2003; 83: 1017-66. doi: 10.1152/physrev.00004.2003.
- 28. Freund TF, Katona I. Perisomatic inhibi- tion. Neuron 2007; 56: 33-42. doi: 10.1016/j. neuron.2007.09.012.
- 29. Pompeiano M, Palacios JM, Mengod
G. Distribution of the serotonin 5-HT2 re- ceptor family mRNAs: Comparison between 5-HT2A and 5-HT2C receptors. Mol Brain Res 1994; 23: 163-78. doi: 10.1016/0169- 328x(94)90223-2.
- 30. Weber ET, Andrade R. Htr2a gene and 5-ht2a receptor expression in the cerebral cor- tex studied using genetically modified mice. Front Neurosci 2010; 4: 36. doi: 10.3389/ fnins.2010.00036.
- 31. Xu T, Pandey SC. Cellular localization of serotonin(2A) (5HT(2A)) receptors in the rat brain. Brain Res Bull 2000; 51: 499-505. doi: 10.1016/s0361-9230(99)00278-6.
- 32. Benarroch EE. Effects of acetylcholine in the striatum: Recent insights and therapeutic implications. Neurology 2012; 79: 274-81. doi: 10.1212/WNL.0b013e31825fe154.
- 33. Martel JC, Gatti McArthur S. Dopamine receptor subtypes, physiology and pharmaco- logy: New ligands and concepts in schizophre- nia. Front Pharmacol 2020; 11: 1003. doi: 10.3389/fphar.2020.01003.
- 34. Missale C, Nash SR, Robinson SW, Jaber M, Caron MG. Dopamine receptors: From struc- ture to function. Physiol Rev 1998; 78: 189-
225. doi: 10.1152/physrev.1998.78.1.189.
- 35. Walsh KB, Andersen HK. Molecular pharmacology of synthetic cannabinoids: Deli- neating CB1 receptor-mediated cell signaling. Int J Mol Sci 2020; 21: 6115. doi: 10.3390/
ijms21176115.
- 36. xMarin P, Bécamel C, Chaumont-Dubel S, Vandermoere F, Bockaert J, Claeysen S. Classification and signaling characteristics of 5-HT receptors: Toward the concept of 5-HT receptosomes. In Handbook of Behavioral Neu- roscience Vol 31. Amsterdam: Elsevier; 2020;
Chapter 5: pp 91-120. doi: 10.1016/B978-0-
444-64125-0.00005-0.
- 37. Liu C, Goel P, Kaeser PS. Spatial and
temporal scales of dopamine transmission. Nat Rev Neurosci 2021; 22: 345-58. doi: 10.1038/s41583-021-00455-7.
- 38. Wilson RI, Nicoll RA. Endocannabinoid signaling in the brain. Science 2002; 296: 678-82. doi: 10.1126/science.1063545.
- 39. Spanagel R. Cannabinoids and the endo- cannabinoid system in reward processing and addiction: From mechanisms to interventions. Dialogues Clin Neurosci 2020; 22: 241-50. doi: 10.31887/DCNS.2020.22.3/rspanagel.
- 40. Zhou R, Han B, Xia C, Zhuang X. Membra- ne-associated periodic skeleton is a signaling platform for RTK transactivation in neurons. Science 2019; 365: 929-34. doi: 10.1126/
science.aaw5937.
- 41. Gahbauer S, Böckmann RA. Membra- ne-mediated oligomerization of G protein cou- pled receptors and its implications for GPCR function. Front Physiol 2016; 7: 494. doi: 10.3389/fphys.2016.00494.
- 42. Zhang L, Zhang JT, Hang L, Liu T. Mu opioid receptor heterodimers emerge as novel therapeutic targets: Recent progress and future perspective. Front Pharmacol 2020;11: 1078. doi: 10.3389/fphar.2020.01078.
- 43. Lu HC, Mackie K. Review of the endo- cannabinoid system. Biol Psychiatry Cogn Neurosci Neuroimaging 2021; 6: 607-15. doi: 10.1016/j.bpsc.2020.07.016.
- 44. Delgado D, Cortés A, Mallol J, Casadó V, Lanciego JL, Franco R, Lluis C, Canela EI, McCormick PJ. Cannabinoid receptors CB1 and CB2 form functional heteromers in brain. J Biol Chem 2012; 287: 20851-65. doi: 10.1074/ jbc.M111.335273.
- 45. Maggio R, Aloisi G, Silvano E, Rossi M, Millan MJ. Heterodimerization of dopamine receptors: new insights into functional and therapeutic significance. Parkinsonism Relat Disord 2009; 15 Suppl 4: S2-7. doi: 10.1016/ S1353-8020(09)70826-0.
- 46. Ullmann T, Gienger M, Budzinski J, He- llmann J, Hübner H, Gmeiner P, Weikert D. Homobivalent dopamine D2 receptor ligands modulate the dynamic equilibrium of D2 mono- mers and homo- and heterodimers. ACS Chem Biol 2021; 16: 371-9. doi: 10.1021/acschem- bio.0c00895.
- 47. Scammell TE, Arrigoni E, Lipton JO. Neural circuitry of wakefulness and sleep. Neu- ron 2017; 93: 747-65. doi: 10.1016/j.neu- ron.2017.01.014.
- 48. Pace-Schott EF, Hobson JA. The neuro- biology of sleep: Genetics, cellular physiology and subcortical networks. Nat Rev Neurosci 2002; 3: 591-605. doi: 10.1038/nrn895.
49. Paller KA, Oudiette D. Sleep Learning Gets Real. Sci Am 2018; 319: 26-31. doi: 10.1038/scientificamerican1118-26







No comments! Be the first commenter?