Introducción y objetivos
Resumen
Los agonistas del receptor de GLP1 pasaron a ser fármacos de primera línea para el tratamiento de las enfermedades cardiometabólicas, como la diabetes, la obesidad, y sus consecuencias clínicas. En esta revisión descri- bimos los cuidados perioperatorios requeridos para el manejo adecuado de los pacientes que reciben estos fármacos. Entre las precauciones se deben considerar el manejo de la glucemia y los aspectos relacionados al potencial retraso en el vaciamiento gástrico.
Palabras clave
Agonistas del receptor de GLP1 – Cirugía no cardíaca – Diabetes tipo 2 – Obesidad.
Los agonistas del receptor de GLP-1 (ArGLP1) se posicionaron como piedra angular del tratamiento de la diabetes tipo 2, de la obesidad, y de las complicaciones cardiovasculares, renales, y metabólicas de las mismas, incluyendo prevención secundaria del infarto de miocardio, del accidente cerebrovascular, tratamiento del hígado graso metabólico, de la insuficiencia cardíaca y renal.
Se encuentran disponibles y recomendados actualmente fármacos de administración diaria (liraglutida, semaglutida oral) y de administración semanal (semaglutida, dulaglutida, y el agonista dual tirzepatida). A los fines prácticos de este texto, omitiremos otros fármacos anteriores que cayeron en desuso, así como otras moléculas que se encuentran en fases de desarrollo-aprobación.
Dado que son fármacos con recomendación clase 1 nivel de evidencia A, y dada la elevada prevalencia de diabetes (1 de cada 8 adultos en Argentina) (1) y tendencia creciente de obesidad (más del 50% de obesidad a nivel global hacia 2050) (2), consideramos importante revisar el manejo de es- tos fármacos en contexto de cirugías no cardíaca.
Cacia S, Zaidel EJ. “Agonistas del receptor GLP-1: su manejo en contexto de cirugías no cardíacas”. Farmacología Cardiovascular 2025;63:4-8.
farmacología cardiovascular 63 | Mayo de 2025
Métodos
Se realizó una revisión amplia de la literatura tanto en bases de datos convencionales (PubMed, Embase, Bireme, ScieLo), como búsqueda activa en las normativas de las sociedades científicas y en los formularios de aprobación de las molécu- las ante agencias regulatorias. La pesquisa se realizó desde el inicio hasta marzo 2025.
Se seleccionaron las moléculas: liraglutida, semaglutida, semaglutida oral, dulaglutida, tirzepatida. Si bien al momento del desarrollo de este documento no está disponible en nues- tro medio el agonista dual tirzepatida, el mismo es uno de los más utilizados a nivel global y se estima su disponibilidad a la brevedad en Argentina. Asimismo, se excluyeron moléculas que cayeron en desuso: lixisenatida, exenatida.
Se analizó la evidencia y se establecieron recomendaciones para su utilización e interrupción en contexto de cirugías no cardíacas. Luego de revisar la evidencia inicial, se subclasifi- có la información en dos ejes: sus efectos el control glucémico pre e intraoperatorio y el manejo de los ArGLP1 en relación a sus efectos en el vaciamiento gástrico en el período preope- ratorio.
Seguridad de los agonistas GLP-1 en rela- ción a la glucemia
Dado el mecanismo de acción de estas moléculas, se reconoce que estos fármacos no provocan hipoglucemias per-se. En el perioperatorio la suspensión y reinicio no se asociarían con hipoglucemias. Sin embargo, se debe tener precaución en la asociación con fármacos que sí puedan provocar hipoglucemias como las insulinas y las sulfonilureas.
El uso en el ámbito hospitalario de los ArGLP1 es controver- sial, ya que sus beneficios radican en los efectos metabólicos a largo plazo. Sin embargo, un estudio pequeño utilizó un ArGLP1 de corta acción en pacientes hospitalizados demos- trando un menor riesgo de hipoglucemias que el grupo asigna- do a insulinas (3), sin embargo, la elevada tasa de aparición de síntomas gastrointestinales rápidamente tras su inicio los hace un grupo de fármacos no ideal para el uso en pacientes quirúrgicos (4-6).
Retraso del vaciamiento gástrico
El agonismo GLP1 se asocia con un retraso del vaciamien- to gástrico, que provoca síntomas floridos durante la fase de titulación, pero que puede persistir en el uso crónico. Esto es de especial interés ya que, ante una recomendación de ayuno convencional, en sujetos con retraso en el vaciamiento gástri-
co pueden permanecer restos de alimentos y por ello podría en teoría existir la posibilidad de broncoaspiración ante pro- cedimientos que incluyan anestesia general (7-12). Por ello, es fundamental reconocer la vida media y efecto post-dosis de cada uno de los ArGLP1.
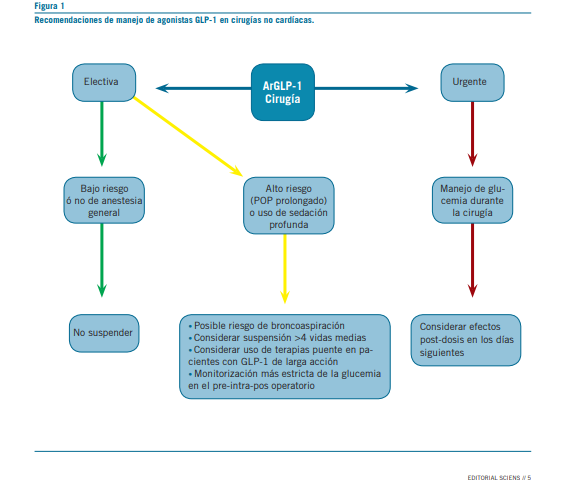
Sin embargo, existe un documento de sociedades de ciru- gía, de gastroenterología, de anestesia, o consensos multiso- ciedades (13-18) donde se aconseja, basado en el intervalo interdosis, suspender la liraglutida 1 día antes de la interven- ción, y la semaglutida y tirzepatida una semana antes. Noso- tros no concordamos con ello, ya que no sigue los conceptos básicos farmacológicos, sólo considera el intervalo interdosis, que no es equivalente a la duración de acción y la vida media. En la tabla 1 describimos la vida media de cada molécula y el tiempo aproximado en el que desaparecería por completo la acción farmacológica (4 vidas medias).
Tabla 1
Vida media y duración máxima del efecto
| Fármaco | Intervalo interdosis | Vida media | Duración máxima |
| Liraglutida | 1 día | 13 hs | 52 hs |
| Semaglutida | 7 días | 1 semana (aproximado) | 5-7 semanas (aproximado) |
| Semaglutida oral | 1 día | 1 semana (aproximado) | 5-7 semanas (aproximado) |
| Dulaglutida | 7 días | 4-5 días | 16-20 días (aproximado) |
| Tirzepatida | 7 días | 5 días | 20 días (aproximado) |
farmacología cardiovascular 63 | Mayo de 2025
Considerando lo antedicho, una potencial suspensión de hasta 7 semanas podría tener impacto en forma crónica en el control glucémico de los pacientes. Por ello, se debería consi- derar una terapia “puente” con monitorización más intensiva de los niveles de glucemia y potencial uso de otros fármacos de vida media corta.
Otro planteo es que, para el reinicio, estos fármacos requie- ren titulación lenta para alcanzar dosis efectivas evitando los síntomas gastrointestinales. En suma, una suspensión de has- ta 7 semanas y reinicio con titulación lenta, probablemente tenga impacto en el control metabólico crónico.
Reganancia de peso
El uso crónico de los ArGLP1 también se asocia con reduc- ción sostendia del peso y por ello actualmente son fármacos de primera línea en el tratamiento de la obesidad. En dichos sujetos, se observa tras la suspensión una reganancia de peso (19-21). Este fenómeno se debe tener en cuenta en cuanto a la suspensión prolongada para cirugías.
Consideraciones en la evaluación de la gastroparesia por ArGLP1
Cómo evaluar el riesgo: la fase de titulación tiene mayor riesgo, los fármacos de uso semanal tendrán mayor riesgo, así
como las dosis altas. La presencia de síntomas gastrointesti- nales (GI) se puede utilizar como marcador de riesgo. Evaluar otras patologías concomitantes (neuropatía diabética, disau- tonomía clínica o farmacológica). En pacientes con bajo ries- go de gastroparesia-broncoaspiración deberían utilizarse los agonistas GLP-1 sin interrupción (22-23).
Cómo evitar la broncoaspiración en los sujetos de alto ries- go: utilizar dieta líquida las 24 hs previas, realizar ecografía el día de la cirugía (implementación difícil por disponibilidad, variabilidad interoperador), uso potencial de proquinéticos, uso de protocolos de inducción anestésica rápida pre intuba- ción orotraqueal (20-23).
Conclusiones
La suspensión de los agonistas GLP-1 en el contexto de cirugías electivas puede empeorar el control metabólico. Es posible que se requieran terapias “puente” ante sujetos con hiperglucemias y que usan agonistas GLP-1 de vida media larga. Diversas sociedades científicas reconocen que estos fármacos podrían retrasar el vaciamiento gástrico con reportes aislados de riesgo de broncoaspiración, por lo que la evalua- ción del tipo de cirugía, de anestesia, y duración de acción máxima de cada fármaco deben ser consideradas.
Referencias bibliográficas
- 1. Obtenido de: https://www.indec.gob.ar/ftp/cuadros/publicaciones/enfr_2018_resultados_definitivos.pdf.
- 2. GBD 2021 Adult BMI Collaborators. Global, regional, and national prevalence of adult overweight and obesity, 1990-2021, with forecasts to 2050: a forecasting study for the Global Burden of Disease Study 2021. Lancet. 2025;405(10481):813-838. doi:10.1016/S0140-6736(25)00355-1.
- 3. Fayfman M, Galindo RJ, Rubin DJ, et al. A Randomized controlled trial on the safety and efficacy of exenatide therapy for the inpatient manage- ment of general medicine and surgery patients with type 2 diabetes. Diabetes Care. 2019;42(3):450-456.
- 4. Umpierrez GE, Schwartz S. Use of incretin-based therapy in hospitalized patients with hyperglycemia. Endocr Pract. 2014;20(9):933-944.
- 5. Makino H, Tanaka A, Asakura K, et al. Addition of low-dose liraglutide to insulin therapy is useful for glycaemic control during the peri-operative period: effect of glucagon-like peptide-1 receptor agonist therapy on glycaemic control in patients undergoing cardiac surgery (GLOLIA study). Diabet Med. 2019;36(12):1621-1628.
- 6. Umpierrez G, Pasquel FJ, Duggan E, Galindo RJ. Should We Stop Glucagon-Like Peptide-1 Receptor Agonists Before Surgical or En- doscopic Procedures? Balancing Limited Evidence With Clinical Judgment. J Diabetes Sci Technol. Published online March 11, 2024. doi:10.1177/19322968241231565.
- 7. Silveira SQ, da Silva LM, de Campos Vieira Abib A, et al. Relationship between perioperative semaglutide use and residual gastric content: A retrospective analysis of patients undergoing elective upper endoscopy. J Clin Anesth. 2023;87:111091. doi:10.1016/j.jclinane.2023.111091.
- 8. Obtenido de: https://www.apsf.org/article/are-serious-anesthesia-risks-of-semaglutide-and-other-glp-1-agonists-under-recognized/.
- 9. Hiramoto, B. McCarty, T. Lodhia, N. et al. Quantified metrics of gastric emptying delay by glucagon-like peptide-1 agonists: a systematic review and meta-analysis with insights for periprocedural management. Am J Gastroenterol. 2024; 119:1126-1140.
- 10. Sen, S. Potnuru, P.P. Hernandez, N. et al. Glucagon-like peptide-1 receptor agonist use and residual gastric content before anesthesia JAMA Surg. 2024; 159:660-667.
- 11. Beam WB, Hunter Guevara LR: Are serious anesthesia risks of semaglutide and other GLP-1 agonists under-recognized? Case reports of retained solid gastric contents in patients undergoing anesthesia. Anesthesia Patient Safety Foundation (APSF Newsletter. June 8, 2023; 38(No. 2).
- 12. Kindel TL, Wang AY, Wadhwa A, et al. Multisociety Clinical Practice Guidance for the Safe Use of Glucagon-like Peptide-1 Receptor Agonists in the Perioperative Period. Clin Gastroenterol Hepatol. Published online October 29, 2024. doi:10.1016/j.cgh.2024.10.003.
- 13. Joshi GP, Abdelmalak BB, Weigel WA, Soriano SG, Harbell MW, Kuo CI, Stricker PA, Domino KB, American Society of Anesthesiologist (ASA) Task Force on Perioperative Fasting: American Society of Anesthesiologists consensus-based guidance on preoperative management of patients (adults and children) on glucagon-like peptide-1 (GLP-1) receptor agonists. June 29, 2023. Available at: https://www.asahq.org/about-asa/newsroom/news-re- leases/2023/06/american-society-of-anesthesiologists-consensus-based-guidance-on-preoperative.
- 14. Hulst AH, Polderman JAW, Siegelaar SE, van Raalte DH, DeVries JH, Preckel B, Hermanides J: Preoperative considerations of new long-acting glucagon-like peptide-1 receptor agonists in diabetes mellitus. Br J Anaesth 2021; 126:567–71.
- 15. Ushakumari DS, Sladen RN. ASA Consensus-based Guidance on Preoperative Management of Patients on Glucagon-like Peptide-1 Receptor Agonists. Anesthesiology. 2024;140(2):346-348. doi:10.1097/ALN.0000000000004776.
- 16. Camilleri M, Kuo B, Nguyen L, et al. ACG Clinical Guideline: Gastroparesis. Official Journal of the American College of Gastroenterology | ACG. 2022;117(8):1197-1220.
- 17. Wadden TA, Hollander P, Klein S, et al. Weight maintenance and additional weight loss with liraglutide in a low calorie-diet-induced weight loss: The SCALE Maintenance randomized study. International Journal of Obesity. 2013;37(11):1443-1451.
- 18. Pi-Sunyer X, Astrup A, Fujioka K, et al. A Randomized, Controlled Trial of 3.0 mg of Liraglutide in Weight Management. New England Journal of Medicine. 2015;373(1):11-22. htp://dx.doi.org/10.1056/Nejmoa1411892.
- 19. le Roux C, Astrup A, Fujioka K, et al. 3 years of liraglutide versus placebo for type 2 diabetes risk reduction at weight management in individuals with prediabetes: a randomised, double-blind trial. Lancet. 2017; 389:1399-409.
- 20. Davies MJ, Bergenstal R, Bode B, et al. Efficacy of Liraglutide for Weight Loss Among Patients with Type 2 Diabetes; The SCALE Diabetes Randomized Clinical Trial. Jama-Journal of the American Medical Association. 2015;314(7):687-699.
- 21. Hashash, J. Thompson, C.C. Wang, A.Y. AGA rapid clinical practice update on the management of patients taking GLP-1 receptor agonists prior to endoscopy: communication Clin Gastroenterol Hepatol. 2023; 22:705-707.
- 22. AASLD/ACG/AGA/ASGE/NASPGHAN Multisociety Statement. No data to support stopping GLP-1 agonists prior to elective endoscopy . 2023. Available from: https://gastro.org/news/gi-multi-society-statement-regarding-glp-1-agonists-and-endoscopy.
- 23. Camilleri, M. Carlson, P. Dilmaghani, S. Prevalence and variations in gastric emptying delay in response to GLP-1 receptor agonist liraglutide. Obesity. 2024; 32:232-233.







No comments! Be the first commenter?