Objetivo: Se realiza un trabajo de revisión sobre los efectos de los ácidos grasos omega 3 de cadena larga sobre el TDAH.
Metodología: Se realizó una búsqueda en BVS, Pub Med, Psiquiatría.com y Google Scholar con las siguientes palabras clave: “TDAH”, “omega 3”, “omega 6”, “PUFA”, “ácido eicosapentaenoico”, “ácido docosahexaenoico”, “metaanálisis”, “Ensayos clínicos aleatorizados”, según descriptores DeCS/MeSH.
Se consideró como resultado positivo la mejora en alguno de los dominios estudiados (atención, memoria, aprendizaje, im- pulsividad, conducta, agresividad, humor, ansiedad), siempre en individuos que cumplían con criterios diagnósticos de TDAH.
Se seleccionaron 30 artículos, de los cuales 4 son MTA, 25 ECA y un estudio observacional.
Conclusiones: Teniendo en cuenta el perfil benigno de efectos adversos y el efecto modesto pero positivo en el consumo de omega 3, además de efectos beneficiosos cardiovasculares, antiinflamatorios, en el neurodesarrollo y varios síntomas psiquiá- tricos, se recomienda su uso como adyuvante en el TDAH o como alternativa en caso de contraindicaciones o efectos adversos importantes con los fármacos de primera línea. También sería una opción para aquellos casos en que los padres y/o pacientes prefieran no utilizar psicofármacos, siempre aclarando que no son de primera línea.
Palabras clave
TDAH – Omega 3 – Omega 6 – PUFA – Àcido eicosapentaenoico – Àcido docosahexaenoico – Metaanálisis – Ensayos clínicos aleatorizados.
Angemi JA, Casal C. “Ácidos grasos omega 3 y trastorno por déficit de atención e hiperactividad: ¿una alternativa de tratamiento?”. Psicofarmacología 2023;133:10-21. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
El Trastorno por déficit de atención /hiperactividad (TDAH) es una entidad con alta prevalencia (estadísticas conservado- ras establecen un 5% en población infantojuvenil y la mitad en adultos), con alteraciones neurobiológicas bien documen- tadas e importante componente genético. Es el motivo de con- sulta más frecuente en servicios especializados en psiquiatría infanto-juvenil y un problema de creciente importancia y reco- nocimiento en adultos (APA 2014, Angemi 2017).
En los últimos años se ha recolectado evidencia que la suplementación con ácidos grasos poliinsaturados (PUFAs, Poly Unsaturated Fatty Acids), esenciales en el neurodesarro- llo, tendrían efecto beneficioso sobre la signosintomatología y evolución de varios trastornos psiquiátricos, entre ellos el TDAH (Ruiz-Lázaro 2014).
PUFAs
Son ácidos grasos (AG) que poseen más de un doble enlace de carbono.
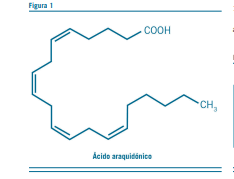
Poseen un grupo metilo (hidrófobo) en el extremo terminal u omega (CH3) y uno carboxilo (hidrófilo) en el proximal (COOH) (Ver fig 1).
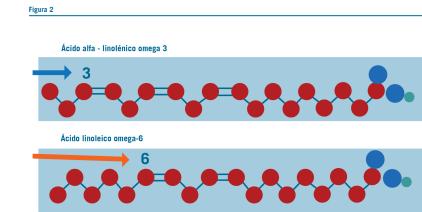
De acuerdo con el lugar que ocupa el doble enlace con res- pecto al extremo omega, se clasifican en:
- Omega 3: situado en posición 3
- Omega 6: situado en posición 6 (Ver figura 2)
Todos ellos son esenciales, es decir, necesitan ser incorpo-

Los mismos se encuentran en varias fuentes naturales, como los aceites de nuez, soja, linaza y canola (ALA) y aceites de pescados (arenque, atún, salmón, caballa, sardina, jurel, trucha, bacalao) calamar, ostras, langostas y krill (EPA y DHA) (NIDDK 2012, Waitzberg et al 2014).
Por la importancia que tiene en nuestro país el consumo de carne vacuna, es importante aclarar que el ganado criado con pastura en campo abierto posee niveles de omega 3 mucho más elevados que el criado en corrales de engorde (Parris et al 2007).
Funciones de los PUFAs
Los PUFAs son componentes de los fosfolípidos (fosfatidil- colina, fosfatidiletanolamina y fosfatidilserina), esenciales en la estructura de la membrana celular neuronal, contribuyen- do a su fluidez y permeabilidad. Esto permite la realización de distintas funciones fisiológicas y homeostáticas como la comunicación intercelular, la ubiquitinación y el recambio intracelular de proteínas, el neurodesarrollo, la activación de la neurotransmisión y la neurosecreción. La fluidez es indis- pensable para la movilización de estructuras tales como receptores, canales iónicos, vesículas, uniones comunicantes y enzimas (Ruiz Lázaro et al 2014, Peet et al 2005).
El DHA y el EPA interactúan con los otros AG en la bicapa de la membrana celular: saturados, monoinsaturados (ome- ga-9) y poliinsaturados (omega-6, omega-3 de cadena corta). La fluidez de la membrana es un resultado neto de todas las densidades de electrones. Los dobles enlaces carbono-carbo- no tienen una alta densidad de electrones. Esta propiedad hace que el DHA (seis enlaces dobles) y el EPA (cinco enlaces dobles) sean los AG de membrana más fluidificantes (Parris et al 2007).
El AA (ácido araquidónico) y el DHA modulan la expresión génica a nivel transcripcional. Los estudios de microarrays de ADN de roedores criados con diversas dietas, revelaron que el enriquecimiento de ALA o EPA + DHA aumentó la expresión de 55 genes hasta siete veces, mientras que la expresión de 47 genes disminuyó hasta cinco veces. Entre los genes mo- dulados, se pueden encontrar algunos relacionados con sero- tonina, inmunoglobulinas, factor nuclear kappa B, plasticidad sináptica, transducción de señales, ensamblaje de canales ió- nicos, citoesqueleto, metabolismo energético y regulación de proteínas. El análisis de microarrays en roedores deficientes en EPA encontró una amplia gama de transcripciones sobre expresadas, algunas de las cuales codifican varios receptores, incluidos los de glutamato, acetilcolina, ácido gamma-amino- butírico y dopamina (DA) (Raz et al 2009).
Los PUFAs afectan las principales vías de señalización y
regulan la actividad de los canales de Na, Ca2 de tipo L y canales de K dependientes de voltaje, así como la ATPasa-Ca en las membranas neuronales y la comunicación intercelular de unión gap (Stillwell et al 2005).
Aproximadamente el 20% del peso seco del cerebro se debe a los PUFAs y en el SNC uno de cada tres ácidos grasos es
![]()
Tabla 1
Estructura de los principales ácidos grasos insaturados
| Palmitoleico | D9 C 16:1 | CH3–(CH2)5–CH=CH–(CH2)7–COOH |
| Oleico | D9 C 18:1 | CH3–(CH2)7–CH=CH–(CH2)7–COOH |
| Linoleico | D9,12 C 18:2 | CH3–(CH2)4–CH=CH–CH2–CH=(CH2)7–COOH |
| Linolénico | D9,12,15 C 18:3 | CH3–(CH2–CH=CH)3–(CH2)7–COOH |
| Araquidónico | D5,8,11,17 C 20:4 | CH3–(CH2)3–(CH2–CH=CH)4–(CH2)3–COOH |
La letra griega Δ denota que el ácido graso es insaturado.
Los superíndices de la letra delta, Δ indican las posiciones donde se encuentran los dobles enlaces.
Modificado de Lozano et al., 2005.
poliinsaturado (Tapia 2005).
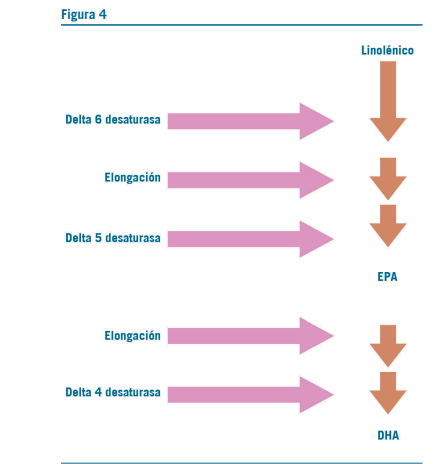
El DHA es esencial para el desarrollo cerebral pre y posna- tal, mientras que EPA parece tener más influencia en el com- portamiento y el estado de ánimo. Tanto el DHA como el EPA generan metabolitos neuroprotectores (Kidd 2007).
Debe existir una proporción adecuada de omega 3/omega 6 para un correcto neurodesarrollo, considerándose óptima 1/4. La ingesta excesiva del ácido linoleico (AL) omega-6, que es abundante en las dietas modernas ricas en aceites vegetales, puede inhibir la síntesis del ácido a-linolénico omega-3 en EPA y DHA y, por lo tanto, reducir la disponibilidad de EPA y DHA (Assisi 2006).
Arnold et al (2000) encontraron una correlación entre bajos niveles de Zn en sangre y alteraciones en el metabolismo de PUFAs en niños. Es importante tener en cuenta que algunos suplementos de omega-3 autorizados para el tratamiento del TDAH incluyen el agregado de Zn.
Desde el último trimestre del embarazo hasta los 2 años de edad, se produce un rápido crecimiento cerebral, período conocido como “brain growth spurt”. El mismo es muy vulne- rable a la falta de nutrientes. El DHA es absolutamente nece- sario para el desarrollo de los sistemas neuronales sensoria- les (especialmente conos y bastones retinianos), perceptivos, cognitivos y motores. Además, son antioxidantes de primera línea por su ubicación en membrana celular (McCann et al 2005, Kidd 2007, Parris et al 2007).
Los bebés prematuros tienen un riesgo especial de insu- ficiencia de omega-3 ya que no alcanzaron a recibir los AG necesarios durante el último trimestre. Además, poseen una capacidad muy limitada para sintetizar DHA a partir del ALA por deficiencia enzimática. También presentan concentracio- nes más bajas de DHA en eritrocitos y corteza cerebral post mórtem en comparación con los bebés a término (Kidd 2007, San Giovanni et al 2000, Clandinin 1980).
El aporte intraútero de DHA lo provee la madre. En etapas tardías del último trimestre gestacional, los astrocitos pueden donar DHA a las neuronas en formación (Tapia A 2005).
Hay datos de que la insuficiencia de DHA en el útero está relacionada con un crecimiento deficiente de neuritas magno- celulares asociado con la dislexia (Stein 2001).
Ramakrishnan et al (2016) evaluaron la cognición global, el comportamiento y la atención a los 5 años de edad en la descendencia de mujeres mexicanas que participaron en un ensayo controlado aleatorio de suplementación prenatal de DHA. Un total de 1094 mujeres fueron asignadas al azar para recibir 400 mg de DHA/ día o placebo desde la semana 18 a la 22 de embarazo hasta el parto. Se evaluó el desarrollo cognitivo y el funcionamiento conductual y ejecutivo, incluida la atención, en 797 hijos a la edad de 5 años (82% de 973 nacidos vivos) con el uso de las Escalas McCarthy de Habi- lidades Infantiles (MSCA), la escala parental del Sistema de Evaluación del Comportamiento para niños, segunda edición (BASC-2) y la prueba de rendimiento continuo para niños de Conners (K-CPT). Se examinó la heterogeneidad por la ca- lidad del entorno familiar, la inteligencia materna y el nivel
socioeconómico. En el K-CPT, la descendencia en el grupo de DHA mostró una mejora en las puntuaciones medias en com- paración con las del grupo de placebo para las omisiones. Se concluye que la exposición prenatal al DHA puede contribuir a mejorar la atención sostenida en los niños en edad preescolar. Se encontraron efectos perjudiciales en el desarrollo verbal entre los niños cuyas madres consumían menos de 12 onzas (unos 340 g) de mariscos por semana (Odd Ratio = 1,48 para mayor riesgo de bajo coeficiente intelectual verbal). La baja ingesta materna de mariscos durante el embarazo también se asoció con resultados subóptimos para las habilidades moto- ras finas, la comunicación, el comportamiento prosocial y las
puntuaciones de desarrollo social (Hibbeln et al 2014).
El calostro y la leche materna contienen EPA y en canti- dades menores DHA, lo que indicaría su importancia en esa etapa del desarrollo (Young et al 1997).
La suplementación con DHA en la fórmula de leches mater- nizadas o aumentando los niveles en leche materna a través de suplementación, mejora el desarrollo neuromotor en niños (Kidd 2007).
Se encontró que los bebés que fueron alimentados con le- che materna o fórmulas con DHA tenían una agudeza visual superior en comparación con aquellos alimentados con fórmu- las no enriquecidas. Este efecto persiste hasta el séptimo año o más (Bakker et al 2003).
Conklin et al (2007) encontraron que una mayor ingesta de omega 3 de cadena larga, se correlacionó positivamente con mayores niveles de EPA y DHA de eritrocitos, y esto a su vez con mayores volúmenes de materia gris cortical en varias re- giones corticolímbicas, incluida la corteza cingulada anterior, el hipocampo y la amígdala.
También regula la transmisión de DA en ganglios basales y de DA y serotonina en cortex prefrontal (Lavialle et al 2010). En primates no humanos, la deficiencia de AG n-3 durante el desarrollo se asocia con déficits en la atención y agudeza
visual, polidipsia y anomalías en el electrorretinograma.
Esto último también se vio en babuinos recién nacidos pre- maturos. La deficiencia perinatal de omega 3 se asocia con un aumento de estereotipia y de episodios de locomoción, lo cual es consistente con la actividad de la DA mesolímbica desregulada. Un estudio de neuroimagen encontró que la conectividad funcional en estado de reposo entre las redes corticales prefrontales se vio afectada en los monos criados con una dieta deficiente en AG n-3 en comparación con los monos criados con una dieta enriquecida con aceite de pes- cado. Específicamente, la deficiencia de omega 3 durante el desarrollo perinatal se asoció con una menor conectividad en estado de reposo entre la ínsula anterior dorsal y las regiones prefrontal ventromedial, orbitofrontal y dorsolateral, así como las regiones parietales superior y temporal medial, en com- paración con monos criados con una dieta enriquecida con aceite de pescado (Messamore et al 2016).
Poseen actividad antiinflamatoria por su competencia con
los omega 6 en la producción de eicosanoides (Waitzberg et al 2014). A partir del EPA se sintetizan resolvinas de la serie
E y a través del DHA de la serie D. Estas proteínas inhiben la migración y activación de polimorfonucleares, disminuyen- do la producción de citoquinas proinflamatorias como la IL-6 (Interleuquina 6) y el FNT-a (Factor de necrosis tumoral alfa) (Otaegui-Arrazola et al 2014). También contribuyen a la sín- tesis de IL-10 (antiinflamatoria). La acción se ejercería sobre la transcripción genética de factores proinflamatorios, como el aumento de la actividad de los receptores activados por el PPAR-g (proliferador de peroxisomas) y la inhibición de libera- ción del factor de transcripción nuclear NF-Kb (factor nuclear potenciador de las cadenas ligeras kappa de las células B activadas). El primero de los efectos mencionados inhibe la producción de COX 1 y 2. (Waitzberg et al 2014, Serhan C. 1994, Chapkin R 1991, in´t Velt B et al 2001). Inhiben las proteínas G y la proteína quinasa C, así como los canales ióni- cos de Ca, Na y K (Lakhan et al 2008).
Una proporción alta de omega-6 /omega-3 puede alterar las propiedades de la membrana celular y aumentar la produc- ción de mediadores inflamatorios ya que el AA es el precursor de eicosanoides inflamatorios, como las prostaglandinas y los tromboxanos (Simopoulos 2002).
En un estudio doble ciego, 103 niños (6-12 años) con TDAH que recibían terapia de mantenimiento fueron asigna- dos al azar en dos grupos. El grupo n-3 recibió AG n-3 (635 mg de EPA +195 mg de DHA) y el grupo placebo recibió cáp- sulas de aceite de oliva que eran visualmente similares a las cápsulas de omega 3. La duración de la suplementación fue de 8 semanas. Antes y después de la intervención se deter- minó la proteína C reactiva (PCR), la interleucina-6 (IL-6) y la actividad de la glutatión reductasa (GR), catalasa (CAT) y superóxido dismutasa (SOD). Asimismo, se aplicó el Cuestio- nario Abreviado de Conners (ASQ-P). Después de la interven- ción de 8 semanas, se observó una reducción significativa en los niveles de PCR (P <0,05, IC del 95% = 0,72-2,02) e IL-6 (P <0,001, IC del 95% = 1,93-24,33) en el grupo suplemen- tado con omega 3. También hubo un aumento significativo en la actividad de SOD y GR (P <0,001). Se observó una mejora significativa en las puntuaciones ASQ-P en el grupo omega 3 (P <005). Este estudio correlaciona la disminución de facto- res inflamatorios y estrés oxidativo con mejoras en síntomas TDAH (Hariri et al 2012).
El DHA disminuye la producción de b-amiloide y aumenta la
del FN (Factor neurotrófico). (Salem et al 2001).
Otro mecanismo potencial de acción del DHA es la regula- ción del receptor de retinoides X (RXR), que es un factor cru- cial de desarrollo y supervivencia implicado en múltiples vías de transcripción, como el sistema dopaminérgico. La combi- nación de DHA y EPA intensificó los niveles de fosfolípidos de membrana en el cerebro de los cachorros nacidos de ratas suplementados durante la gestación y la lactancia y produjo un mayor número de espinas dendríticas por unidad de área y la mejora de las actividades sinápticas. Estos hallazgos sugie- ren que la sinaptogénesis está parcialmente determinada por la disponibilidad de precursores de fosfolípidos en el cerebro.
De hecho, la suplementación con precursores de fosfolípidos en modelos animales produjo modificaciones bioquímicas y estructurales que favorecieron la liberación de neurotransmi- sores, como la DA y la acetilcolina, y la mejora en tareas cog- nitivas específicas (Bozzatello et al 2020).
Un estudio de tomografía por emisión de positrones demos- tró que la suplementación dietética con DHA mejora la dismi- nución del acoplamiento neurovascular observado en monos de edad avanzada (Tsukada et al 2000).
Richardson y Montgomery (2005) realizaron un estudio controlado y aleatorizado (ECA) de suplementación dietética con ácidos grasos w-3 y w-6, en comparación con placebo, en 117 niños de 5 a 12 años de edad con trastorno del desarrollo de la coordinación. El tratamiento durante 3 meses en grupos paralelos fue seguido de un cruce de una vía de placebo a tra- tamiento activo durante 3 meses adicionales. Se encontraron mejoras significativas para el tratamiento activo frente al pla- cebo en la lectura, la ortografía y el comportamiento durante 3 meses de tratamiento en grupos paralelos. Después del cruce, se observaron cambios similares en el grupo de placebo acti- vo, mientras que los niños que continuaron con el tratamiento activo mantuvieron o mejoraron su progreso.
Existe signo sintomatología que nos puede hacer sospechar en deficiencia de PUFAs, como ser sed, micción frecuente, cabello y piel secos y ásperos, uñas quebradizas y queratosis folicular (Stevens 1996).
Es importante aclarar el perfil benigno de efectos adversos ante la administración de omega 3.
Estos se metabolizan en el hígado por beta-oxidación y se descomponen en AG de cadena corta. Tienen poco efecto so- bre el citocromo P450 hepático o la actividad transportadora de fármacos.
Los efectos secundarios de los suplementos de omega-3 y aceite de pescado son mínimos. Pueden incluir malestar gastrointestinal leve, náuseas, diarrea, dispepsia, regusto des- agradable y dolor de cabeza. Los efectos secundarios clíni- camente más significativos incluyen disfunción plaquetaria y un mayor riesgo de hemorragia, particularmente en pacientes que reciben terapia anticoagulante y antitrombótica.
Puede haber un incremento leve en ALT en hepatograma, sin alteraciones en niveles de bilirrubina ni fosfatasa alcalina (NIDDK 2012).
En caso de indicar aumento en la ingesta de pescado, tener en cuenta que se pueden concentrar cantidades significativas de metilmercurio, bifenilos policlorados y dioxinas en ciertas especies de peces, como el tiburón, el pez espada, la caballa real y el blanquillo (Covington 2004).
La FAO (Food and Agriculture Organization) (FAO)/OMS (Organización mundial de la salud) (2019), recomiendan la ingesta de 100 a 200 mg/día de EDA y DHA entre los 2 a 6 años de edad, y 200 a 250 mg/día en mayores de 6 años. La ecuación riesgo/ beneficio con respecto a la contaminación con la ingesta es a favor del consumo de pescado.
w-3 y TDAH
La asociación entre PUFAs e hiperactividad fue inicialmen- te hipotetizada en 1981 por Colquhoun y Bunday en Gran Bretaña. Esta hipótesis es compatible con fracciones de PU- FAs más bajas en sangre en niños con TDAH en comparación con niños sin TDAH. También asociaron deficiencia de Zn, necesario para metabolizar PUFAs a prostaglandinas.
Luego aparecieron varios estudios que evidencian una dis- minución en la concentración de PUFAs en sangre de niños afectados de TDAH, sobre todo de DHA y de AA. (Richard- son 2006). Estos hallazgos también se obtuvieron en adultos (Young et al 2004).
Al comparar 48 niños hiperactivos con 49 controles empa- rejados por edad y sexo, Mitchell et al (1987) informaron que los niveles de DHA, ALA y AA eran significativamente más ba- jos (alrededor del 15%) en la fracción de fosfolípidos séricos en niños hiperactivos que en los controles.
Steven et al (1996) encontraron que los niveles bajos de ome- ga-3 en niños de 6 a 12 años de edad, se asociaron con una va- riedad de problemas de comportamiento, sueño, concentración y aprendizaje, independientemente del diagnóstico clínico.
El mismo autor y su grupo (Steven et al 1995) analizaron el metabolismo de los AG midiendo los lípidos del plasma y los glóbulos rojos de 53 sujetos con TDAH. Encontraron que el DHA y el AA se redujeron significativamente en los sujetos con TDAH comparados con los controles tanto en la fracción de lípidos polares en plasma como en la fracción de lípidos totales de los glóbulos rojos. Los grados de reducción de DHA en los niños con TDAH fueron casi dos veces mayores compa- rados con AA.
En un estudio longitudinal sobre el desarrollo prenatal, Ko- hlboeck et al. (2011) demostraron que los niños que tienen niveles bajos de DHA en la sangre del cordón umbilical tienen mayores niveles de inatención e hiperactividad a los 10 años de edad. Tomaron una cohorte de 1467nacimientos produ- cidos desde noviembre de 1997 a enero de 1999 de la ciu- dad alemana de Munich, de los cuales participaron 416 (por consentimiento de sus padres):221 varones (53.1%) y 195 mujeres (46.9%).
La Chance et al (2016) realizaron un metaanálisis (MTA) sobre niveles en sangre de omega 6 y 3 en niños con TDAH. Los niños y jóvenes con TDAH tienen proporciones elevadas de ácidos omega 6 / 3 y AA / EPA en sangre en comparación con los controles. Por tanto, una relación elevada omega6 / omega3, y más específicamente AA / EPA, puede representar la alteración subyacente en los niveles de AG esenciales en pacientes con TDAH.
Montgomery et al (2013) estudiaron 493 niños en edad escolar de 7 a 9 años en escuelas de Oxfordshire, seleccio- nados por un rendimiento en lectura inferior al promedio en evaluaciones nacionales a los siete años. Se midieron: niveles de AG en sangre (mediante punción en dedo), memoria de trabajo y TDAH. El DHA y el EPA representaron sólo el 1,9%
y el 0,55% respectivamente de los AG en sangre totales, y el DHA mostró una mayor variación individual. Al controlar por sexo y estatus socioeconómico, las concentraciones más bajas de DHA se asociaron con una menor capacidad de lectura y rendimiento de la memoria de trabajo con niveles más altos de conducta de oposición y labilidad emocional calificada por los padres.
Fuentes-Albero M et al (2019), estudiaron en Valencia (Es- paña), mediante un cuestionario sobre ingesta de alimentos con alto contenido en omega-3 administrado a padres, a un grupo de niños con TDAH (n 48) y otro grupo con DN (De- sarrollo Neurotípico, n 87). Los niños con TDAH consumían pescado, moluscos, crustáceos y huevos de gallina con una frecuencia significativamente menor (p <0,05) que los niños del grupo de control.
Brookes et al (2006) investigaron tres genes que codifican enzimas esenciales (desaturasas) para el metabolismo de los AG mediante la exploración de la asociación genética entre 45 polimorfismos de un solo nucleótido (SNP) y el TDAH. Los hallazgos sugieren una asociación significativa de TDAH con SNP rs498793 en el gen de la desaturasa 2 del AG (FADS2). Con respecto al TDAH e inflamación, los sujetos que pre- sentan el trastorno tienen más posibilidades de sufrir asma y dermatitis atópica y niveles elevados de Il-6 (Chang et al
2019, Dawish et al 2019).
Cabe señalar que autores como Rioux et al (1997) encon- traron que niveles más bajos de PUFAs en la sangre no refle- jan necesariamente niveles más bajos de PUFAs en el cere- bro, como lo demostraron en roedores y cerdos. Esto puede ser una consecuencia de varios factores, uno de los cuales es la existencia de la barrera hematoencefálica. La velocidad y los mecanismos de penetración en el cerebro no son los mismos para todos los PUFAs y la evidencia sugiere que la barrera hematoencefálica juega un papel en la conversión del ácido linoleico y ALA en AA y EPA. Además, la asociación entre el estado sanguíneo de PUFAs y los síntomas del TDAH no son suficientes para probar una relación causal. No existen niveles de referencia de los niveles de PUFAs en sangre necesarios para la salud normal de los seres humanos, y el hecho de que algunos niños tengan niveles más bajos que otros no necesa- riamente tiene implicaciones clínicas (Raz et al 2009).
En cambio, hay estudios que avalan que los niveles de EPA
+ DHA en eritrocitos se correlaciona positivamente con el plasma sanguíneo, las plaquetas, las células inmunitarias, el tejido adiposo, la leche materna, el miocardio y la materia gris del cerebro. La evidencia emergente de los estudios de neu- roimagen en humanos sugiere que los niveles de DHA en san- gre están asociados con diferentes aspectos de la integridad estructural y funcional cortical relevantes para los trastornos psiquiátricos. La evidencia también sugiere que los déficits de EPA + DHA en glóbulos rojos preceden o coinciden con el inicio de la psicopatología. Juntos, estos hallazgos sugieren que la deficiencia de PUFAs omega-3 en eritrocitos puede representar un biomarcador de riesgo general o un factor de riesgo asociado con la psicopatología (McNamara et al 2013).
![]()
Tabla 2
Estudios de eficacia de omega 3 en TDAH.
| Voigt et al (2001) n: 63 niños de 6 a 12 años con diagnóstico de TDAH.345 mg/día de DHA vs placebo durante 4 meses. ECA doble ciego. Diferencia no significativa. |
| Huss et al (2010) n:810 niños de 5 a 12 años. Estudio observacional. PUFAs (EPA 400 mg, DHA 40 mg, GLA 60 mg) + Zn 80 mg + Mg 5 mg durante 3 meses 2 a 8 cápsulas día. Reducción significativa de síntomas TDAH, síntomas emocionales y mejora del sueño. Gustafsson et al (2010). n: 92 niños de 7 a 12 años con TDAH. ECA doble ciego. 0,5 g/día de EPA vs placebo. Duración 15 semanas. |
| Mejora de síntomas oposicionistas y en menor medida hiperactividad/impulsividad con el tratamiento con EPA. El aumento de EPA y la disminución de las concentraciones de ácidos grasos omega-6 en los fosfolípidos en membranas celulares de glóbulos rojos se relacionaron con la mejoría clínica. |
| Manor et al (2012) n 150 niños con TDAH. Omega 3 PUFAs (fosfatidilserina) vs placebo. Duración 15 semanas de ECA doble ciego, seguidas de15 semanas de estudio abierto. Disminución significativa de síntomas de TDAH y en impacto en padres. Mejoras en humor y conductas disruptivas. |
| Bloch et al (2011). MTA de 10 trabajos. n: 699 niños TDAH suplementados con omega 3, sobre todo EPA en dosis altas (de 80 a 750 mg/ día). Efecto positivo pero modesto comparado con estimulantes, atomoxetina y alfa 2 adrenérgicos. |
| Hawazaki et al (2004). n: 40 niños de 6 a 12 años con diagnóstico TDAH. ECA doble ciego. 510 mg DHA +100 mg EPA /día. Sin diferen- cias significativas en aspectos cognitivos. Disminución de agresividad. |
| Stevens et al (2003) n: 50 niños, edad media 10 años, con TDAH. ECA doble ciego. 480 mg DHA + 80 mg EPA + 96 mg GLA +40 mg AA + 24 mg vit E vs placebo. Duración 4 meses. Diferencias significativas en TDAH y conductas desafiantes. |
| Richardson et al (2002). n: 29 niños con TDAH y dislexia. ECA doble ciego. 480 mg DHA + 96 mg GLA + 42 mg AA + 864 mg de cis-lino- leico + 60 UI de Vitamina E + 8 mg de aceite de tomillo vs placebo. Duración 80 a 100 días Mejoras significativas en atención, ansiedad y conductas disruptivas. |
| Vaisman et al (2007). n: 60 niños con TDAH. Edad media 9 años. Relación varón/ mujer: 3:1. ECA, doble ciego. Grupo control: aceite de canola. Grupo 2: aceite de pescado con 250 mg DHA/EPA día. Grupo 3: 250 mg DHA/EPA + 300 mg/día de fosfatidilserina. Mejoría signifi- cativa en grupos 2 y 3 pero mucho mayor en este último. |
| Bos et al (2015). n: 40 niños con TDAH, 38 recibiendo MPH, suspendido 24 hs antes de la fRNM (8 A 14 años) vs 39 controles NT. ECA, doble ciego. Duración 16 semanas. 650 mg/día de EPA + DHA vs placebo. Mejoran síntomas TDAH en grupos TDAH y NT. Se realizó control con fRNM, no demostrándose cambios en áreas de procesamiento cognitivo, a pesar del efecto clínico. No estaría implicado por el sistema DA. |
| Kean et al (2017). n: 144 niños TDAH (123 varones, 23 mujeres, edad media 8,7 años). ECA, doble ciego. Duración 14 semanas. Com- pararon placebo vs PCSO-524® (extracto de mejillones verdes): lípidos (ácido eicosatetraenoico): 50 mg (incluidos EPA 7,3 mg y DHA 5,5 mg), aceite de oliva natural monoinsaturado 100 mg y vitamina E 0,025 mg + ácido mirístico, ácido palmítico, ácido palmitoleico, ácido esteárico, ácido oleico y ácido linoleico. 3 cápsulas/ día si pesaban hasta 45 kg y 4 si superaban ese peso. Mejoró significativamente la me- moria en las tareas cognitivas frente al placebo, independientemente de la gravedad de los síntomas (en grupos TDAH y TDAH subclínico). |
| Chang et al (2019). n: 92 sujetos con TDAH. 6 a 18 años. ECA doble ciego. Duración 12 semanas. 1,2 g/día de EPA vs placebo. El grupo de EPA mejoró más que el grupo de placebo en la atención enfocada y menos en impulsividad (errores de comisión). Este resultado se vio en sujetos con bajo contenido de EPA en eritrocitos. En conclusión, el tratamiento con EPA mejora los síntomas cognitivos en los jóvenes con TDAH, especialmente si tienen un nivel de EPA endógeno de referencia bajo. |
| Hirayama et al (2004). ECA contra placebo, doble ciego. n: 40 niños de 6 a 12 años, con TDAH. A la mitad se le administró 3,6 g/semana de DHA. Duración: 2 meses. Sin evidencia de efecto positivo en síntomas de atención, hiperactividad/impulsividad, percepción visual, agre- sión ni impaciencia. La memoria visual a corto plazo y los errores de comisión (Continuous Performance Test) obtuvieron mejores resultados en el grupo control. |
| Matsudaira et al (2015). ECA doble ciego. n: 76 adolescentes varones (de 12 a 16 años, media = 13,7) con TDAH. La mitad recibió place- bo y la otra EPA 558 mg +DHA 174 mg +omega-6 AA 60 mg + vitamina E 9.6 mg /día. Se evaluaron los efectos de 12 semanas de suple- mentos de omega-3 y omega-6 vs placebo, sobre los resultados bioquímicos y psicológicos La medida de resultado principal fue el cambio en las escalas de CTRS. Al inicio del estudio, los grupos de placebo y de tratamiento tenían niveles comparables de LC-PUFA medidos por la fosfatidilcolina de los glóbulos rojos. En el grupo de tratamiento, la suplementación mejoró el EPA, el DHA y niveles totales de omega-3. Sin cambios en agresión, impulsividad, depresión ni ansiedad. |
| Sinn y Bryan (2007). n: 132 niños australianos (7 a 12 años) con TDAH (medidos con Conners ADHD Index). ECA, doble ciego. Duración 15 semanas, tomando PUFAs solos, PUFAs + micronutrientes (Zn, Fe) o placebo. Se encontraron efectos positivos significativos del trata- miento en desatención, hiperactividad / impulsividad en ambos grupos de tratamiento con PUFAs en comparación con el grupo de placebo; no se encontraron efectos adicionales con los micronutrientes. Después de un cruce unidireccional a los suplementos activos en todos los grupos durante 15 semanas más, estos resultados se replicaron en el grupo de placebo y los grupos de tratamiento continuaron mostrando mejoras significativas. |
| Johnson et al (2009). ECA cruzado unidireccional, de 3 meses, controlado con placebo y con omega 3/6 con 75 niños y adolescentes con TDAH (de 8 a 18 años), seguido de 3 meses con omega 3/6 para todos. La mayoría no respondió al tratamiento con omega 3/6. Sin em- bargo, un subgrupo del 26% respondió con una reducción de más del 25% de los síntomas del TDAH y una caída de las puntuaciones CGI (Escala clínica global) al rango casi normal. Después de 6 meses, el 47% de todos mostró tal mejoría. Los respondedores tendían a tener un subtipo de falta de atención del TDAH y trastornos comórbidos del neurodesarrollo. |
| Moghaddam et al (2017). n: 40 niños de entre 6 y 12 años con TDAH en Zahedan (Irán). 33 varones (82.5%) y 7 mujeres (17.5%). ECA doble ciego. Los pacientes fueron divididos en dos grupos de MPH más PUFA y MPH más placebo. Medición: ADHD Rating Scale. La respuesta al tratamiento (una reducción de al menos un 25% en escala) en el grupo que tomó MPH más PUFA fue del 90% (18 pacientes) y en el grupo de metilfenidato más placebo fue del 60% (12 pacientes) (p = 0,028). |
| Bent et al (2014). ECA. n: 57 niños de 5 a 8 años, con TEA + TDAH. 1,3 gramos de omega-3 vs placebo idéntico al día durante 6 sema- nas. Se obtuvieron evaluaciones de resultados de los 57 participantes y 57 maestros, y el estudio se completó en 3 meses. Los niños del grupo de omega-3 tuvieron una mayor reducción de la hiperactividad (-5,3 puntos) en comparación con el grupo de placebo (-2,6 puntos), pero la diferencia no fue estadísticamente significativa (1,9 puntos más de mejora en el grupo de omega-3, IC del 95% = -2,2 a 5,2) |
| Milte et al (2013). Objetivo: Investigar los efectos de DHA y EPA sobre la atención, la alfabetización y el comportamiento de los niños con TDAH.ECA. n 90 niños. Grupo 1: suplementos con alto contenido de EPA, DHA Grupo control: AL. Duración 4 meses cada uno en un dise- ño cruzado. Se midieron los ácidos grasos de los eritrocitos, la atención, la cognición, la alfabetización y la CPRS a los 0, 4, 8 y 12 meses. 53 niños completaron el tratamiento. En niños con muestras de sangre (n = 76-46), el aumento de EPA + DHA en eritrocitos se asoció con una mejor ortografía, atención, comportamiento de oposición reducido, menor hiperactividad y mejoras en cognición. |
| Widenhorn-Müller (201. ECA, doble ciego. Duración 16 semanas. Grupo activo: altas dosis de EPA y DHA. n: 95 niños con TDAH. Para un subgrupo de 81 participantes, se analizó la composición de ácidos grasos de la membrana de eritrocitos antes y después de la intervención. Padres, maestros e investigadores evaluaron la conducta mediante escalas de calificación y cuestionarios estandarizados. Otras variables medi- das fueron la memoria de trabajo, la velocidad del procesamiento de la información y diversas medidas de atención. La suplementación con la mezcla de omega-3 aumentó las concentraciones de EPA y DHA en las membranas de eritrocitos y mejoró la función de la memoria de trabajo, pero no tuvo ningún efecto sobre otras medidas cognitivas y el comportamiento evaluado por padres y maestros en la población de estudio. La memoria de trabajo mejorada se correlacionó significativamente con un aumento de EPA, DHA y una disminución de AA (ácido araquidónico). |
| Barragán et al (2014). ECA.Objetivo: Comparar la eficacia de Omega-3/6 (Equazen eye q ™: Aceite de Pescado (550 mg), EPA (279 mg), Aceite de onagra rico en omega 6 (200 mg),), DHA (87 mg),, GLA (20 mg)) con el MPH y el MPH combinado + Omega-3/6 en niños con TDAH. n = 90. Asignados al azar a Omega-3/6, MPH de acción prolongada o combinación durante 12 meses. Los síntomas del TDAH se eva- luaron mediante la escala de calificación del TDAH y la escala de impresiones clínicas globales (CGI-S). Los síntomas del TDAH disminuyeron en todos los grupos de tratamiento. Aunque se encontraron diferencias significativas a favor de Omega + MPH sobre Omega-3/6 solo para las subescalas de TDAH Total e Hiperactividad-Impulsividad, los resultados en la subescala de Inatención fueron similares. Los puntajes de CGI-S disminuyeron lenta y constantemente con Omega-3/6, en comparación con una rápida disminución y un ligero aumento posterior en los brazos que contienen MPH. Los eventos adversos fueron numéricamente menos frecuentes con Omega-3/6 o MPH + Omega-3/6 que con MPH solo. |
| Perera et al (2012). 94niños (de 6 a 12 años) con TDAH tratados con MPH y terapia conductual estándar durante más de 6 meses, cuyos padres no informaron mejoras en el comportamiento y el aprendizaje académico, fueron asignados al azar (ECA) para recibir suplemen- tos con una combinación de omega-3 PUFAs (592,74 mg/día) + omega-6 PUFAs (361.5 mg/dí). El resultado se midió a los 3 y 6 meses después del tratamiento utilizando una lista de verificación de autoevaluación completada por los padres. Se encontró una mejora estadís- ticamente significativa en el grupo de tratamiento en comparación con el grupo de placebo (P <0.01) en las siguientes medidas: inquietud, agresividad, completar el trabajo y rendimiento académico. No se encontró una mejoría estadísticamente significativa a los 3 meses de tratamiento entre los grupos, pero fue evidente a los 6 meses de tratamiento (p <0,05). Los tamaños del efecto variaron de 0,3 a 1,1 a los |
| 3 meses y de 0,2 a 1,4 a los 6 meses para las variables de síntomas individuales. Anand et al (2016). ECA prospectivo doble ciego. n: 50 niños (4 a 11 años) con TDAH. El grupo de control recibió atomoxetina, mien- tras que el grupo de estudio recibió atomoxetina junto con EPA y ácido DHA. No mencionan dosis. Ambos grupos fueron seguidos cada 2 semanas durante los siguientes 4 meses usando la CPRS-R. El grupo de estudio tuvo una mayor reducción en las puntuaciones de TDAH en comparación con el grupo de control, aunque no estadísticamente significativo (p = 0,08). La mejora fue más significativa en los sujetos masculinos del estudio con un tipo combinado de TDAH. |
| Dashty et al (2013). ECA.n: 85 niños con TDAH (6 a 12 años, media 8,22 +/- 1.65). Medición: CPRS y CTRS. 29 tratados con MPH (0,3 a 1 mg/kg/día), 28 con omega-3 (1 g/día, no aclaran de qué tipo) y 28 con placebo. Se observaron asociaciones significativas entre la terapia con MPH y omega-3 (p <0,001). No hubo asociación significativa entre el grupo de placebo (p> 0.050). Mediciones a las 2 y 4 semanas. |
| Salehi et al (2016) ECA. n: 150 (6 a 15 años) recientemente diagnosticados con TDAH. 50 grupo control MPH (10 mg/día en niños de hasta 20 kg y el doble en más de 20) + placebo, 50 sulfato de Zn (22 mg/día)+ MPH y 50 omega 3 (100 mg EPA en niños<25 kg, 200 mg de 26–35 kg, y 400 mg >35 kg/día) + MPH. Se evaluaron con CPRS a las 2, 4 y 8 semanas. La suplementación con zinc acompañada del tratamiento principal mejora significativamente los síntomas del subtipo de trastorno por déficit de atención de TDAH. Sin embargo, la suplementación con omega-3 fue superior al zinc y al placebo en la mejora clínica del TDAH. |
| Rodriguez et al (2019). ECA. n: 66 TDAH (6 a 18 años). Duración 6 meses. Placebo (n 34) vs DHA 1000 mg + EPA 90 mg + docosapen- taenoico 150 mg + vit E 4,5 mg (1 sachet/día en niños de hasta 32 kg y 2 si pesaban más). 75% de pactes del grupo activo y 70,6 % del grupo placebo recibieron MPH o atomoxetina. Medición: d2-test, AULA Nesplora, EDAH y CPRS abreviado. En la prueba cognitiva, no se encontraron diferencias entre los grupos, pero las diferencias dentro del grupo fueron de mayor magnitud en el grupo de DHA. Se observa- ron diferencias entre los grupos a favor del brazo de DHA en las medidas de comportamiento, que ya se detectaron después de 3 meses de tratamiento. Los resultados no cambiaron cuando se ajustaron con la medicación para el TDAH. |
| Hawkey et al (2014). MTA de 16 estudios (n = 1408). La suplementación con omega 3 mejoró los síntomas compuestos del TDAH;(g = 0.26, 95% CI = 0.15–0.37; p <.001) y mostró efectos modestos pero confiables sobre la hiperactividad según el informe de los padres y maestros y efectos confiables para la falta de atención solo según el informe de los padres. |
| Chang et al (2018). MTA. En 7 RTC, (n = 534 jóvenes con TDAH), la suplementación con n-3 PUFA mejora las puntuaciones de los sínto- mas clínicos del TDAH (p=0,0001); y en 3 RTC, (n = 214 jóvenes con TDAH), la suplementación con n-3 PUFA mejora las medidas cogni- tivas asociadas con la atención (, p = 0,001). Además, los niños y adolescentes con TDAH tienen niveles más bajos de DHA (7 estudios, n = 412, p = 0,0002), EPA (7 estudios, n = 468, p = 0,0008) y n-3 PUFA totales (6 estudios, n = 396, p = 0,0001). Demuestra evidencia de que la monoterapia de suplementación con n-3 PUFA mejora los síntomas clínicos y el rendimiento cognitivo en niños y adolescentes con TDAH, y que estos jóvenes tienen una deficiencia en los niveles de n-3 PUFA. |
| Bélanger et al (2009) n: 26 niños. Duración: 16 semanas. Mediciones: SWAN y CPRS. Se dividieron en dos grupos (A y B) y participaron en un ECA cruzado, doble ciego, unidireccional. En la primera fase, el grupo A recibió el suplemento de PUFA n-3(Cápsulas:25 mg de PL +250 mg EPA + 100 mg DHA + 3.75 U vitamina E. 2 a 4 por día según peso). y el grupo B recibió PUFA n-6 (aceite de girasol) como placebo. Durante la segunda fase, el grupo B recibió el suplemento de PUFA n-3 activo que continuó en el grupo A. La composición de AG y el perfil de lípidos se evaluaron durante las fases del estudio. La suplementación con n-3 PUFA resultó en aumentos significativos en los ácidos EPA y DHA en el grupo A, mientras que el grupo B se enriqueció con ácidos alfa-ALA, GLA y homo-gamma-ALA. El suplemento de PUFA n-3 se toleró sin efectos adversos. Se observó una mejoría estadísticamente significativa en los síntomas basada en CPRS desde el inicio hasta el final de la fase 1, y esta mejoría continuó desde las fases 1 a 2, aunque los últimos cambios de las fases 1 y 2 no fueron estadísticamente significativos. en cualquiera de las subescalas excepto en la subescala que mide la falta de atención en el grupo B. La mejoría fue mayor en los pacientes del grupo A en la fase 1 y en los pacientes del grupo B en la fase 2. Un subgrupo de ocho pacientes (cuatro en cada grupo) mostró una mejoría clínica estadísticamente significativa después de la administración del suplemento de PUFA n-3, en particular para la falta de atención. |
| Firth et al (2019) MTA. En los 16 RTC que informaron sobre los dominios de los síntomas del TDAH, se observaron beneficios significativos tanto para la hiperactividad / impulsividad como para la falta de atención en escalas clínicas informadas por padres pero no por docentes. |
CPRS: Conner’s Parents Rating Scale CTRS: Conner´s Teacher Rating Scale DHA: ácido docosahexaenoico
ECA: ensayo clínico aleatorizado
EDAH: Scale for the Assessment of Attention Deficit Hyperactivity Disorder
EPA: ácido eicosapentaenoico
GLA: ácido gamma linoleico MPH: metilfenidato
MTA: metaanálisis NT: neurotípico
PUFA: ácido graso poliinsaturado
TDAH: Trastorno por déficit de atención e hiperactividad
SWAN: Strengths and Weaknesses in ADHD and Normal Behaviors
Selección de estudios (ver Tabla 2) y me- todología
Se realizó una búsqueda en BVS, Pub Med y Google Scho- lar con las siguientes palabras clave: “TDAH”, “omega 3”, “omega 6”, “PUFA”, “ácido eicosapentaenoico”, “ácido do- cosahexaenoico”, “metaanálisis”, “Ensayos clínicos aleato- rizados”, según descriptores DeCS/MeSH. Se priorizaron los ECA, MTA y un estudio observacional (incluido por su impor- tante n:810 niños de 5 a 12 años de edad).
Se consideró como resultado positivo la mejora en alguno de los dominios estudiados (atención, memoria, aprendizaje, impul- sividad, conducta, agresividad, humor, ansiedad), siempre en individuos que cumplían con criterios diagnósticos de TDAH.
Se seleccionaron 30 artículos, de los cuales 4 son MTA, 25 ECA y un estudio observacional.
De los ECA, 5 fueron cruzados (uno suplementando MPH), 5 cruzaron resultados clínicos con mediciones de PUFAs en plasma y/o glóbulos rojos y uno con fRNM .
4 estudios fueron realizados como suplementación al MPH y uno a la atomoxetina.
Resultados
De los 4 MTA, 3 obtuvieron datos positivos, con mejorías modestas a moderadas en los informes de padres, no de do- centes.
De los ECA, 21 demostraron mejoría moderada con respecto a placebo y en 4 no hubo diferencias estadísticamente signi- ficativas.
En el único estudio que utilizó fRNM no se demostraron cambios en áreas de procesamiento cognitivo a pesar del efec- to clínico, por lo que no estaría implicado el sistema DA en la acción de los omega 3.
En el estudio observacional incluido, se observó disminu- ción de síntomas TDAH, de síntomas emocionales y en cali- dad del sueño. Se utilizaron omega 3, 6 y Zn.
Con respecto a las mediciones de PUFAs en sangre y eritro- citos, hubo correlación con su aumento y mejoría clínica en 4 de los 5 estudios seleccionados.
De los 4 estudios ECA en donde no se demostró eficacia, en uno se utilizó una dosis baja de DHA sin otro agregado, en otro una dosis mayor de DHA en comparación con EPA (casi 5 veces). En el estudio de Bent et al (2011) se utilizó 1,3 g/ día de omega 3 sin especificar de qué tipo, mientras que el tiempo de evaluación utilizado por Dashty fue muy corto, de 2 a 4 semanas.
Conclusiones
Es interesante remarcar que la prematuridad, el bajo peso para la edad gestacional y el período de amamantamiento son factores predictores de aparición de TDAH, coincidente con lo explicado anteriormente sobre la importancia de los omega 3 en esos ítems.
Con respecto a los diversos resultados encontrados en la abundante literatura, habría muchas variables a tener en cuenta, como ser:
- Heterogeneidad metodológica.
- Trabajos con pocas n.
- Dosis variables.
Inclusión de otros componentes en el grupo activo además de omega 3, como Zn, Mg, Vit E, omega 6.
Inclusión de componentes que podrían tener un efecto en el grupo placebo, como ser aceite de oliva, canola, vit E, oli- goelementos.
No tener en cuenta el balance en la ingesta entre omega 3/6 y entre EPA/DHA.
Estudios de poco tiempo de duración, teniendo en cuenta que el cerebro necesita unos 3 meses para recuperar los ni- veles de PUFAs en caso de deficiencia (Richardson 2000).
Teniendo en cuenta el perfil benigno de efectos adversos y el efecto modesto pero positivo en el consumo de omega 3, además de efectos beneficiosos cardiovasculares, antiin- flamatorios, sobre el neurodesarrollo y varios síntomas psi- quiátricos, se recomienda su uso como adyuvante en el TDAH o como alternativa en caso de contraindicaciones o efectos adversos importantes con los fármacos de primera línea. Tam- bién sería una opción para aquellos casos en que los padres y/o pacientes prefieran no utilizar psicofármacos, siempre aclarando que no son de primera línea.
Bbliografía
- Anan P, Sachdeva A. (2016). Effect of Poly Unsaturated Fatty Acids Administration on Children with Attention Deficit Hyperactivi- ty Disorder: A Randomized Controlled Trial. Journal of Clinical and Diagnostic Research. Sep, Vol-10(9): OC01-OC05.
- Angemi J (2017). Diagnóstico y tratamiento del trastorno por déficit de atención e hipe- ractividad. En PROAPSI (Programa de actua- lización en psiquiatría). Quinto Ciclo. Módulo
4. Ed. Médica Panamericana. Bs As. Argen- tina.
- Assisi A, Banzi R, Buonocore C, Capasso F, Di Muzio V, Michelacci F, et al. (2006) Fish oil and mental health: the role of n-3 long- chain polyunsaturated fatty acids in cogniti- ve development and neurological disorders. International Clinical Psychopharmacolo- gy;21(6):319–36.
- APA (American Psychiatric Association) (2014). Manual diagnóstico y estadístico de los trastornos mentales. DSM-5. Editorial Mé- dica Panamericana. Madrid. España.
- Arnold L, Sandra Pinkham S, Votolato N. (2000) Does Zinc Moderate Essential Fatty Acid and Amphetamine Treatment of Atten- tion-Deficit/Hyperactivity Disorder? Journal of child and adolescent psychopharmacology, 10, 2,111-117.
- Bakker E, Ghys A, Kester A, Vles J, Dubas J, Blanco C et al. (2003) Long-chain polyun- saturated fatty acids at birth and cognitive function at 7 y of age. Eur J Clin Nutr;57:89- 95.
- Barragán E, Breuer D, Döpfner M. (2017) Efficacy and Safety of Omega-3/6 Fatty Acids, Methylphenidate, and a Combined Treatment in Children With ADHD. Journal of Attention Disorders.21(5):433-441.
- Bélanger A,Vanasse M, Spahis S,Sylvestre
M, Lippé S, l’Heureux F et al (2009). Ome- ga-3 fatty acid treatment of children with at- tention-deficit hyperactivity disorder: A ran- domized, double-blind, placebo-controlled study. Paediatr Child Health 2009;14(2):89- 98.
- Bent S, Hendren R, Zandi T, Kalb L, Nestle J, Law P et al. Internet-Based, Randomized, Controlled Trial of Omega-3 Fatty Acids for Hyperactivity in Autism. (2014) J of Am Acad Child and Adolesc Psychiatry. Vol 53, Issue 6, P658-666, June 01.
- Bloch M, Qawasmi A. (2011) Omega-3 fat- ty acid supplementation for the treatment of children with attention-deficit/hyperactivity disorder symptomatology: systematic review and metaanalysis. J Am Acad Child Adolesc Psychiatry 2011; 50 (10): 991-1000.
- Bos D, Oranje B, Veerhoek E, Van Diepen R, Wusten J,Demmelmair H et al (2015) Re- duced symptoms of inattention after dietary omega 3 fatty acid supplementation in boys with and without attention deficit/hyperacti- vity disorder. Neuropsychopharmacology 40: 2298–2306.
- Bozzatello P, De Rosa M, Rocca P, Bellino S.(2020). Effects of Omega 3 Fatty Acids on Main Dimensions of Psychopathology. Int.
J. Mol. Sci. 2020, 21, 6042; doi:10.3390/
ijms21176042.
- Brookes K, Chen W, Xu X, Taylor E, As- herson P. (2006). Association of fatty acid desaturase genes with attention-deficit/ hyperactivity disorder. Biol Psychiatry.Nov 15;60(10):1053-61.
- Chang J, Su K, Mondelli V, Satyanarayanan S, Yang H, Chiang Y et al (2019) High-dose eico- sapentaenoic acid (EPA) improves attention and vigilance in children and adolescents with atten- tion deficit hyperactivity disorder (ADHD) and low endogenous EPA levels. Translational Psy- chiatry 9:303 https://doi.org/10.1038/s41398-
019-0633-0.
- Chang J. Su K, Mondelli V ,Pariante C (2018) Omega-3 Polyunsaturated Fatty Acids in Youths with Attention Deficit Hype- ractivity Disorder: a Systematic Review and Meta-Analysis of Clinical Trials and Biologi- cal Studies. Neuropsychopharmacology 43, 534–545.
- Chapkin R, Akoh C, Miller C. (1991) In- fluence of dietary n-3 fatty acids on macro- phage glycerophospholipid molecular species and peptide leukotriene synthesis. J Lipid Res; 32: 1205-13.
- Clandinin M, Chappell J, Leong S, Heim T, Swyer P, Chance G (1980). Extrauterine fatty acid accretion in infant brain: implica- tions for fatty acid requirements. Early Hum Dev.4:131–8.
- Colquhoun I, Bunday S. (1981) A lack of essential fatty acids as a possible cause of hyperactivity in children. Med Hypotheses 1981; 7:673–79.
- Conklin S, Gianaros P, Brown S, Yao J, Hariri A, Manuck S, et al. (2007) Longchain omega-3 fatty acid intake is associated positi- vely with corticolimbic gray matter volume in healthy adults. Neurosci Lett.421:209–12.
- Covington M. (2004). Omega-3 Fatty Acids. Am Fam Physician; 70:133-40.
- Darwish, A. H., Elgohary, T. M. & Nosair,
N. A. (2019). Serum interleukin-6 level in children with attention-deficit hyperactivity disorder (ADHD). J. Child Neurol. 34, 61–67
- Dashti N, Hekmat H, Soltani HR, Rahim- del A, Javaherchian M. (2014) Comparison of therapeutic effects of omega-3 and methyl- phenidate (Ritalin®) in treating children with attention deficit hyperactivity disorder. Iran J Psychiatry Behav Sci 8(4): 7-11.
- FAO/FINUT. Grasas y ácidos grasos en Nutrición Humana. Online: www.fao.org/3/ i1953s.pdf Consultada enero 2021.
- Firth J, Teasdale S, Allott K, Siskind D, Marx W, Cotter J et al (2019) The efficacy and safety of nutrient supplements in the treatment of mental disorders: a meta-review of meta-analyses of randomized controlled trials. World Psychiatry;18:308–324).
- Fuentes-Albero M ,Martínez-Martínez M, Cauli O. (2019) Omega-3 Long-Chain Polyunsaturated Fatty Acids Intake in Chil- dren with Attention Deficit and Hyperactivity Disorder. Brain Sci.9, 120; doi:10.3390/bra- insci9050120.
- Gustafsson PA, Birberg-Thomberg U, Du- chén K, Landgren M, Malmberg K, Pelling H et al. (2010) EPA supplementation improves teacher–rated behavior and oppositional symp- toms in children with ADHD. Acta Paediatr; 99 (10): 1540-1549.
- Hamazaki T, Hirayama S. (2004) The effect of docosahexaenoic acid-containing food ad- ministration on symptoms of attention-deficit/ hyperactivity disorder – a placebo-controlled double-blind study. Eur J Clin Nutr; 58:838.
- Hariri M, Djazayery A, Djalali M, Saediso- meolia A, Rahimi A, Abdolahian E. (2012). Effect of n-3 supplementation on hyperac- tivity, oxidative stress and inflammatory mediators in children with attention-defi- cit-hyperactivity disorder. Malays J Nutr. Dec;18(3):329-35.
- Hawkey E, Nigg J. (2014) Omega—3 fat- ty acid and ADHD: Blood level analysis and meta-analytic extension of supplementa- tion trials. Clin Psychol Rev. August; 34(6): 496–505.
- Hibbeln J, Gow R. (2014) Omega-3 Fatty Acid and Nutrient Deficits in Adverse Neuro- development and Childhood Behaviors. Child Adolesc Psychiatr Clin N Am. July; 23(3): 555–590.
- Hirayama S, Hamazaki T, Terasawa K (2004). Effect of docosahexaenoic acid-con- taining food administration on symptoms of attention-deficit/ hyperactivity disorder—a placebo-controlled double blind study. Euro- pean Journal of Clinical Nutrition 58, 467– 473.
- Huss M, Volp A, Stauss-Grabo M. (2010) Supplementation of polyunsaturated fatty acids, magnesium and zinc in children see- king medical advice for attention deficit/ hyperactivity problems- an observational cohort study. Lipids in Health and Disease; 9:105.
- in ‘t Veld B, Ruitenberg A, Hofman A, Lau- ner L, van Duijn C, Stijnen T et al. (2001) Nonsteroidal antiinflammatory drugs and the risk of Alzheimer’s disease. N Engl J Med; 345:1515-1521.
- Johnson M, Östlund S, Fransson G, Kadesjö B,Gillberg C. (2009) Omega-3/Omega-6 Fa- tty Acids for Attention Deficit Hyperactivity Disorder: A Randomized Placebo-Controlled Trial in Children and Adolescents. J of Att. Dis. 2009; 12(5) 394-401).
- Kean J, Sarris J, Scholey A, Silberstein R,- Downey L, Stough C.(2017) Reduced inatten- tion and hyperactivity and improved cognition after marine oil extract (PCSO-524®) supple- mentation in children and adolescents with clinical and subclinical symptoms of atten- tion-deficit hyperactivity disorder (ADHD): a randomised, double-blind, placebo-controlled trial. Psychopharmacology 234:403–420.
- Kidd P (2007) Omega-3 DHA and EPA for Cognition, Behavior, and Mood: Clinical Fin- dings and Structural-Functional Synergies with Cell Membrane Phospholipids. Altern Med Rev;12(3):207-227).
- Kohlboeck G, Glaser C, Tiesler C, Demmel- mair H, Standl M, Romanos M et al (2011) Effect of fatty acid status in cord blood serum on children’s behavioral difficulties at 10 y of age: results from the LISAplus study. Am J Clin Nutr 94(6):1592–1599.
- LaChance L, McKenzie K,Taylor V, Vigod
S. Omega-6 to Omega-3 Fatty Acid Ratio in Patients with ADHD: A Meta-Analysis (2016) J Can Acad Child Adolesc Psychiatry, 25:2, Spring.
- Lakhan S, Vieira K. (2008). Nutritional the- rapies for mental disorders. Nutrition Journal, 7:2 doi:10.1186/1475-2891-7-2.
- Lavialle M, Denis I, Guesnet P, Vancassel S. (2010) Involvement of omega-3 fatty acids in emotional responses and hyperactive symp- toms. J Nutr Biochem; 21(10): 899-905.
- Lozano J, Galindo j, García- Borrón J, Mar- tinez- Liarte J, Peñafiel R, Solano F. (2005) Bioquímica y biología molecular para ciencias de la salud. Ed McGraw Hill-Interamericana. Madrid. España.
- Manor I, Magen A, Keidar D, Rosen S, Tas- ker H, Cohen T, et al. (2012) The effect of phosphatidylserine containing Omega3 fat- ty-acids on attention-deficit hyperactivity di- sorder symptoms in children: A double-blind placebo-controlled trial, followed by an open-label extension. Eur Psychiatry; 27(5): 335-342.
- Matsudaira T,Gow R, Kelly J,Murphy C, Potts L , Sumich A et al (2015) Biochemi- cal and Psychological Effects of Omega-3/6 Supplements in Male Adolescents with At- tention Deficit/Hyperactivity Disorder: A Ran- domized, Placebo-Controlled, Clinical Trial. journal of child and adolescent psychophar- macology.Volume 25, Number 10,775:782.
- McCann J, Ames B. (2005) Is docosahexae- noic acid, an n-3 long-chain polyunsaturated fatty acid, required for development of normal brain function? An overview of evidence from cognitive and behavioral tests in humans and animals. Am J Clin Nutr;82:281-295.
- McNamara R, Strawn J (2013) Role of Long-Chain Omega-3 Fatty Acids in Psychia- tric Practice. PharmaNutrition. April; 1(2): 41–49.
- Messamore E, MacNamara R. (2016) De- tection and treatment of omega-3 fatty acid
deficiency in psychiatric practice: Rationale and implementation. Lipids in Health and Disease 15:25 DOI 10.1186/s12944-016- 0196-5.
- Milte C, Parletta N, Buckley J, Coates A, Young R, Howe P. (2015). Increased Erythrocyte Eicosapentaenoic Acid and Doco- sahexaenoic Acid Are Associated With Impro- ved Attention and Behavior in Children With ADHD in a Randomized Controlled Three-Way Crossover Trial. Journal of Attention Disor- ders.19(11):954-964.
- Mitchell E, Aman M, Turbott S, Manku M (1987): Clinical characteristics and serum essential fatty acid levels in hyperactive chil- dren. Clin. Pediatr. 26, 406–411.
- Moghaddam M, Shamekhi M, Rakhshani T (2017). Effectiveness of methylphenidate and PUFA for the treatment of patients with ADHD: A double-blinded randomized clinical trial. Elec- tronic Physician. May,Vol: 9, Issue: 5, Pages: 4412-4418.
- Montgomery P, Burton J, Sewell R, Sprec- kelsen T, Richardson A. (2013) Low blood long chain omega-3 fatty acids in UK chil- dren are associated with poor cognitive per- formance and behavior: a cross sectional analysis from the DOLAB study. PLoS One 2013; 8 (6): e66697.
- NIDDK (National Institute of Diabetes and Digestive and Kidney Diseases). (2012). Li- ver Tox: Clinical and Research Information on Drug-Induced Liver Injury. Omega-3 Fatty Acids.
- Otaegui-Arrazola A, Amiano P, Elbusto A, Urdaneta E,Martinez-Lage G.( 2014) Diet, cognition and Alzheimer’s disease: food for thought. Eur J Nutr Feb;53(1):1-23.
- Peet M, Stokes C. (2005) Omega-3 fatty acids in the treatment of psychiatric disor- ders. Drugs; 65 (8):1051-9.
- Plourde M, Cunnane S. (2007) Extremely limited synthesis of long chain polyunsatu- rates in adults: implications for their dietary essentiality and use as supplements. Appl Physiol Nutr Metab;32:619-634.
- Ramakrishnan U, Gonzalez-Casanova I, Schnaas L, DiGirolamo A, Quezada A, Pallo B et al (2016). Prenatal supplementation with DHA improves attention at 5 y of age: a randomized controlled trial. Am J Clin Nutr; 104:1075–82.
- Raz R, Gabis L. (2009) Essential fatty acids and attention-deficit–hyperactivity disorder: a systematic review. Developmental Medicine & Child Neurology 51; 580–592.
- Richardson A, Puri B. (2002) A randomized double blind, placebo-controlled study of the effects of supplementation with highly unsatu- rated fatty acids on ADHD-related symptoms in children with specific learning difficulties. Prog Neuropsychopharmacol Biol Psychiatry; 26:233-239.
- Richardson A, Montgomery P. (2005) The Oxford-Durham Study: A Randomized, Contro-
lled Trial of Dietary Supplementation with Fatty Acids in Children with Developmental Coordi- nation Disorder. Pediatrics May 2005, 115 (5)
1360-1366.
- Richardson A. Omega-3 fatty acids in ADHD and related neurodevelopmental disor- ders. Int Rev Psychiatry 2006; 18:155-172.
- Rioux F, Innis S, Dyer R, MacKinnon M (1997) Diet-induced changes in liver and bile but not brain fatty acids can be predicted from differences in plasma phospholipid fatty acids in formula and milk fed piglets. J Nutr 127: 370–77.
- Rodriguez C, García T, Areces D, Fernan- dez E, García-Noriega M, Domingo J (2019). Supplementation with high-content doco- sahexaenoic acid triglyceride in attention deficit hyperactivity disorder: a randomized double-blind placebo-controlled trial. Neu- ropsychiatric Disease and Treatment 15 1193–1209.
- Ruiz-Lázaro Pedro Manuel. (2014) Acidos grasos poliinsaturados (PUFAS) en el trata- miento del déficit de atención con y sin hi- peractividad (TDAH). revista de psiquiatría infanto-juvenil núm 3/julio-septiembre.
- Salehi B, Mohammadbeigi A, Sheykholes- lam H, Moshiri E, Dorreh F. (2016) Omega-3 and Zinc supplementation as complementary therapies in children with attention-deficit/ hyperactivity disorder. J Res Pharm Pract 5:22-6.
- Salem N, Jr., Litman B, Kim HY, Gawrisch
K. (2001) Mechanisms of action of doco- sahexaenoic acid in the nervous system. Li- pids; 36:945–59.
- SanGiovanni J, Parra-Cabrera S, Colditz G, Berkeley C, Dwier J.(2000) Meta-analysis of dietary essential fatty acids and long-chain polyunsaturated fatty acids as they relate to visual resolution acuity in healthy preterm in-
fants. Pediatrics; 105:1292-1298.
- Serhan CN. Eicosanoids in leukocyte func- tion. Curr Opin Hematol 1994; 1:69-77.
- Simopoulos A. (2002). Omega-3 fatty acids in inflammation and autoimmune diseases. J Am Coll Nutr. 2002; 21(6):495–505.
- Sinn N, Bryan J (2007). Effect of Supple- mentation with Polyunsaturated Fatty Acids and Micronutrients on Learning and Behavior Problems Associated with Child ADHD. J Dev Behav Pediatr. Apr;28(2):82-91.
- Stein J. The magnocellular theory of develo- pmental dyslexia. Dyslexia. 2001; 7:12–36.
- Stevens L, Zentall S, Deck J, Abate M, Wa- tkins B, Lipp S et al. (1995): Essential fatty acid metabolism in boys with attention-defi- cit hyperactivity disorder. Am. J. Clin. Nutr. 62, 761–768.
- Stevens L, Zentall S, Abate M, Kuczek T, Burgess R (1996) Omega-3 fatty acids in boys with behavior, learning, and health pro- blems. Physiol Behav;59:915-920.
- Stevens L, Zhang W, Peck L, Kuczek T, Grevstad N, Mahon A et al, (2003) EFA su- pplementation in children with inattention, hyperactivity, and other disruptive behaviors. Lipids 2003;38:1007-1021.
- Stillwell W, Shaikh S, Zerouga M, Siddiqui R, Wassall S. (2005) Docosahexaenoic acid affects cell signaling by altering lipid rafts. Reprod Nutr Dev.Sep-Oct;45(5):559-79.
- Tapia A (2005). La suplementación con ácidos grasos omega-3 disminuye la agresi- vidad, hostilidad y el comportamiento antiso- cial. Rev Chil Nutr Vol. 32, N°2, Agosto.
- Thomson AB, Schoeller C, Keelan M, Smi- th L, Clandinin M. (1993). Lipid absorp- tion: passing through the unstirred layers, brush-border membrane, and beyond. Can J Physiol Pharmacol;71:531-555.
- Tsukada H, Kakiuchi T, Fukumoto D, Nishi-
yama S, Koga K. (2000) Docosahexaenoic acid (DHA) improves the age-related impairment of the coupling mechanism between neuronal ac- tivation and functional cerebral blood flow res- ponse: a PET study in conscious monkeys. Brain Res.862:180–6.
- Vaisman N, Kaysar N, Zaruk-Adasha Y, (2007). Effect of phospholipids enriched with omega-3 fatty acids on symptoms of attention deficit and hyperactivity disorder (ADHD) in children. Pediatric Academic Societies Mee- ting. Toronto, Canada.
- Voigt R, Llorente A, Jensen C, Fraley J,- Berretta M, Heird W. (2001) A randomized, double-blind, placebo-controlled trial of docosahexaenoic acid supplementation in children with attention-deficit/hyperactivity disorder. J Pediatr;139:189-196.
- Waitzberg D, Garla P. (2014) Contribu- ción de los Ácidos Grasos Omega-3 para la Memoria y la Función Cognitiva. Nutr Hosp;30(3):467-477.
- Widenhorn-Müller K, Schwanda S, Scholz E, Spitzer M, Bode H. (2014) Effect of su- pplementation with long-chain w-3 polyun- saturated fatty acids on behavior and cog- nition in children with attention deficit/ hyperactivity disorder (ADHD): a randomized placebo-controlled intervention trial. Pros- taglandins Leukot Essent Fatty Acids.Jul- Aug;91(1-2):49-60.
- Young C, Hikita T, Kaneko S, Yimizu Y, Ha- naka S, Abe T et al (1997) Fatty acid com- positions of colostrum, cord blood, maternal blood and major infant formulas in Japan. Acta Paediatr Jpn ;39:299-304.
- Young G, Maharaj N, Conquer JA (2004) Blood phospholipid fatty acid analysis of adults with and without attention deficit/ hyperactivity disorder. Lipids; 39:117-123.







No comments! Be the first commenter?