Hemorragias digestivas en pacientes tratados con inhi- bidores selectivos de recaptación de serotonina (ISRS)
Resumen
Planteamiento del problema: los inhibidores selectivos de la recaptación de serotonina (ISRS) son la piedra angular del tra- tamiento de varias patologías psiquiátricas, incluyendo la depresión, trastorno de ansiedad generalizada, trastorno obsesivo/ compulsivo, etcétera.
La depresión es la sexta causa más común de asistencia sanitaria (alrededor de 20.3 millones en 2005) (IMS Health, 2006). También en 2005 había 122.500.000 recetas de ISRS e inhibidores selectivos de serotonina y noradrenalina (IRSN) distribui- dos en EE.UU., lo que hacía que este tipo de psicofármacos ocupasen el quinto lugar de los fármacos más prescriptos.
Con la prevalencia de la depresión y el uso de ISRS correspondiente es importante examinar el perfil de efectos adversos de estos agentes, incluso de aquellos raros que pueden afectar un número significativo de pacientes.
Muchos pacientes con patología psiquiátrica se encuentran recibiendo tratamientos con ISRS, así como muchos otros pa- cientes desarrollan patologías psiquiátricas en el curso de su enfermedad que requiere un abordaje psicofarmacológico. La prevalencia de las psicopatologías, así como el uso continuo de psicofármacos ISRS en la práctica clínica asistencial diaria genera la necesidad de conocer los riesgos, precauciones y el mejor manejo para el profesional.
Justificación: en los últimos años, la evolución de las patologías psiquiátricas registró cambios en las características pobla- cionales y factores asociados con las evoluciones de las patologías y de sus tratamientos. La prevalencia de enfermedades psiquiátricas cada vez es mayor en la población general.
Varios informes de casos han demostrado asociaciones entre los ISRS y los trastornos hemorrágicos. La mayoría de los pacien- tes tenía trastornos hemorrágicos leves, como por ejemplo, equimosis, púrpura, epistaxis o tiempo de hemorragia prolongado, pero algunos tenían afecciones más graves, como hemorragia gastrointestinal, hemorragia genitourinaria y hemorragia intracra- neal (Evans, 1991) (Montero, 1996).
La liberación de serotonina de las plaquetas tiene un papel importante en la regulación de la respuesta hemostática a la lesión vascular (Sanders, 1996) (Li, 1997). La serotonina no se sintetiza en las plaquetas, sino que es transportada por los transportadores de serotonina en las mismas, que son similares a los del cerebro humano. A dosis terapéuticas, la fluoxetina y otros inhibidores selectivos de la recaptación de serotonina han demostrado consistentemente que bloquean esta captación de serotonina por las plaquetas, lo que lleva a un agotamiento de la serotonina después de varias semanas de tratamiento. Es posible que estos medicamentos perjudiquen la función hemostática, al menos en ciertas condiciones, y por lo tanto aumentan el riesgo de sangrado. Probamos esta hipótesis con datos de un estudio de casos y controles en curso, que se estableció para estimar el riesgo de complicaciones de la úlcera de los medicamentos antiinflamatorios no esteroideos.
Hipótesis: 1. En la bibliografía se describe mayor prevalencia de hemorragias gastrointestinales por uso de antidepresivos
inhibidores selectivos de recaptación de serotonina que la que se estima hoy en día.
- La prevalencia de este efecto adverso por el uso de este tipo de antidepresivo por sí mismo y las interacciones específicas entre éstos psicofármacos con otros fármacos son datos relevantes y a tener en cuenta en el contexto clínico-asistencial de la población que recibe tratamiento.
- La mayor prevalencia de este efecto adverso descripto en la bibliografía con el uso de ISRS tiene relevancia para la práctica clínica de los médicos.
- En la bibliografía científica se reportaron interacciones específicas entre tipo de neuropsicofármaco y otros fármacos.
Objetivos: el objetivo general del presente trabajo es describir una reacción adversa poco descripta en el manejo neuropsico- farmacológico de ISRS, a fin de lograr una intervención terapéutica con fármacos basada en la evidencia, tendiente a reducir el riesgo de sangrado gastrointestinal por uso de antidepresivos inhibidores de recaptación de serotonina.
Los objetivos específicos son:
- Describir las bases fisiopatológicas implicadas en el desarrollo de hemorragias gastrointestinales por el uso de antidepresivos ISRS.
- Realizar una revisión bibliográfica sobre el riesgo de sangrado gastrointestinal en pacientes tratados con antidepresivos inhibidores de la recaptación de serotonina.
- Describir las interacciones farmacológicas entre este tipo de psicofármacos y otros fármacos.
Marco teórico: el marco teórico estará conformado por los conceptos que se utilizarán a continuación. Persona padeciendo sintomatología depresiva es aquella que presenta síntomas de la serie depresiva, ya sea en la esfera del ánimo, de la cognición o neurovegetativa. El diagnóstico de las mismas es básicamente clínica, sin necesidad de utilizar imágenes, estudios serológicos o cualquier otro tipo de estudio.
Una vez diagnosticada la depresión, se implementa una terapéutica basada en la psicoterapia y/o en la psicofarmacología. En la última terapéutica encontramos muchas veces a los antidepresivos, como principal prescripción. Dentro de los antidepresi- vos encontramos a los inhibidores selectivos de la recaptación de serotonina (ISRS) como los más recetados, dada su reconocida eficacia en el tratamiento de la depresión (particularmente la unipolar).
Toda prescripción de un psicofármaco busca un efecto terapéutico sin dejar de lado los efectos adversos, muchas veces men- cionados como colaterales o “no deseados” y es en este punto donde buscamos ahondar. Los ISRS pueden provocar distintos tipos de sangrado pero en este trabajo desarrollaremos el sangrado gastrointestinal. El sangrado o hemorragia gastrointestinal es la pérdida de sangre en algún sector del tubo digestivo. Se clasifican en leves, moderadas o graves, según el volumen de la pérdida hemática. Sus principales manifestaciones son: hematemesis (vómito de sangre fresca) y o la melena (evacuación de heces alquitranadas). También puede manifestarse por enterorragia, principalmente cuando el tránsito intestinal es acelerado. Los motivos del sangrado pueden ser varios, algunos propios del tracto y otros secundarios como las neoplasias, los trastornos vasculares o la utilización de fármacos.
La hemostasia son los procesos fisiológicos que tienen como función detener las hemorragias secundarias a la lesión vascu- lar, que se conocen como la formación del coágulo. Se forma de dos fases, la primaria y la secundaria. La hemostasia primaria se divide en 2 etapas: la primera de vasoconstricción (inmediatamente posterior a la lesión vascular) rápida para disminuir la hemorragia. La segunda es el inicio de formación del trombo plaquetario o “trombo blanco” en el cual las plaquetas se dirigen al endotelio para adherirse a él. Una vez adheridas las plaquetas se activan, liberando sustancias entre ellas la serotonina (que estimulan la agregación plaquetaria).
El uso de antidepresivos inhibidores selectivos de la recaptación de serotonina provoca, secundariamente al efecto tera- péutico deseado, una disminución del ingreso de serotonina a la plaqueta. Cuando los niveles de serotonina en las plaquetas descienden por debajo de cierto nivel, la capacidad de unión de las plaquetas para formar un coágulo es menor provocando un mayor riesgo de sangrado.
Palabras clave
Hemorragias digestivas – Antidepresivos – Inhibidores selectivos de la recaptación de serotonina – Reacciones adversas medicamentosas – Interacciones medicamentosas.
García Matías, Leva Analía. “Hemorragias digestivas en pacientes tratados con inhibidores selectivos de recaptación de serotonina (ISRS)”. Psicofarmacología 2021;127:15-30. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
En los pacientes deprimidos, los péptidos coagulatorios se- cretados por las plaquetas aumentan, las plaquetas se agregan con más fuerza a un estímulo dado, la reactividad de las plaquetas al estrés leve aumenta y existe una mayor densidad de receptores. El estado “hipercoagulable” secundario al aumento de la activación plaquetaria en pacientes deprimidos se postula como uno de los mecanismos que explican el mayor riesgo de enfermedad vascular isquémica asociada con el diagnóstico de depresión mayor (Roose, 2016). Por el
contrario a este efecto muchos autores postulan que el uso de antidepresivos serotoninérgicos pueden contrarrestar el efecto procoagulante de la ansiedad y/o depresión (Geiser, 2011), pero que también aumentan el riesgo de sangrado estableciendo que el bloqueo de la recaptación de serotonina, entre otros neurotransmisores, disminuye significativamente el contenido de serotonina de las plaquetas (la paroxetina, por ejemplo, reduce la concentración de serotonina plaquetaria en un 83 % (Hergovich, 2000)) y, en consecuencia, reduce la función plaquetaria normal. Las plaquetas absorben y almacenan en densos gránulos la serotonina sintetizada por las células enterocromafines en el intestino a través del transportador de serotonina ubicado en la membrana (Roose, 2016). La serotonina, un compuesto químico natural del cuerpo, es necesaria para el correcto funcionamiento de las plaquetas. Cuando los niveles de serotonina en las plaquetas descienden por debajo de cierto nivel, la capacidad de unión de las pla- quetas para formar un coágulo es menor.
Durante mucho tiempo se pensó que los ISRS (Inhibidores Selectivos de Recaptación de Serotonina) y los ISRN (Inhibidores selectivos de la recaptación de serotonina y noradrenalina) producen un aumento en el tiempo de sangrado y hay muchos informes de casos clínicos que asocian el uso de ISRS con manifestaciones de sangrado anormal, como la equimosis, la menorragia y la hemoptisis. A modo de simplificar la temática solo nos referiremos a los ISRS, aunque es razonable sobre la base de los datos disponibles suponer que la siguiente discusión puede extenderse más allá del uso de los ISRS, como por ejemplo los antidepresivos tricíclicos terciarios (imipramina, amitriptilina y clomipramina) que también bloquean la captación de serotonina.
Los ISRS se prescriben en el 11 % de las personas mayores de 12 años que padecen síntomas depresivos en los Estados Unidos, lo que representa entre 28 y 30 millones de personas (Roose, 2016).
En cuanto a la consecuencia de hemorragia un metaanálisis reciente concluyó que el riesgo de sangrado general aumenta al menos un 36 % (del 12 % al 64 %), según el alto nivel de estudios observacionales, con el uso de ISRS (Laporte, 2016). Este estudio a su vez menciona 4 grandes tipos de hemorragias que sabemos que producen los ISRS: gastroin- testinal (GI), posparto, posoperatorio y accidente cerebrovas- cular hemorrágico. Por su parte Andrade y colaboradores, en un estudio realizado en el mismo año, menciona además otros tipos de hemorragias también como son: hematoma epidu- ral, retrobulbar, patelar, epistaxis, etcétera (Andrade, 2016). Mas allá de los sangrados mencionados, en este trabajo nos centraremos en un tipo de hemorragia particular que es la hemorragia gastrointestinal.
Un componente crítico de la activación plaquetaria es la secreción de serotonina. La serotonina es esencial para la función plaquetaria normal, ya que realiza los siguientes efectos: 1) vasoactivación a través de la acción directa sobre los receptores de serotonina y la producción de óxido nítrico, 2) potenciación de la agregación inducida por el difosfato de adenosina, la epinefrina y colágeno, y 3) mejora de la formación de fibrina (Roose, 2016).
Objetivo
El objetivo del presente artículo es realizar una revisión bibliográfica sobre cuánto es el riesgo de sangrado gastroin- testinal en pacientes tratados con antidepresivos inhibidores selectivos de la recaptación de serotonina.
Materiales y métodos
Se realizó una búsqueda en libros de medicina y en Pub- med, en esta última con combinaciones de los siguientes términos: “bleeding gastrointestinal”, “depression unipolar”, “depression bipolar”. Los estudios de interés elegidos para desarrollar el tema en cuestión son de las siguientes meto- dologías:
- Metaanálisis
- Estudios retrospectivos
- Estudios de cohorte.
- Estudios de casos y controles.
Resultados
- Conceptos básicos relacionados con hemorragias:
- Fases de la hemostasia
a.1. Formación del trombo planetario
Al lesionarse el vaso, las plaquetas se adhieren al sitio da- ñado, que suele ser la superficie de la capa íntima al descu- bierto. La adhesión plaquetaria es mediada sobre todo por el factor de Von Willebrand (vWF), proteína que está en plasma y en la matriz extracelular de la pared subendotelial de los va- sos, que actúa como “adhesivo molecular primario” evitando que las fuerza de cizallamiento de la corriente de sangre la desprendan. A su vez la adhesión plaquetaria es facilitada por la unión directa a la colágena subendotelial por los receptores específicos de dicha sustancia en la membrana plaquetaria.
La adhesión plaquetaria causa la activación y agregación de los trombocitos y este proceso se intensifica y amplifica por mediadores humorales en el plasma (adrenalina y trombina); mediadores liberados de las plaquetas activadas (difosfato de adenosina y la serotonina) y los constituyentes de la matriz extracelular de la pared de vaso que se ponen en contacto con las plaquetas adherentes (colágena o vWF).
Las plaquetas activadas pasan por una reacción de libera- ción en la cual secretan su contenido, que estimula aún más la agregación e inhibe los factores naturales anticoagulantes de las células del endotelio. En la agregación (interacción en- tre una plaqueta y otra) hay reclutamiento de más plaquetas desde la circulación hasta el sitio de la lesión vascular, con la cual se forma el llamado trombo blanco oclusivo, hecho
de plaquetas, fijado y estabilizado con la trama de fibrina en evolución.
Al activarse los trombocitos se activan los receptores de membrana plaquetaria GpIIb/IIIa que permite la unión al fibri- nógeno y al vWF, en el sitio de lesión vascular, generando un “agregado” oclusivo por medio de una red densa de puentes fibrinógeno intercelulares. El receptor es el medidor básico de la agregación plaquetaria y por ello se ha vuelto un “ele- mento” eficaz para ser modificado por medio de tratamiento antiplaquetario.
a.2. Formación del coágulo de fibrina
Las proteínas de coagulación (factores de coagulación) que generalmente circulan inactivos por el plasma, al activarse, sufren una serie de reacciones que culminan en la formación de fibrina. Estas reacciones se conocen como “cascada” y se conocen dos vías: vía extrínseca (factor hístico) y vía intrínseca (por contacto).
Se sabe que la coagulación empieza al exponerse y acti- varse el factor hístico (TF, tissue factor) por la vía extrínseca clásica, pero con amplificación muy importante por la partici- pación de elementos de la vía intrínseca clásica. Todos estos eventos se dan lugar en la capa fosfolipídica, en la plaqueta activada.
Al exponerse la lesión vascular se expone el factor hístico (TF) que se expresa en forma constitutiva en las superficies de los componentes celulares del subendotelio de la pared, como las células de fibra lisa y los fibroblastos. Dicho factor se liga al factor VIIa de serina proteasa; el complejo activa el factor X y se transforma en Xa. Otra posibilidad es que el complejo active de manera indirecta el factor X e inicialmente transforme el factor IX en IXa, que luego activa el factor X. la participación del factor XI en la hemostasia no depende de su activación por el factor XIIa, sino más bien de su activación retroalimentaria positiva por parte de la trombina. De este modo, el factor XIa actúa en la propagación y amplificación y no en el desencadenamiento de la cascada de coagulación. El factor Xa, que se forma por las acciones del complejo de factor hístico/factor VIIa o el factor IXa (con el factor VIIIa como cofactor), transforma la protrombina en trombina, que es la proteasa fundamental del sistema de coagulación. El co- factor esencial de dicha reacción es Va. Semejante a su homó- logo, el factor VIIIa, el factor Va es producido por la proteólisis limitada del factor V, inducida por la trombina. La trombina es una enzima multifuncional que transforma el fibrinógeno plasmático soluble en una matriz insoluble de fibrina. La poli- merización de la fibrina entraña un poco ordenado de vínculos intermoleculares. La trombina también activa el factor XIII (factor estabilizador de fibrina) hasta la forma de factor XIIIa, que se enlaza en forma covalente y con ello estabiliza el coá-
gulo de fibrina.
El ensamblado de los factores de coagulación en las superficies activadas de la membrana celular acelera mucho la velocidad de sus reacciones, y también sirve para circunscribir la coagulación a los sitios de lesión vascular. Los fosfolipidosácidos, componentes fundamentales de la membrana celular, no están expuestos normalmente a las superficies de la membrana de la célula en reposo. Sin embargo, cuando las plaquetas se activan por medio de lesiones vasculares o estímulos inflamatorios, los radicales procoagulantes de los fosfolipídos de la membrana aniónica sufren translocación a las superficies de estas células o se liberan como parte de micropartículas, dejándolas disponibles para que apoyen y favorezcan las reacciones de coagulación en el plasma.
Varios mecanismos antitrombóticos fisiológicos actúan en forma concertada, en circunstancias normales, para evitar la coagulación. Tienen como finalidad de conservar la fluidez de la sangre y limitar su coagulación a los sitios específicos de lesión vascular. Las células endoteliales ejercen muchos efectos antitrombóticos; producen prostaciclina, oxido nítri- co y ectoADPasa/CD39, que inhibe la unión, la secreción y la agregación plaquetaria. Las células del endotelio producen factores anticoagulantes que incluyen proteoglucanos como el heparano; antitrombina; inhibidor de la vía de TF, y trom- bomodulina. También activan mecanismos fibrinolíticos por medio de la producción del activador I de plasminógeno y la anexina 2.
La antitrombina es el principal inhibidor proteásico de trom-
bina en el plasma y de los demás factores de coagulación. La antitrombina neutraliza la trombina y otros factores de coagu- lación activados mediante la formación de un complejo entre el sitio activo de la enzima y el centro reactivo de la antitrom- bina. La velocidad de formación de estos complejos inactiva- dores aumenta en un factor de miles en presencia de hepa- rina. La inactivación de trombina por antitrombina, y de otros factores activados de coagulación, se realiza por mecanismos fisiológicos en las superficies vasculares, en las cuales están presentes glucosaminoglucanos, como los sulfatos de heparano, que catalizan estas reacciones. Las deficiencias de antitrombina cuantitativas o cualitativas de tipo hereditario ocasionan una predisposición permanente a la tromboembolia venosa.
La proteína C es una glucoproteina plasmática que se transforma en sustancia anticoagulante cuando es activada por la trombina. La activación de la proteína C inducida por la trombina ocurre por mecanismos fisiológicos en la trombomodulina, un sitio de unión de proteoglucanotransmembrana para la trombina en la superficie de la célula endotelial. La unión de la proteína C con su receptor en las células endoteliales la coloca muy cerca del complejo de trombina-trombomodulina, y de este modo intensifica su eficiencia activadora. La proteína C activada actúa como anticoagulante al escindir e inactivar los factores V y VIII activados. Dicha reacción es acelerada por un cofactor, la proteína S que, a semejanza de la proteína C, es una glucoproteina que experimenta modificaciones postraduccionales que dependen de la vitamina k. Las deficiencias cuantitativas o cualitativas de una y otra proteína (C o S) o
la resistencia a la acción de la proteína C activada por una mutación específica en su sitio de escisión predeterminado en el factor Va (factor V de Leiden), causa estados de hiper- coagulabilidad.
El inhibidor de la vía del factor hístico (TFPI) es una pro- teasa plasmática inhibidora que regula la vía de coagulación extrínseca inducida por TF, EI TFPI inhibe el complejo TF/ FVIIa/FXa, de manera que impide que TF/FVIIa comience la coagulación, la que depende, entonces, del “asa de amplifi- cación”, vía la activación de factores XI y VIII por parte de la trombina. EL TFPI está unido a la lipoproteína y también pue- de ser liberado por la heparina desde las células endoteliales, sitio en que está unido a los glucosaminoglucanos, y también desde las plaquetas. La liberación de TFPI mediada por hepa- rina no fraccionada y la de bajo peso molecular.
a.3. El sistema fibrinolítico
La trombina que escapa a los efectos inhibidores de los sistemas anticoagulantes fisiológicos queda disponible para transformar el fibrinógeno en fibrina. En respuesta, el sistema fibrinolítico endógeno es activado para disponer de la fibrina intravascular y con ello conservar o restablecer el libre trán- sito de la circulación. De la misma forma que la trombina es la proteasa fundamental del sistema de coagulación, la plas- mina lo es en el sistema fibrinolítico, al digerir la fibrina y generar su productos de degradación.
Los activadores de plasminógeno, que son el activador de tipo hístico y el de tipo urocinasa, separan Arg560-Val561 unida al plasminógeno, para generar la plasmina, enzima ac- tiva. Los sitios de unión a lisina presentes en la plasmina (y el plasminógeno) le permiten unirse a la fibrina, de tal manera que la fibrinólisis fisiológica es “fibrino-específica”. El plas- minógeno (por medio de sus sitios de unión a lisina) y tPA poseen afinidad específica por la fibrina, y por lo tanto se unen de manera selectiva a los coágulos. El ensamblado de un complejo ternario que consiste en fibrina, plasminógeno y tPA estimula la interacción localizada entre el plasminógeno y tPA estimula la interacción localiza entre el plasminógeno y tPA, y acelera en gran medida la activación de plasminógeno y su transformación en plasmina. Además, la degradación parcial de la fibrina por parte de la plasmina deja al descubierto nue- vos sitios de plasminógeno y de unión con tPA en los residuos de lisina de la terminación carboxilo de los fragmentos de fibrina, para intensificar todavía más tales reacciones. De esa manera, el organismo cuenta con un mecanismo extraordina- riamente eficiente para generar en forma local plasmina en el coagulo de fibrina, y de ese modo se transforma en sustrato de plasmina para la digestión, hasta la aparición de productos de degradación de la fibrina.
La plasmina degrada la fibrina en sitios precisos de su molécula, lo que genera los característicos fragmentos de fibrina en el proceso de fribrinólisis. Los sitios de degradación son los mismos que los del fibrinógeno. Sin embargo, cuando la plasmina actúa en la fibrina con uniones covalentes, quedan en libertad los dímeros D; en consecuencia, es posible medir- los en el plasma como un índice de la degradación de fibrinas relativamente específico (en vez de medirlos como fibrinógeno). Las mediciones de dímeros D se pueden utilizar como marcador sensible de la formación de coágulos, y algunos han sido validados para empleo en clínica con el fin de descartar el diagnóstico de trombosis venosa profunda (TVP) y embolia pulmonar en poblaciones escogidas. Además tales mediciones pueden utilizarse para estratificar a los pacientes, en particular a mujeres, para el riesgo de tromboembolia venosa recurrente cuando se mide un mes después de interrumpir los anticoagulantes administrados para el tratamiento del evento idiopáticoinicial. Las concentraciones de dímeros D pueden encontrarse elevadas en ausencia de TVP en personas de edad avanzada.
La regulación fisiológica de la fibrinólisis tiene lugar más
bien en tres niveles: 1. Los inhibidores del activador de plas- minógeno (PAI), particular PAI1 y PAI2, inhiben a los ac- tivadores de plasminógeno fisiológico; 2. El inhibidor fibri- nolíticoactivado por trombina limita la fibrinólisis, y 3. La antiplasmina a2, inhibe a la plasmina. El PAI1 es el inhibidor principal de tPA y uPA en plasma. El TAFI fragmenta los residuos de lisina N-terminales de la fibrina, que ayudan a cir- cunscribir la actividad de la plasmina. La antiplasmina a2, es el principal inhibidor de la plasmina en el plasma de los seres humanos e inactiva cualquier plasmina no vinculada con el coágulo de fibrina (Konkle, 2016).
- Factores dependientes del paciente
Los trastornos de la hemostasia pueden ser hereditarios o adquiridos, es por esto que es necesaria una buena anam- nesis para identificar datos personales o familiares como así también obtener datos de cuadros ocultos o primarios, sitios de hemorragia o tendencia hemorrágica que aumento por otro trastorno médico o por la introducción de fármacos (Konkle, 2016).
- Hemorragia y trombosis
El sistema hemostático del ser humano se encarga del equi- librio natural entre los factores procoagulantes y los anticoa- gulantes. Los primeros incluyen la adhesión y la agregación plaquetaria, y la formación del coagulo de fibrina; los segun- dos comprenden los inhibidores naturales de la coagulación y de la fibrinólisis.
En circunstancias normales la hemostasia es regulada de modo tal que fluya la sangre por los vasos. También está pre- parada para coagular lo más pronto posible la sangre y detener su flujo para evitar la hemorragia. Una vez interrumpida la hemorragia, este sistema remodela el vaso lesionado para que se restaure el flujo normal.
Los componentes principales del sistema hemostático que actúan en forma concertada son:
Plaquetas y otros elementos formes de la sangre como los monocitos y los eritrocitos.
Las proteínas plasmáticas (factores de coagulación) y ele- mentos fibrinolíticos e inhibidores.
c.1 Hemorragias digestivas altas
Según la Guía de Procedimiento para la atención de urgen- cias y emergencias médicas publicada en 2017, es la pérdi- da de sangre del sector del tubo digestivo comprendido entre la orofaringe y el ángulo duodeno yeyunal. Se clasifican en leves, moderadas o graves, según el volumen de la perdida hemática. Sus principales manifestaciones son: hematemesis (vómito de sangre fresca) y o la melena (evacuación de heces alquitranadas). También puede manifestarse por enterorragia, principalmente cuando el tránsito intestinal es acelerado.
- Etiología:
Úlcera péptica gastroduodenal: se da entre el 50 al 75 % de los casos, es por ende el cuadro más frecuente en las úlceras duodenales.
Lesiones agudas de la mucosa y/o gastritis: son superficia- les, solitarias o múltiples.
Hernia hiatal: por esofagitis.
Neoplasias: por erosión tumoral, suelen ser leves o mode- radas.
Desgarro de la mucosa esofágica: por el esfuerzo de vómi- tos, síndrome de Mallory Weiss.
Otras: lesiones vasculares, aneurismas aórticas, discrasias sanguíneas y uremia.
- Cuadro clínico: el 60 % de pacientes sufren hemorragias sin síntomas prodrómicos. Los signos clínicos de exterioriza- ción d la hemorragia son: hematemesis, melena y descompen- sación hemodinámica por hipovelemia aguda.
- Exámen físico:
- Palidez de piel y mucosas.
- Frialdad distal por déficit de perfusión cutánea.
- Sudoración fría.
- Mareos.
- Hipotensión arterial.
- Taquicardia.
- Clasificción de la hemorragia:
Por la magnitud del sangrado se clasifican en:
CLASE I: pérdidas menores del 15 %, exploración normal.
CLASE II: pérdida sanguínea del 20-25 %, pulso mayor a 100 latidos/minuto.
CLASE III: pérdida sanguínea del 30-35 %, pulso mayor a 120 latidos/minuto. Frecuencia respiratoria mayor a 30/minu- to. Presión sistólica disminuida. Oliguria.
CLASE IV: pérdida sanguínea del 40-50 %, pulso mayor a 140 latidos/minuto. Presión sistólica menor a 50 mmHg. Fre- cuencia respiratoria mayor a 35 por minuto. Anuria. Trastorno del sensorio.
- Tratamiento de la hemorragia digestiva alta: el manejo es multidisciplinaria y es fundamental identificar los pacientes de riesgo.
FASE I: reanimación.
Estabilizar hemodinámicamente al paciente y definir los cri- terios pronósticos:
- Medidas específicas de reanimación mediante la coloca- ción de catéteres endovenosos cortos y gruesos que permita la perfusión hidroelectrolítica adecuada.
- Evaluar la necesidad de transfusión. Recordar que el he- matocrito inicial no traduce la magnitud de la hemorragia, de manera que son fundamentales el estado hemodinámico, la intensidad de la hemorragia en el momento del diagnóstico, la edad y las enfermedades concomitantes, para evaluar la necesidad de transfusión. En pacientes de edad avanzadas y/o con antecedentes de cardiopatía, se requiere un HTO mayor a 30 %, mientras que en los jóvenes el HTO deseado será entre 20 y 25 %. En caso de hemorragia variceal, no debe superarse el valor de 25 % debido al riesgo de sangrado, que asciende al aumentar la presión en las várices, favorecidas por el incremento del HTO.
- Mantener una vía aérea permanente protegida de la as- piración.
- Colocación de sonda nasogástrica que permite corroborar y cuantificar el sangrado.
- Colocación de sonda vesical para el control del débito urinario horario.
En forma simultánea se realizara una completa historia clí- nica que nos llevará a las causas del cuadro hemorrágico y la solicitud de los exámenes complementarios.
FASE II. Endoscopia diagnóstica y terapéutica
Tiene una efectividad diagnóstica del 90 %, realizada den- tro de las primeras 12 horas del sangrado.
Las lesiones encontradas según la población examinada son: úlcera péptica (Duodenal-Gástrica). Lesión aguda de mu- cosa gástrica (L.A.M.G.) y várices esofágicas.
Estas patologías representan alrededor del 80 % de las causas de Hemorragia Digestiva Alta. Son causas menos frecuentes: Cáncer gástrico, Síndrome de Mallory Weiss, Esofagitis, etcétera.
Clasificación de forrest (signos endoscópicos de valor pro- nóstico):
FORREST I: presencia de sangrado activo. Ia. Sangrado en chorro.
Ib. Sangrado en napa.
FORREST II: estigmas recientes o sangrado reciente. IIa. Vaso visible no sangrante.
IIb. Signos indirectos: manchas planas, rojas o negruzcas, sobre el fondo ulceroso o coágulo oscuro adherido.
FORREST III: ausencia de signos de hemorragia.
- Terapéutica endoscópica: existen distintas técnicas:
- Térmicas: láser, electrocoagulación (mono, bi o multipo- lar), sonda térmica.
- Inyecciones (esclerosis): adrenalina, etanol, sol. Fisio- lógica, agua, dextrosa al 50 %, agentes esclerosantes (poli- docanol, sulfato de tetradecil sódico). La eficacia de estos compuestos es similar.
Tabla 1
Inhibidores selectivos de la recaptación de serotonina aprobados actualmente en EE.UU.
Nombre genérico
Nombre
de la marca
Indicaciones aprobadas por la FDA
Rango de dosis (mg día-1) Grado de inhibición de la
recaptación de serotonina
| Fluoxetina | Prozac, Sarafem | Trastorno depresivo mayor Trastorno obsesivo compulsivo Bulimia nerviosa Ataque de pánico Trastorno disfórico premenstrual | 10-80 | Alto |
| Fluvoxamina | Luvox | Trastorno obsesivo compulsivo Trastorno depresivo mayor | 50-300 | Intermedio |
| Paroxetina | Paxil | Trastorno depresivo mayor Trastorno obsesivo compulsivo Ataque de pánico Desorden de ansiedad social Trastorno de ansiedas generalizado Trastorno de estrés postraumático | 10-60 | Alto |
| Sertralina | Zoloft | Trastorno depresivo mayor Trastorno obsesivo compulsivo Ataque de pánico Trastorno de estrés postraumático Desorden de ansiedad social Trastorno disfórico premenstrual | 25-200 | Alto |
| Citalopram | Celexa | Trastorno depresivo mayor | 20-40 | Intermedio |
| Escitalopram | Lexapro | Trastorno depresivo mayor Trastorno disfórico premenstrual | 10-20 | Intermedio |
| Adaptado de Adaptado de Turner (2007). |
- Nuevas técnicas: clips metálicos, ligadura con bandas, argón-plasma, dispositivos de sutura.
FASE III. Terapéutica médica
El tratamiento con IBP (inhibidores de la bomba de pro- tones) endovenoso en bolo de 80 mg en la primera y 40 mg cada 12 horas.
En el sangrado variceal la aplicación de Terlipresina 2 mg cada 4 horas en las primeras 24 horas. Se debe efectuar antes de la endoscopía.
Además de todas las medidas terapéuticas explicitadas en la fase de reanimación.
FASE IV. Tratamiento quirúrgico
De excepción en la actualidad, motivado por el fallo del tratamiento médico y endoscópico.
La técnica y la táctica quirúrgica aplicada dependerá de la causa del sangrado.
La tendencia actual es la realización de operaciones menos complejas como la hemostasia directa (SAME, 2017).
2. Hemorragias gastrointestinales secundarios a psicofármacos
- Hemorragias en pacientes recibiendo ATD ISRS
La diátesis hemorrágica que se observa después de la admi-
nistración de ISRS está relacionada con una disminución en la función plaquetaria que ocurre cuando se inhibe la recapta- ción de serotonina en las plaquetas. Las plaquetas contienen aproximadamente el 99 % de la serotonina en sangre total y la liberan en los sitios de lesión vascular, lo que provoca la amplificación de la agregación plaquetaria que es vital para la formación del trombo hemostático (De Clerck, 1990).
Los medicamentos que bloquean la recaptación de sero- tonina, a su vez, disminuyen el contenido de serotonina de las plaquetas lo que ocasiona la reducción de la función pla- quetaria. Según pruebas realizadas con citometros de flujo y técnicas de agregación plaquetaria la serotonina disminuiría en más del 80 % en los pacientes que reciben paroxetina, y la reducción conduciría a una exposición disminuida de las proteínas de activación en la superficie de las plaquetas y al deterioro de la agregación plaquetaria (Serebruany, 2003).
Dos investigadores realizaron una revisión acerca de estudios que informaban sangrados durante una cirugía, obteniendo que los pacientes que tomaban ISRS tenían mayor tasa de hemorragia gastrointestinal que el grupo control. De dicho trabajo surge que los pacientes no medicados con ISRS tienen un riesgo relativo (RR) 1.7 veces menor de experimentar sangrado en comparación a quienes reciben esa medicación (RR1.7; Intervalo de Confianza 95 % (IC del 95 %): 1.4 – 2.0)
(Roose, 2016).
Varios estudios sobre el tratamiento con ISRS muestran una marcada reducción de la concentración de serotonina plaquetaria en comparación con los controles (entre 65 y 90 por ciento menos que los no tratados con ISRS). La consecuencia de dicha reducción es la disminución en la formación de tapones de plaquetas, ejerciendo un efecto antiplaquetario.
Un artículo publicado en 2019 por Yuet y colaboradores menciona que las vías serotoninérgicas inervan áreas cere- brales vagales las cuales liberan serotonina al tracto gastroin- testinal, una vez allí se unirán a receptores serotoninérgicos específicos provocando la modulación de la liberación de áci- do gástrico. La estimulación vagal puede aumentar la tasa de
Tabla 3
Número estimado necesario para dañar (NND) utilizando los odds ratios del metanálisis y en función de diversos factores de riesgo de hemorragia gastrointestinal superior
| Tasa basal de eventos | NND por año con | NND por año | |
| Poblacion de pacientes | gastrointestinales supe- riores por 10000 por año | ISRS (IC del 95%) | con ISRS y AINE |
| Edad no seleccionada> 50 años sin exposición a AINEs | 23 | 318 (152-979) | 82 (41-181) |
| Factor de riesgo de hemorragia digestiva alta | |||
| 18 | 411 (196-1266) | 106 (53-233) | |
| Sin uso previo de medicamentos para úlceras** | |||
| u hospitalización* | |||
| Uso de drogas para úlceras** | 42 | 177 (85-545) | 46 (24-101) |
| Hospitalización* | 62 | 121 (58-370) | 32 (17-69) |
| Uso de drogas ulcerosas** y hospitalización* | 108 | 70 (34-214) | 19 (10-41) |
ISRS, inhibidor selectivo de la recaptación de serotonina: AINE, fármaco antiinflamatorio no esteroideo.
* Historia previa de ingreso por cualquier evento gastrointestinal superior.
** El uso de medicamentos para las úlceras es cualquier tratamiento para las úlceras en el pasado pasado o el presente.
Adaptado de Adaptado de Turner (2007). liberación serotoninérgicas a la luz gástrica y la circulación portal en un 600 % y 265 % respectivamente (Yuet, 2019). Este proceso también puede aumentar el riesgo de sangrado gastrointestinal.
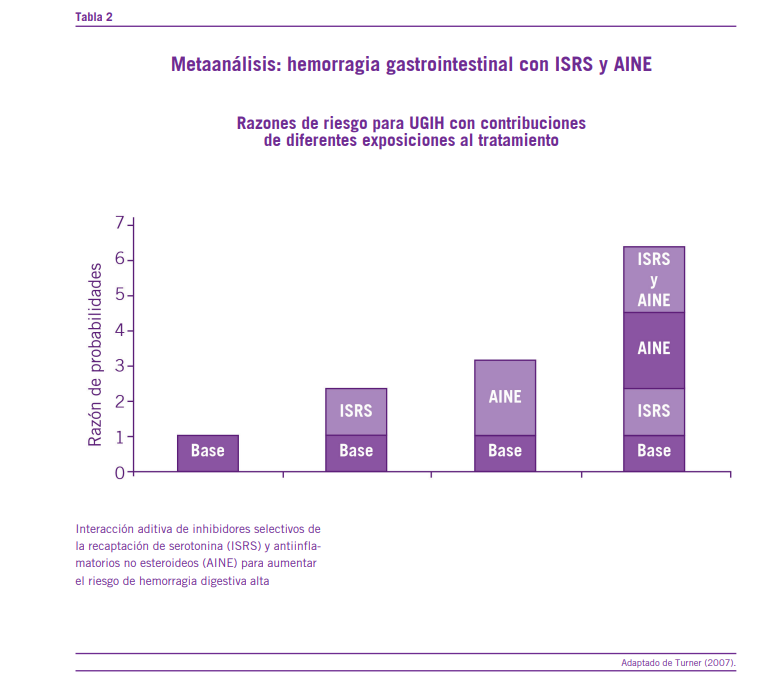
Por su parte Turner y colaboradores, en un estudio de co- horte retrospectivo, identificó usuarios de antidepresivos du- rante un período de cinco años (sobre una base de datos de prescripciones en un pueblo de Dinamarca) en los cuales se determinó la incidencia de hospitalización por hemorragia di- gestiva alta en pacientes tratados con ISRS versus no tratados con ese tipo de psicofármacos. Los resultados alcanzados, en cuanto a la relación de 2.3 (IC 95 % 1.5 – 3.4) para los no usuarios (Turner, 2007).
Durante un estudio realizado por McCloskey y colaboradores en el 2008 donde se comparó el funcionamiento plaquetario (a través de métodos de medición de agregación plaquetaria) en pacientes tratados con ISRS vs pacientes tratados con bu- propión. Dicho estudio arrojó diferencias entre ambos grupos evidenciando una disminución en los niveles de agregación en aquellos pacientes que utilizaron bupropión (McClosley, 2008).
- Hemorragias en pacientes utilizando psicofármacos asocia- dos a otros fármacos
El ácido acetilsalicílico (AAS) y otros antiinflamatorios no esteroideos (AINES), que inhiben la ciclooxigenasa I, antagonizan con los componentes de la hemostasia primaria y pue- den exacerbar la hemorragia de otras causas o incluso desenmascarar una hemorragia leve que había estado oculta, como el caso de vWD. Sin embargo, todos los AINES desencadenan hemorragias del tubo digestivo, que pueden ser más intensas cuando hay problemas hemorrágicos subyacentes. El efecto del AAS en la función plaquetaria, valorado con la agregometría, puede persistir incluso siete días, aunque más a menudo se normaliza a las 72 horas de haber consumido la última dosis. El efecto de otros AINES es más breve, porque se re- vierte el efecto inhibidor una vez que se interrumpe el uso del fármaco. Las tienopiridinas (clopidogrel y prasugrel) inhiben la agregación plaquetaria mediada por ADP y, al igual que los AINES, algunas veces precipitan o exacerban los síntomas hemorrágicos.
Tabla 4
Consideraciones sobre la prescripción de medicamentos y la educación
- Eduque al paciente sobre el aumento del riesgo de hemorragia asociado con los SRI antes de iniciar la terapia.
- Eduque al paciente sobre cómo identificar los signos y síntomas asociados con el sangrado anormal y cuándo buscar tratamiento médico.
- Sopese el riesgo y los beneficios del uso de antidepresivos frente al riesgo de hemorragia abdominal.
- Evite suspender los antidepresivos en pacientes con una indicación activa de uso basada solo en el riesgo de hemorragia.
- Si un paciente desarrolla una HD, se deben sopesar el riesgo y los beneficios antes de suspender la te- rapia antidepresiva, y se puede agregar un agente supresor de ácido para reducir el riesgo de desarrollar hemorragias adicionales.
- Evite el uso innecesario de AINE.
- Cuando los prescriptores deben usar dosis ocultas de AINE con ISRS, deben considerar la terapia de
supresión de ácido para reducir el riesgo de HD.
Adaptado de Bixby, 2018.
Los estudios demuestran que si se combina un ISRS con un AINE, como ibuprofeno, el riesgo de hemorragia gastrointestinal aumenta hasta nueve veces comparado con los controles (Elderon, 2011). Varios trabajos se dedicaron a profundizar sobre los efectos prohemorrágicos de la asociación de ISRS con otros fármacos como el estudio de cohorte poblacional llevado adelante en Dinamarca, en el año 2003, donde comparaban la incidencia de hospitalización por hemorragia digestiva alta en pacientes que habían sido recetados con ISRS, en una base de datos retrospectiva de cinco años, y en pacien- tes que no habían recibido antidepresivos dio como resultados que los usuarios de ISRS presentaban una relación observa- da-esperada de 3.6 (IC 95 %: 2.7 – 4.7) en comparación a la observada en quienes no recibían ISRS, la cual fue de 2.3 (IC 95 %: 1.5 – 3.4). Por otro lado, los que recibían ISRS en combinación con AINES o aspirina presentaban una relación observada-esperada superior ((12.2; IC 95 %: 7.1-19.1) y
(5.2; IC 95 %: 32.-8) respectivamente) (Turner, 2007). Por su parte el metaanálisis realizado por Loke y colaboradores en el año 2008 examinó la asociación entre los ISRS y el riesgo de hemorragia digestiva alta, el efecto sinérgico con los AINEs y el impacto en pacientes. Para tal fin estudiaron cuatro estudios de tipo observacional, de los cuales tres estudios eran de tipo casos y controles (De Abajo et al., 1999; Tata, 2005; Helin-Salmivaara et al., 2007) y uno retrospectivo (Dalton et al., 2003), y ratificaron que existe un riesgo más elevado de
sangrado con el uso de ISRS, ya sea indicados solos o junto con AINEs donde la asociación e implicancia era más signifi- cativa y deletérea por un mecanismo sinérgico.
Por último, si bien los médicos deben ser conscientes del riesgo de hemorragia por el uso concomitante de ISRS y AI- NEs, también los pacientes deben recibir información acerca de este efecto adverso para un uso prudente de estos fárma- cos (Bixby, 2018).
Un estudio de casos y controles llevado a cabo entre la población británica donde se comparó el riesgo de hemorragia gastrointestinal en tratados con AINES, ISRS y la combina- ción de ambos (11261 pacientes que presentaron sangrado gastrointestinal superior (incluidos como casos) versus 53156 controles de la misma edad, sexo y con idéntica práctica médica que no presentaron sangrado), demostró que los prescriptos con ISRS y con AINES presentaron mayor riesgo de hemorragia gastrointestinal ((Odds Ratio (OR) 2.38; IC del 95 %: 2.08 – 2.72) y (OR 2.15; IC del 95 %: 2.02 – 2.28) respectivamente). Finalmente, el uso concomitante de ambos agentes demostró una ligera elevación en el riesgo de sangra- do en comparación al uso de cada agente solo (OR 2.93; IC de 95 %: 2.25 – 3.82).
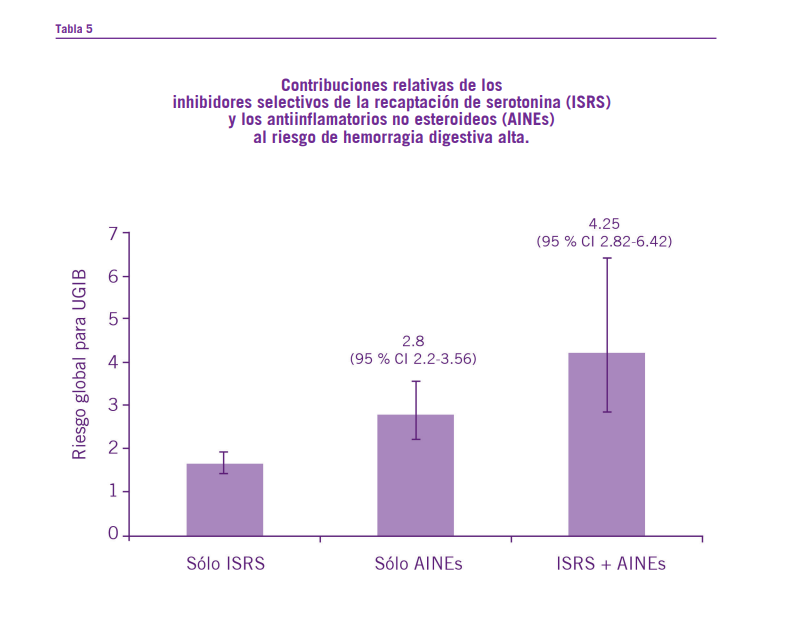
Otro trabajo en el cual se incluyeron 15 estudios de casos y controles (n=393.268) y 4 estudios de cohorte arrojo como resultados que el número necesario para dañar (NNH) por

sangrado gastrointestinal en población de bajo riesgo en tra- tamiento con ISRS es de 3177, mientras que en la población de alto riesgo es de 881. A su vez, el riesgo de hemorragia digestiva alta aumentó más con el uso de ISRS asociados a otros medicamentos prohemorrágicos (AINES) a (OR 4.25; IC de 95 %: 2.82 – 6.42) (Anglin, 2014).
Andrade et al. (2010) publicaron que los antidepresivos ISRS estaban asociados con un riesgo aproximadamente dos veces mayor de generar hemorragias gastrointestinales altas, y determinaron la incidencia en 1/8000 prescripciones de di- chas moléculas. Estos autores identificaron como factores de riesgo el uso concomitante de AINEs o drogas antiagregantes (con ellas aumentaba el riesgo entre 8 y 28 veces) y las altera- ciones hepáticas, especialmente en período de cirrosis.
Es de destacar que si bien la combinación de un ISRS con un AINE aumentó el riesgo de hemorragia digestiva alta por encima de lo observado con un ISRS solo, en un análisis de subgrupos donde se restringió la cohorte a pacientes que no tenían antecedentes de exposición a medicamentos con ma- yor riesgo de hemorragia gastrointestinal (AINES, dosis bajas de aspirinas, antagonistas de la vitamina K o corticoides ora- les), se obtuvo una razón observada-esperada para los consumidores de ISRS de 3.4 (IC del 95 %: 2.1 a 5.2). Este resultado indicó que los ISRS pueden ser un factor de riesgo independiente para el sangrado gastrointestinal.
Por último, un estudio observacional de cohorte llevado a cabo en Gran Bretaña (en una base de datos de prescripciones médicas entre 1986 y 1998) donde se comparó tasas de hemorragias en usuarios de ISRS, usuarios de otro tipo de medicación psiquiátrica y no usuarios de medicación psiquiátri- ca (excluyendo a quienes recibían potenciales confundidores (AINES y aspirinas)), sorprendió arrojando que si bien hubo un leve aumento en la incidencia de hemorragia, el mismo no fue significativo aunque si se evidenció un aumento en la incidencia de casos en el primer mes de tratamiento con ISRS. El riesgo de sangrado asociado con los AINEs se relaciona con la inhibición de la síntesis de prostaglandinas gástricas que son protectoras de la mucosa. Cabe destaca que la mayoría de los AINEs se metabolizan mediante la CYP2C9, sitio metabólico que puede ser inhibido por los antidepresivos ISRS y que genera acumulación del AINEs y riesgo de toxicidad.
1. Hemorragias en pacientes tratados con psicofármacos con co- morbilidades clínicas
En general, los cuadros hemorrágicos adquiridos son con- secuencia o acompañan a alguna enfermedad sistémica. Por tanto, la valoración de una persona con tendencia hemorrágica debe incluir una revisión minuciosa en busca de manifestaciones de enfermedad subyacente u oculta. En las hepatopatías, la disfunción renal grave, el hipotiroidismo, las paraproteinemias o la amiloidosis y en trastornos que originan insuficiencia de medula ósea, surgen con facilidad hematomas o hemorragias de mucosas. El hígado sintetiza todos los factores de coagulación y por ello su insuficiencia causa una combinación de deficiencias en tales elementos; la situación suele complicarse por trombocitopenia debida a esplenomegalia causada por hipertensión portal. Los factores de coagulación II, VII, IX, X y las proteína C, S y Z depende de la vitamina K para su modificación postraduccional. Si bien la vitamina K se necesita para procesos procoagulantes y anticoagulantes, el fenotipo de la deficiencia de vitamina K o el efecto que tiene la warfarina en la coagulación es la hemorragia.
En un estudio prospectivo llevado a cabo en un hospital holandés con el objetivo de investigar en qué medida el poli- morfismo del transportador de serotonina aumenta el tiempo de sangrado en usuarios de paroxetina, concluyó que si bien no avalaba la suposición del polimorfismo hacia incapié en que la edad avanzada, el uso de inhibidores plaquetarios y los antecedentes de hemorragias gastrointestinales siguen sien- do foco para las complicaciones hemorrágicas inducidas por ISRS (Hougardy, 2008).
El número normal de plaquetas en la sangre es de 150.000 a 450.000 células/mm3; cuando hay disminución de éstas, aumenta su destrucción, hay secuestro, o los tres factores, ocurre trombocitopenia aislada si hay <50000 células/ mm3, y por lo regular sólo cuando disminuye a <10.000 a 20.000 células /mm3. Las coagulopatías coexistentes, como las que se observan en la insuficiencia hepática o la coagulación dise- minada, infecciones, el uso de fármacos que inhiben la acción de plaquetas y enfermedades subyacentes, pueden agravar el peligro de hemorragia en el individuo trombocitopénico. Casi todas las intervenciones quirúrgicas se pueden realizar en su- jetos con 50.000 plaquetas/ mm3. El número necesario de ellas para cirugía mayor depende del tipo de operación y del cuadro médico primario aunque quizá sea suficiente un re- cuento aproximado de 80.000 células/mm3 (Konkle, 2016). El dengue es una enfermedad viral transmitida por el mos- quito Aedes aegyptique se ha instalado como una enfermedad endémica en América Latina y tiene alta prevalencia estacio- nal en la República Argentina. A nivel mundial se han regis- trado 390 millones de casos y en 2019 la Organización Pa- namericana de la Salud informó más de 3 millones de casos en Sudamérica, cifra pico a la esperada a nivel interanual. Según estimaciones, por cada persona infectada con síntomas clínicos de dengue se infectan entre 8 y 15 que cumplen con el ciclo del virus. En 2020 se registró un pico de infectados por dengue que se calcula, al día de hoy, asciende a 12 mil casos registrados en el mes de abril y se suman a un total de más de 20 mil casos registrados entre julio de 2019 hasta abril de 2020. En dicho período de 8 meses se registraron 25 fallecimientos relacionados con el dengue y múltiples complicaciones con aumento de la morbilidad (Mazzoglio, 2020). El mecanismo fisiopatológico exacto por el cual se produce el sangrado en pacientes con por dengue no se ha aclarado definitivamente. Se han descrito varias anormalidades hemostáticas en pacientes con dengue como: trombocitopenia severa, tiempo prolongado de protrombina (PT), tiempo prolongado de tromboplastina parcial activada (aPTT), tiempo prolongado de trombina (TT), reducción de ciertos factores de coagulación, aumento del nivel de factor tisular, alteraciones en el sistema fibrinolítico y niveles reducidos de proteína C y proteína S son algunas de las anormalidades reportadas en la literatura. También se reconoce que la mayoría de estas anormalidades hemostáticas se resuelven espontáneamente sin hemorragias clínicamente significativas. Por otro lado, las principales manifestaciones hemorrágicas en el dengue no se correlacionan necesariamente anormalidades en los parámetros bioquímicos de la coagulación. En particular, el grado de trombocitopenia no se relaciona estrechamente con el riesgo y la gravedad del sangrado en el dengue. Es decir que los pa- rámetros de coagulación pueden no ser una guía útil para de- terminar el riesgo de sangrado en el dengue (Diamond, 2015; Putri al. 2018).
Las plaquetas en los pacientes con infección por dengue
han mostrado que expresan a la proteína p selectina sobre su superficie, la cual es una molécula de adhesión que facilita la unión de las plaquetas en los leucocitos. Es conocido que las plaquetas formen agregados con los monocitos, y que esas duplas plaqueta-monocito se correlacionan con la presencia de trombocitopenia y asimismo estos complejos también están asociados al exudado vascular inflamatorio (Srikiatkhachorn, 2009). En los pacientes con infección activa por el virus del dengue y que estén en tratamiento con antidepresivos inhibidores selectivos de la recaptación de serotonina se debe tener precaución debido al riesgo aumentado de sangrado que presentan como reacción adversa, especialmente a nivel gas- trointestinal. El cuadro aumenta el riesgo de sangrado con el uso concomitante de antiinflamatorios no esteroideos indicados en estos pacientes debido al efecto sinérgico de potenciación entre las moléculas.
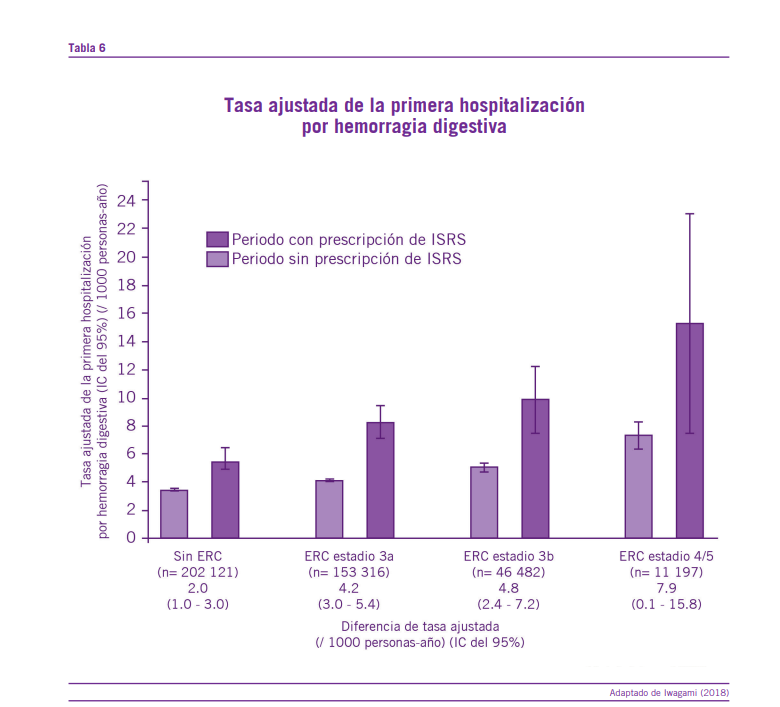
Los pacientes con enfermedad renal crónica (ERC) (filtrado glomerular menor a 60 ml/min por un período igual o mayor a 3 meses) padecen mayor riesgo de sangrado con el uso de ISRS. Un estudio cohorte compararon el riesgo de sangrado por uso de ISRS en pacientes ERC en comparación con aquellos pacientes que no recibieron ISRS.
Los resultados que arrojó el estudio fue que el riesgo de sangrado gastrointestinal es de 4.2/1000 personas/años en pacientes con ERC estadio 3a (4.8/1000 personas/años en estadio 3b y 7.9/1000 personas/años en estadio 4/5) en comparación con pacientes sin ERC quienes tuvieron un registro de 2/1000 personas/años. Esto concluye que es evidenciable el mayor riesgo de sangrado en pacientes con ERC que reciben ISRS (Iwagami, 2018).
El riesgo de sangrado también aumenta en pacientes que están infectados en Helicobacter pylori, la bacteria que pre- senta un riesgo de enfermedad por úlcera péptica.
Otros factores de riesgo descriptos incluyen el antecedente de hemorragias gastrointestinales o úlceras, la tercera edad y comorbilidades en tratamiento crónico o prolongado con cor- ticoides y AINEs.
Discusión
Si bien ha habido varios estudios investigando el sangrado gastrointestinal por ISRS, la gran mayoría son retrospectivos o de cohorte. No son ensayos controlados y aleatorizados.
Muchos de los eventos hemorrágicos se presumieron haber sido ocasionados por acumulación (IRSR solos o combinados con otro/s fármaco/s), o por altas dosis de medicación sin ha- ber constatado las concentraciones de fármacos en la sangre de los pacientes.
En un estudio se mencionó el aumento de eventos en el primer mes del tratamiento con ISRS, en base a eso falta profundizar el factor temporalidad en la terapia con este tipo de psicofármacos.
Conclusión
Si bien los datos varían según los estudios analizados, parece haber un aumento de 1.5 a 2 veces el riesgo relativo de realizar un sangrado gastrointestinal en pacientes medicados con ISRS. No obstante el riesgo absoluto sigue siendo pequeño. Afortunadamente, ninguno de los estudios ha demostrado una mayor mortalidad por sangrado GI asociado a ISRS, lo cual es tranquilizador. Si aumenta el riesgo con cierta medicación concomitante (por ejemplo, en combinación con AI- NES asciende a nueve veces comparado con controles), es por eso que se debe tener precaución máxima en pacientes con comorbilidades y que se encuentra polimedicados. Algo que ayuda es agregar un inhibidor de la bomba de protones, como omeprazol, esto disminuye el riesgo de hemorragia gastrointestinal a ligeramente un poco más que los controles que no tomaban ISRS. Lo que más debe preocupar al indicar un ISRS u otros antidepresivos es si el paciente ya toma un AINE, y no tiene un inhibidor de la bomba de protones.
Quienes presentan alto riesgo son aquellos que padecen trombocitopenia marcada, por ejemplo, con un recuento plaquetario menor a 25000 los cuales a su vez padecen hemorragias espontáneas. Por otro lado, también se debe ser cauteloso al momento de medicar con ISRS a aquellos pacientes que si bien tienen un recuento normal plaquetario pero que tienen plaquetas disfuncionales como en el trastorno de von Willebrand.
Ante sospecha de sangrado que pueda estar asociado con estos fármacos se recomienda interrupción de la administra- ción y evaluación hematológica. En caso de intervención qui- rúrgica, si bien no hay consenso, se aconseja interrumpir el ISRS antes de la misma la mayor cantidad de días posible (lo mejor es 15 días) siempre que la clínica del paciente lo permita.
No existe una contraindicación absoluta para el uso de ISRS en pacientes con antecedentes de trastornos de la coagula- ción como trombocitopenia o alteración de la funcionalidad plaquetaria, aunque deben ser controlados periódicamente.
Por último, si bien son muy raros, existen casos de trombocitopenia inducidos por ISRS.
Bibliografía
- Andrade C, Sandarsh S, Chethan KB, et al. Se- rotonin reuptake inhibitor antidepressants and abnormal bleeding: a review for clinicians and a reconsideration of mechanisms. J Clin Psychia- try 2010;71:1565-75.
- Andrade CH, Sharma E. Serotonin Reuptake Inhibitors and Risk of Abnormal Bleeding. Psy- chiatr Clin N Am 2016; 1-14.
- Anglin R, Armstrong D, Leontiadis G, Moyyedi P, Tse F, Yuan Y. Risk of Upper Gastrointestinal Bleeding With Selective Serotonin Reuptake In- hibitors With or Without Concurrent Non Steroi- dal Anti-Inflammatory Use: A Systematic Review and Meta-Analysis. The American Journal of gas- troenterology. 2014; 109: 811-819.
- Bixby A, Vander Berg A. Clinical Management of Bleeding Risk With Antidepressants. Annals of Pharmacotherapy 2018; 1-9.
- Dalton S, Sorensen H, Johansen C. SSRIs and upper gastrointestinal bleeding: what is known and how should it influence prescribing? CNS Drug 2006;20(2):143-51.
- De Abajo FJ, Garcia Rodríguez LA, Montero D. Association between selective serotonin reup- take inhibitors and upper gastrointestinal blee- ding: population based case-control study. BMJ 1999;23:319.
- De Clerck F. El papel de la serotonina en la trombogénesis. Fisiología Clínica y Bioquímica. 1990; 8 supl. 3: 40–49.
- Diamond MS, Pierson TC. Molecular insight into dengue virus pathogenesisand its implica- tions for disease control. Cell 2015;162.
- Elderon L, Smolderen KG, Whooley MA. Accu- racy and prognostic value of American Heart As- sociation: recommended depression screening in patients with coronary heart disease: data from the Heart and Soul Study. Circ Cardiovas- cular Quality and Outcomes 2011;4:533-40.
- Evans TG, Buys SS, Rodgers GM, Acquired ab- normalities of platelet function [letter]. N Engl J Med. 1991;324:1671.
- Geiser F, Meier CH, Oldenburg J. Coagulation activation and fibrinolysis impairment are re- duced in patients with anxiety and depression when medicated with serotoninergic antidepres- sants. Psychiatry and Clinical Neurosciences 2011; 65: 518-525.
- Halperin D, Reber G. Influence of antidepres-
sants on hemostasis. Dialogues in Clinical Neu- roscience 2007; 9(1): 47-59.
- Helin-Salmivaara A, Huttunen T, Gronroos JM, KlaukkaT, Huuponen R. Risk of serious upper gastrointestinal events with concurrent use of NSAIDs and SSRIs: a case-control study in the general population, Eur J Clin Pharmacol 2007;63:403-8.
- Hergovich N, Jilma B. Paroxetine decreases platelet serotonin storage and platelet function in human beings. Clinical Pharmacology Therapy 2000; 68: 435-442.
- Hougardy D, Van der Graaf F. Serotonin trans- porter polymorphism and bleeding time during SSRI therapy. British Journal of Clinical Phar- macology 2008; 65(5): 761-766.
- IMS Health. National Disease and Therapeutic Index, 2006. http://www.imshealth.com
- Iwagami M, Mansfield KE, Smeeth L, Tomlin- son LA. Gastrointestinal bleeding risk of selecti- ve serotonin reuptake inhibitors by level of kid- ney function: A population-based cohort study. Br J Clin Pharmacol. 2018 (84):2142-2151.
- Konkle BA. Hemorragia y trombosis. En: Fau- ci AS, Hauser SL, Kasper DL, Larry J, Longo DL, Loscalzo J. Harrison Principios de Medi- cina Interna. 19ª Edición, 2016. Vol 1. Pags. 402–406.
- Laporte S, Bellet F, Caillet P, Chapelle C. Ble- eding risk under selective serotonin reuptake inhibitor (SSRI) antidepressant: A meta-analy- sis of observational studies. Elsevier. 2016; 118:19-32.
- Li N, Wallen NH, Ladjevardi M, Hjemdahl P. Effects of serotonin on platelet activation in whole blood. Blood Coagul Fibrinolysis. 1997; 8:517-23.
- Loke YK, Trivedi AN, Singh S. Meta-analysis: gastrointestinal bleeding due to interaction be- tween selective serotonin uptake inhibitors and non-steroidal anti-inflammatory drugs. Aliment Pharmacol Ther 2008;27(1):31-40.
- McCloskey DJ, Postolache TT. Selective Sero- tonin Reuptake Inhibitors (SSRIs): Measurement of Effect on Platelet Function. Transl Research 2008; 151(3): 168-172.
- Montero D, Coulson R, De Abajo FJ, Martín Serrano G, Prieto M, Moore N. Cuarta reunión anual de la Sociedad Europea de Farmacovigi- lancia. Lisboa: ESOP; 1996. Inhibidores selecti- vos de la recaptación de serotonina y trastornos
hemorrágicos.
- Putri IH, Tunjungputri RN, De Groot PG. Thrombocytopenia and platelet dysfunction in acute tropical infectious diseases. Semin Thromb Hemost 2018 Oct;44 (7):683-690.
- Roose SP, Rutherford BR. Selective seroto- nin Reuptake Inhibitors and Operative Bleeding Risk: A Review of the Literature. J Clin Psy- chopharmacol. 2016; 36 (6): 704 – 709.
- SAME, Guía de Procedimiento para la Atencón de Urgencias y Emergencias Médica, 2017. Vol
1. Pags 96 – 99.
- Sanders-Bush E, Mayer SE. Agonistas y anta- gonistas de los receptores de 5-hidroxitriptami- na (serotonina). En: Hardman JG, Limbird LE, Milinoff PB, Ruddon RW, Goodman LS, Gilman AG, editores. Goodman y Gilman son las bases farmacológicas de la terapéutica. Novena ed. Nueva York: McGraw-Hill; 1996. pp. 249–263.
- Serebruany VL, Glassman AH et al. Selective serotonin reuptake inhibitors yield additional an- tiplatelet protection in patients with congestive heartfailure treated with antecedent aspirin. Eur J Heart Fail. 2003;5:517-21
- Turner MS, Xiong GL. Review: Clinical impact of selective serotonin reuptake inhibitors therapy with bleeding risks. Journal of Internal Medicine 2007; 261: 205-213.
- Yuet CH, Derasari D. Review: Selective Seroto- nin Reuptake Inhibitor Use and Risk of Gastroin- testinal and Intracranial Bleeding. The Journal of the American Osteopathic Association. 2019; 119(2): 102-111.







No comments! Be the first commenter?