Nuevos antidepresivos no monoaminérgicos en depresiones severas con riesgo de vida
Resumen
La revisión de la efectividad antidepresiva en fármacos utilizados antes del período de los antidepresivos monoaminérgicos, es una consecuencia de la ausencia de respuesta en un tercio de la población y de la discapacidad en la edad productiva de la vida. Se suma la depresión severa con riesgo de vida, en la que otros antidepresivos con diferentes mecanismos no monoaminérgi-
cos de acción, parecen ser más efectivos que estos fármacos indicados en los últimos 40 años.
De este modo se abren nuevas líneas de investigación para el desarrollo de nuevos targets farmacológicos, para coadyuvar, optimizar o reemplazar a los antidepresivos ya existentes.
Palabras clave
Astroglia – Ketamina – Canales de K+: Kir.41 – Buffer de K+ – Mecanismos de acción no monoaminérgicos – Nuevos anti- depresivos.
Pérez Vargas María Sol. “Nuevos antidepresivos no monoaminérgicos en depresiones severas con riesgo de vida”. Psicofarmacología 2022;128:18-30. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Al Doctor Zieher por sus aportes continuos a las neurocien- cias y ser un importante incentivo para sus alumnos.
La depresión es una trastorno multifactorial y poligénico, caracterizada por alteraciones en los neurotransmisores, vías de señalización, y receptores entre otros, en los que interviene la genética y la epigenética (1).
Se deben tener en cuenta también los antecedentes fami- liares, la cronobiología, los procesos inflamatorios y el estrés.
Afecta a más de 300 millones de personas en el mundo e impone una pesada carga económica a la sociedad y a las familias.
La carga total de las enfermedades relacionadas con la sa- lud mental se ha incrementado en casi un 40 % en los últimos 20 años.
La depresión se ubica entre las enfermedades más comunes y costosas de todos los desórdenes psiquiátricos.
Aproximadamente una de cada cuatro mujeres y uno de cada seis hombres pueden experimentar depresión durante su vida y hasta el 65 % de los individuos tienen episodios recurrentes de esta enfermedad.
La prevalencia es mayor en adolescentes y jóvenes.
Se suma a que aproximadamente el 50 % no realizan tra- tamiento (2).
Estudios epidemiológicos han estimado que las tasas de re- caídas y recurrencias durante un tratamiento continuado con antidepresivos constituyen entre el 10 % y 30 % aproxima- damente (1).
El importante impacto negativo que puede tener la depre- sión en el funcionamiento emocional, social y ocupacional de una persona requiere que se prioricen medidas efectivas de prevención y tratamiento.
Se deben considerar a los pacientes que presentan criterios para depresión resistente.
El uso de antidepresivos ISRS y SNRI son los más común- mente usados en depresión.
Casi a dos tercios de los pacientes que no logran la remi- sión, se los considera “resistentes al tratamiento”: habiéndo- se utilizado 2 antidepresivos previos en tiempo y forma, con leves o sin resultados con dosis máximas.
Las guías para los primeros tratamientos parecen ser se- guidas por la mayoría de los médicos, mientras que en el tra- tamiento de los pacientes que reúnen criterios de Depresión Resistente, el tratamiento es arbitrario posiblemente debido a la falta de especificidad en estas guías (4).
El estrecho foco de las terapias farmacológicas antidepre- sivas que se centran en la modulación de la transmisión de monoaminas constituye una limitación, que puede contribuir a las altas tasas de pacientes refractarios al tratamiento. En este sentido, los pacientes que no responden a dichos trata- mientos que se centran en los mecanismos monoaminérgicos tienen pocas opciones terapéuticas alternativas (1).
Además, si bien el agregado de agentes antipsicóticos atí- picos como la cariprasina, la olanzapina, el brexiprazol, ari- piprazol a los antidepresivos tradicionales, optimizan la tera- péutica de la depresión, un importante número de pacientes continúa sufriendo esta debilitante enfermedad (2).
Nuevas hipótesis se han desarrollado y se han retomado otras, como consecuencia de estas cifras, así como antiguos fármacos empezaron a ser más profundamente estudiados y sus derivados como nuevos targets.
En la depresión hay elevada respuesta a la información ne- gativa y apagada a la información positiva, lo cual se relaciona con alta respuesta de la Amígdala y baja respuesta en el nú- cleo accumbens respectivamente.
Estas estructuras están reguladas por la Habénula una de cuyas áreas la HbL (habénula lateral) es la estructura central que media la respuesta para los estados emocionales nega- tivos y el balance entre la amígdala y el núcleo accumbens.
En el estrés crónico por derrota social hay disminución de la sustancia gris y de la glía en la corteza prefrontal, área de la cognición y en la ACC (corteza cingulada anterior) (2).
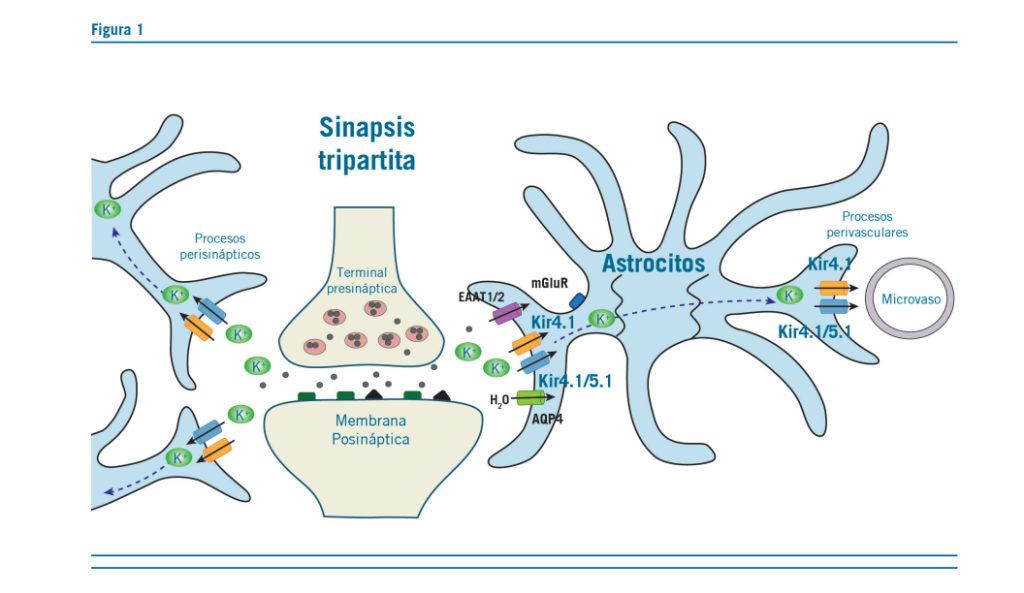
Uno de los más importantes descubrimientos en Neurocien- cias fue demostrar que los astrocitos tienen estrecha relación con las neuronas y, por lo tanto, intervienen en el procesa- miento de la información en el cerebro (3).
Las investigaciones se han centrado en las interacciones astroglía-neuronas en las sinapsis tripartitas, donde los as- trocitos se envuelven estrechamente alrededor de los sitios
presinápticos y postsinápticos (3).
El estrés leve crónico inducido por corticoides produce un comportamiento anhedónico y conduce a la depresión afec- tando (6):
- la liberación del glutamato y GABA (ácido gama amino- butírico),
- el tráfico del BDNF (factor neurotrófico derivado del ce- rebro),
- la morfología de las dendritas en roedores vulnerables al estrés (6).
Respuesta de la Habénula lateral al estrés
La actividad neuronal de la habénula lateral se vio aumen- tada en animales estresados en comparación con animales control en diferentes paradigmas de stress animal.
La disfunción de la HbL (habénula lateral) durante el estrés y la aparición consecuente de síntomas depresivos constituyen un blanco prometedor para nuevas terapéuticas farmacológicas.
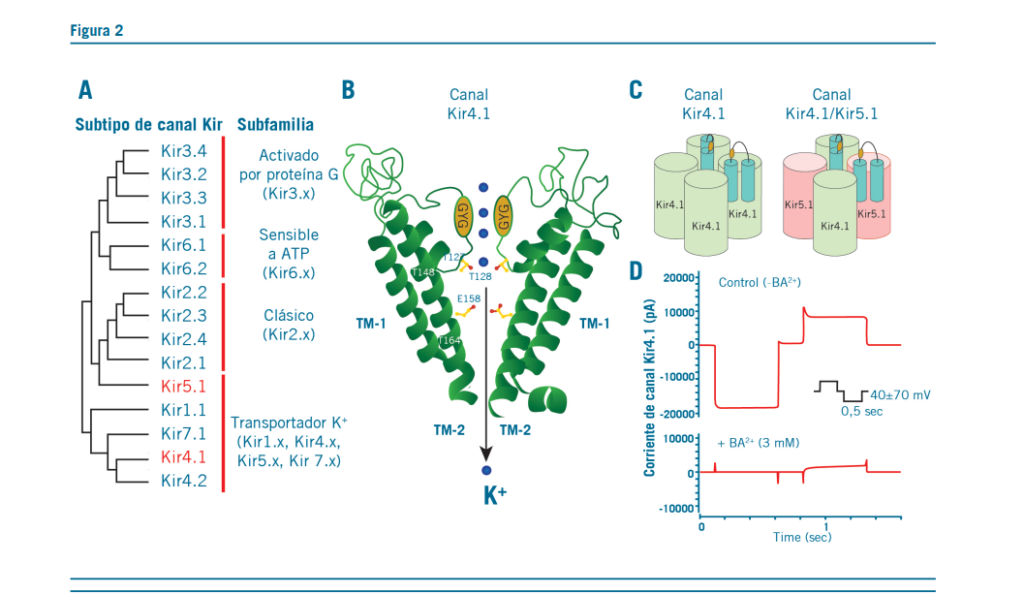
Los canales de K+ (Kir4.1) presentan un patrón distinto de expresión en los astrocitos.
La astroglía con los canales Kir4.1 de K+ en la HbL condu- cen las descargas neuronales en la depresión.
En la depresión, la up regulation de los canales Kir4.1 pue- de causar un mayor clearence de potasio extracelular, lo que lleva a una hiperpolarización neuronal.
El canal Kir4.1 en la HbL podría ser un blanco para el tra- tamiento de la depresión clínica.
La clave más importante de la función de los astrocitos es en el mecanismo de mantenimiento del buffer de K+. Este control del buffer de K+ impide que salga al LEC (líquido extracelular).
Hay una estrecha relación entre el buffer espacial de pota- sio y el glutamato (3).
Los efectos de la ketamina en el funcionamiento de las neuro- nas de la habénula lateral (HbL)
Yang et al. (2018) reportaron que la ketamina ejerce efec- tos similares a los antidepresivos mediante la inhibición de las descargas aumentadas de los potenciales de acción de- pendientes del receptor NMDA en la HbL. También se observó la participación de canales de calcio tipo T sensibles a bajos voltajes en la generación de descargas aumentadas en la ac- tividad de la HbL.
El aumento en la actividad de la descarga neuronal en la habénula lateral (HbL) es esencial para que se desencadene una depresión (5).
La up regulation de Kir4.1, como el canal de potasio rectifi- cador hacia el interior celular, está fuertemente implicada en el proceso de buffering del exceso de K+ extracelular en las sinapsis tripartitas.
Por lo tanto, los astrocitos regulan la excitabilidad de las neu- ronas a través de la regulación de iones y agua, manteniendo la homeostasis en las sinapsis. Los astrocitos, metabolizan neu- rotransmisores como GLU y GABA y secretan varias sustancias
neuroactivas (gliotransmisores, neurotrofinas y citoquinas). Los canales Kir4.1 y Kir4.1 / 5.1 permiten que grandes co-
rrientes de K + sean conducidas hacia el interior de la célula, sosteniendo el equilibrio de K + y corrientes moderadas de K
+ hacia el exterior.
Estos canales, están acoplados a la captación de glutamato por aminoácidos excitatorios (EAAT1) y (EAAT 2) y agua a través de aquaporin-4 (AQP4) los cuales son incorporados a los astrocitos.
También se sabe que las poliaminas que existen en las cé- lulas en concentraciones relativamente altas, así como el Mg2
+, están involucradas en las propiedades rectificadoras de los canales Kir4.1 y Kir4.1 / Kir5.1 al inactivar la compuerta del canal en potenciales de membrana despolarizados.
El BDNF es la molécula esencial para el desarrollo de la fi- siopatología de la depresión en el cerebro ya que se encuentra involucrado en la modulación del LTP, inductor de la plasti- cidad neuronal.
El BDNF mediando mecanismos moleculares subyacentes favorece la plasticidad sináptica (crecimiento neuronal y si- naptogénesis, desarrollo neuronal, sobrevida neuronal y man- tiene una gliosis activa).
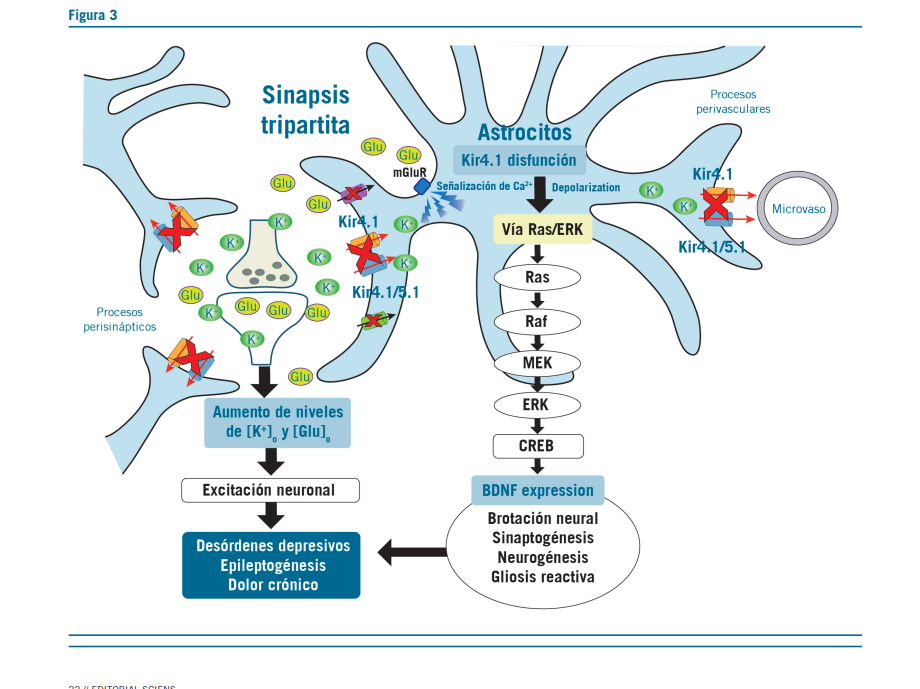
La liberación considerable de cifras elevadas de K+ durante la fase de repolarización neuronal, consiste en que si esta fase es incorrecta o eleva el K+ a 10 mM o más en el LEC (líqui- do extracelular) se producen descargas neuronales atípicas, como ocurre en la depresión.
Los astrocitos, lo transportan a regiones de menor (K+) can- tidad como los microvasos.
Los canales Kir4.1 conducen grandes corrientes de K + hacia el interior de las células y más pequeñas (sensibles a Ba2 +), hacia el exterior, que ilustran las características de la rectificación en el interior (9).
El estrés crónico induce anhedonia y cambios en la libera- ción de glutamato, alteraciones en la morfología de las dendri- tas por la falta de BDNF en los estados depresivos. Esta neu- roarquitectura es restaurada por la acción de la ketamina (5). Las neuronas de la habénula lateral se proyectan a áreas del mesencéfalo (la sustancia negra compacta, el área tegmental ventral y el núcleo dorsal del rafe) y controlan las actividades que están involucradas en la liberación de dopamina y neuro-
transmisores como 5- HT.
En un reciente estudio que aplicó un modelo animal de de- presión inducida por estrés, se demostró que la HbL tiene una elevada activación del factor de transcripción CREB (proteína de unión al elemento de respuesta al AMP cíclico) tal como reflejan los niveles de fosforilación de CREB, y la facilitación de la potenciación sináptica a largo plazo (LTP).
Se demostró que la unión de CREB al promotor del BDNF y el consecuente up regulation de la expresión del BDNF es iniciada por la entrada de calcio en la célula (9).
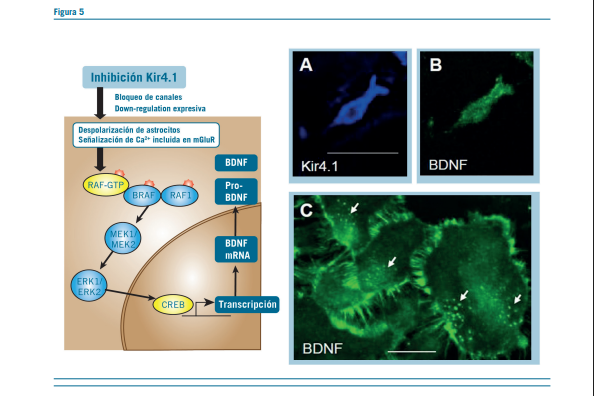
El potencial mecanismo de los canales Kir4.1 puede ser expli- cado por 2 puntos de vista:
- Regulación de la excitabilidad neuronal por el buffer es- pacial de K+
Regulación de la expresión del BDNF en los astrocitos
La actividad de las neuronas glutamatérgicas de la HbL blo- quea la acción de las neuronas dopaminérgicas del mesencé- falo que son responsables del procesamiento de la informa- ción y del circuito de la recompensa (9).
El BDNF disminuido está implicado en el desarrollo de trastornos depresivos y se sabe que éstos están asociados con la degradación morfológica de las estructuras límbicas, por ejemplo, la retracción dendrítica, la disminución de la neurogénesis, y la supervivencia neuronal. Se cree que estos eventos son causados por alteraciones metabólicas o por una menor expresión del BDNF, especialmente ante la exposición al estrés crónico.
También se ha reportado que múltiples polimorfismos en el gen del BDNF están asociados con los trastornos depresivos. Asimismo, las drogas antidepresivas incrementan tanto la ex- presión neuronal como astrocítica del BDNF en el hipocampo, en la corteza prefrontal y restauran la neurogénesis afectada en el hipocampo (7).
Función del kir4.1 -BDNF- astroglía
Todos estos hallazgos revelan que el BDNF es una molécula clave en la modulación de la patogénesis y tratamiento de los trastornos depresivos.
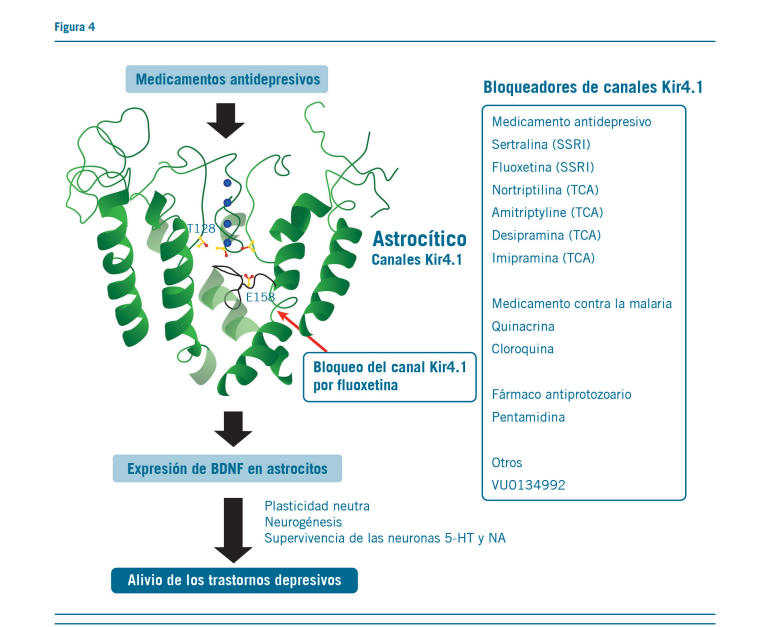
Los efectos monoaminérgicos que subyacen a la acción an- tidepresiva de la fluoxetina vía astrocitos-BDNF reportan el bloqueo de los canales Kir4.1 con drogas antidepresivas.
Este bloqueo por fluoxetina facilita el aumento del BDNF mRNA y la expresión de proteínas en los astrocitos, los que po-
tencialmente alivian los síntomas depresivos, mejorando la plas- ticidad neuronal, la neurogénesis y supervivencia de las neuro- nas 5HT y NA. Estos efectos son logrados por los ISRS y los ATC. Estas acciones no fueron mediadas por la inhibición de la recaptación de 5HT, sino es en forma directa y específica por
la unión a la región del poro en los canales Kir4.1.
Además, muchas drogas antidepresivas facilitan la expre- sión del BDNF en los astrocitos mediante la inhibición de los canales Kir4.1 (9).
Se explica de esta manera como la disfunción astrogial, dis- funciona consecuentemente la disfunción monoaminérgica (1). La expresión del BDNF en los astrocitos está recibiendo gran atención en la actualidad como modulador de enferme-
dades del sistema nervioso central.
Hay una mayor evidencia de que la inhibición de estos canales Kir4.1, atenúan la amortiguación de K+ y la expresión del BDNF. Estos eventos parecen facilitar la plasticidad neuronal y causar sensibilización. En contraste, la activación de los canales Kir4.1 reducen la excitabilidad neuronal al disminuir los niveles de [K+]0 y [Glu]0 y atenúan la expresión del BDNF. Estos estudios indicarían que están involucrados en la atrofia de las estructuras límbicas inducida por estrés y en el desarrollo de trastornos depresivos.
Una nueva posibilidad es que el sistema Kir4.1-BDNF as- trocítico sirva como nuevo blanco para el tratamiento de en- fermedades del sistema nervioso central (8).
Hay una mejoría de la expresión de BDNF por el bloqueo de los canales Kir4.1.
La inhibición de estos canales causa una inhibición de los astrocitos, con down regulation de los canales Kir4.1 que activa el receptor mGluR, induciendo la señalización de Ca+, a través de la elevación de los niveles de K+ y Glu en las sinapsis. Estos eventos subsecuentemente activan la cascada de señalización y mejoran la expresión del BDNF en los astrocitos.
Estos resultados sugieren fuertemente que la inhibición de los canales Kir4.1 facilitan la expresión del BDNF en los as- trocitos por la activación de las vías de señalización de Ras / ERK regulando la transcripción de BDNF y la plasticidad neu- ronal a través de la interacción con AMP cíclico.
Los canales Kir4.1 juegan un importante rol en la modulación de la expresión de BDNF en los astrocitos. El BDNF reduce la expresión de los canales Kir4.1 asociados con enfermedades del SNC (9).
El papel clave de la transmisión glutamatérgica en el trastorno depresivo mayor (TDM)
Los receptores NMDA son grandes complejos de proteínas de membrana heterotetraméricas, la mayoría de los cuales se componen de dos subunidades GluN1 y dos subunidades GluN2 obligatorias. Estas últimas poseen cuatro subtipos:
GluN2 A, B, C y D.
Tanto los estudios genéticos como los farmacológicos han sugerido que los receptores NMDA que contienen GluN2B juegan un papel importante en los trastornos del estado de ánimo. Los bloqueadores selectivos de la subunidad GluN2B producen un rápido efecto antidepresivo tanto en roedores como en humanos, con baja neurotoxicidad y efectos psicogé- nicos leves o insignificantes.
Adicionalmente en estudios preclínicos, la descarga de la vía glutamatérgica modula aguas abajo, la síntesis y liberación de BDNF.
El sistema glutamatérgico podría en realidad conducir al mantenimiento de la respuesta antidepresiva, en vez de pro- ducir el efecto antidepresivo real agudo a través de la modu- lación de la plasticidad neuronal (11).
Por ejemplo, los antagonistas de los canales NMDA como lanicemine (AZD 6765), memantine, ketamine (R, S-ketami- ne) o iones de magnesio han mostrado efectos antidepresivos en roedores sin tratamiento previo (9).
La ketamina (KET), un antagonista del receptor N-me- til-D-aspartato (NMDA) no competitivo, administrada en dosis
bajas sub-anestésicas, induce una respuesta antidepresiva rá- pida (a las pocas horas) y sostenida (hasta varios días) tanto en estudios clínicos como preclínicos.
Mecanismo de acción de la ketamina
Un estudio preclínico ha demostrado que los efectos an- tidepresivos de otros antagonistas NMDA y aún la ketamina son independientes del antagonismo de los receptores NMDA y se deberían a la modulación de otros receptores como los AMPA R.
La ketamina además modula un aumento en las cascadas de señalización del adenosín monofosfato cíclico (AMPc) en las células gliales C6 en ausencia del receptor N-metil-D- aspartato (NMDAR). Se ha indicado una disminución en la señalización por AMPc en pacientes con depresión y se registraron mayores niveles de AMPc luego del tratamiento con inhibidores selectivos de la recaptación de serotonina (ISRS). La ketamina puede actuar de un modo similar a los ISRS dado que se ha reportado que ésta aumenta el factor neurotrófico derivado del cerebro y los niveles de AMPc.
Sumado al antagonismo NMDAR, la ketamina también tiene como blanco a los canales regulados por nucleótidos cíclicos activados por hiperpolarización (HCN1) implicados en sus acciones hipnóticas; el canal representa otro blanco terapéutico posible en la enfermedad depresiva.
Los astrocitos expresan canales HCN1 (12).
La mayoría de los estudios se focalizan en que el mecanismo de acción de la ketamina es actuar como un antagonista no competitivo del NMDA R y la subsecuente activación de AMPA R.
La Ketamina no explica por si sola el efecto antidepresivo, sino que además produce mayor circulación de glutamato.
Esta mayor disponibilidad de Glu sobre los receptores AMPA, genera mayor efecto antidepresivo y acciones neuro- plásticas ya que inducen el ingreso de Ca++ a la célula y el incremento del BDNF (7).
Además, los AMPA activan al mTOR, que a su vez aumenta BDNF-TRK-B y juntos a la proteína antiapoptótica BCL2.
Aumenta la sinaptogénesis en el Hipocampo como en la CPF (corteza prefrontal) (2).
La ketamina aplicada a través de la vía intraperitoneal en dosis de 50 mg/kg inhibe el aumento del comportamiento de- presivo inducida por una baja dosis (7).
BDNF-GABA
El BDNF desempeña un papel fundamental en la regulación de la morfología dendrítica local (Aid et al., 2007; Baj et al., 2011; Chiaruttini et al., 2008; Kellner et al., 2014). Se ha demostrado que tanto el tratamiento crónico con antidepresi- vos como el ejercicio físico aumentan el tráfico de BDNF en las dendritas distales (Baj et al., 2012).
La liberación de GABA producida por la despolarización neuronal, se vio deteriorada en roedores vulnerables al estrés leve crónico y ésta fue completamente restaurada por el trata- miento con ketamina.
Previamente se había demostrado que el estrés leve crónico reduce el número de interneuronas GABAérgicas en el hipo- campo, a la vez que impide la síntesis, captación y transmi- sión sináptica inhibitoria de GABA en la corteza prefrontal. La ketamina restaura completamente la liberación de GABA en el
hipocampo de roedores vulnerables al estrés leve crónico (17).
GABA es el principal neurotransmisor inhibitorio del cerebro y produce una rápida neurotransmisión inhibitoria a través de los receptores ionotrópicos GABAA y respuestas inhibitorias más lentas a través de los receptores metabotrópicos GABAB (16).
Se encuentran ampliamente distribuidos en todo el cerebro; se expresan como heterorreceptores presinápticos, postsináp- ticos, extrasinápticos, y como autorreceptores interneurona- les; y se ha demostrado que tienen una amplia gama de fun- ciones neurofisiológicas. Es así como dentro de esta gama de funciones tenemos a la anhedonia, síntoma de la depresión.
Se suma a la acción de la ketamina, la liberación de glutamato y sugiere una acción más compleja de la ketamina en la disfunción sináptica y en el balance excitación-inhibición (17). La actividad de tipo antidepresiva de ambos enantiómeros de la ketamina: S-ketamina y R-ketamina, dependió de los receptores AMPA y de la vía de señalización Trk/BDNF ya que la administración de inhibidores respectivos de estos receptores/vías eliminó por completo la actividad antidepresiva.
A diferencia de la R-ketamina, la S-ketamina produjo efectos secundarios, como por ejemplo la hiperlocomoción, déficits en la inhibición prepulso y efectos de recompensa en roedores. Ambos compuestos revirtieron los cambios en la densidad de las espinas dendríticas en la corteza pre-límbica
y el hipocampo (región CA3 y giro dentado) de roedores suje- tos a estrés por DS (derrota social).
Estos resultados son especialmente interesantes si se tiene en cuenta que el receptor TrkB se encuentra ubicado corriente arriba (upstream) de las vías de señalización intracelulares mTOR y ERK, las cuales se encuentran involucradas en el mecanismo de acción de la ketamina (12).
BDNF y TrkB
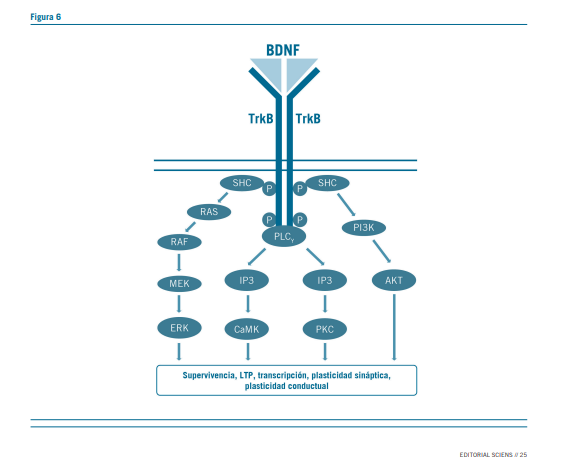
El BDNF se une al TrkB extracelular formando homodíme- ros y activando la cascada de señalización intracelular aguas abajo que regula la plasticidad sináptica, el LTP y la supervi- vencia neuronal, incluyendo a Ras/MAPK, fosfolipasa C(PLC), además de la vía de señalización de PI3K/ AKT.
BDNF-TRK-B fosforilados activan la cascada de señalización del AMPc, aumentando la BCL2 (proteína antiapoptótica) y lo- grando su expresión en el interior de las células en el GD (giro dentado) del hipocampo aumentando la neurogénesis (7).
La R-ketamina produjo efectos diferentes a los de la S- ke- tamina en las vías mTOR y ERK en ratones expuestos a DS (derrota social).
El pretratamiento con rapamicina o AZD8055 (dos potentes inhibidores de mTOR) bloqueó la eficacia antidepresiva de corta y larga duración de la S-ketamina, pero no de la R- ketamina. Asimismo, sólo la (S)-ketamina restauró las anormalidades de la vía de señalización mTOR en la corteza prefrontal y en el hipocampo inducidas por el estrés por (DS) en roedores. Completamente diferentes son los efectos que se han reportado sobre la activación de la vía ERK. Un pretratamiento con un inhibidor del ERK, inhibió los efectos antidepresivos de la (R)-ketamina, sin afectar la eficacia de la (S)- ketamina. Sólo la (R)- ketamina atenuó los efectos del estrés por DS en la activación de la vía ERK en la corteza prefrontal y en el hipocampo en roedores. Al parecer, los efectos antidepresivos del enantiómero más potente podrían ser independientes de la activación de la vía de señalización mTOR.
La activación de las vías ERK y mTOR puede resultar del interjuego entre los receptores NMDA y TrkB. En el futuro, las investigaciones deberían centrarse en explicar de forma precisa la relación entre la afinidad de enantiómeros particulares, con los subtipos del receptor NMDA y la activación de los receptores TrkB, incluida la activación y la participación de vías
de señalización intracelulares como mTOR y ERK.
Hasta el momento se ha revelado que la (R)- ketamina, pero no la (S)-ketamina, requiere la expresión del receptor NMDA que contiene la subunidad GluN2D para obtener sus efectos de larga duración en roedores. Sin embargo, se sabe poco acerca de otros subtipos de receptores NMDA y la potencia antidepresiva de los enantiómeros de la ketamina.
Se demostró que una única dosis de (R)- ketamina restauró la composición alterada de la microbiota intestinal inducida por estrés por DS.
La S-ketamina, aprobada por la FDA, se comercializa en for- ma de spray nasal como coadyuvante de un antidepresivo. Tiene más afinidad con el NMDA R, mejor perfil de seguridad, a pesar de producir sedación importante, disociación y abuso (12).
Se debe controlar la presión ya que puede aumentarla, puede producir sedación por lo que hay riesgo para conducir maquinarias. Además de la posibilidad de producir cistitis ul- cerosa y toxicidad embriofetal (2).
Esto indica que los mecanismos biológicos que subyacen a los efectos antidepresivos de la ketamina y de sus enantióme- ros, podrían ser más complejos y la explicación de sus activi- dades puede no estar relacionada solamente con los efectos inducidos en el cerebro.
Las asociaciones de conductas de tipo depresivas con niveles reducidos de BDNF en el hipocampo pero elevados en el núcleo accumbens sugieren que estas dos regiones cerebrales pueden tener diferentes roles en el desarrollo de síntomas depresivos (8). La expresión del BDNF en la corteza prefrontal medial (CPFm) y en el hipocampo puede ser regulada por los recep- tores NMDA que contienen GluN2B, lo cual sugiere que es posible mejorar síntomas depresivos a través de la regulación del BDNF mediante el antagonismo de los receptores NMDA
que contienen GluN2B.
Por otro lado, el bloqueo de los receptores NMDA en las neuronas GABAérgicas por acción de la ketamina u otros an- tagonistas de los receptores NMDA de acción prolongada en la corteza prefrontal, señalan que los antagonistas NMDA tienen el potencial de liberar glutamato en la corteza.
El bloqueo de los receptores NMDA por acción de la keta- mina en las interneuronas GABAérgicas ha sido descripto en porciones del hipocampo. En este proceso, las neuronas pi- ramidales glutamatérgicas son desinhibidas por la liberación de glutamato. El glutamato luego actúa sobre los receptores AMPA en las neuronas postsinápticas. La activación de los receptores AMPA produce la activación de canales de calcio voltaje-dependientes, lo cual provoca un aumento de los ni- veles de iones de calcio intracelulares y aumento del BDNF.
La señalización de ERK es necesaria para revertir comporta- mientos similares a los depresivos.
La activación de mTOR quinasa, controla los procesos de iniciación de la translación de proteínas sinápticas.
La ketamina y otros pocos antagonistas del receptor NMDA inducen la activación de la mTOR quinasa.
La actividad del mTOR y el aumento de la síntesis de pro- teínas sinápticas están correlacionados con cambios estructu-
rales y funcionales en las neuronas.
Otra forma de activación de mTOR por parte de los antago- nistas del receptor NMDA es el bloqueo de receptores NMDA que modifica el estado funcional de los receptores GABA-B metabotrópicos, aumentando la estimulación de los canales de calcio voltaje-dependientes con la consecuente entrada de iones de calcio a la célula (11).
Zanos et al. [42] buscó establecer el mecanismo de acción exacto de la 2R, 6R- HNK, hidroxinorketamina, metabolito de la ketamina.
Más recientemente se ha descrito el rol crucial de los recep- tores dependientes del receptor metabotrópico GluR2 en los efectos antidepresivos de 2R, 6R-HNK (hidroxinorketamina).
Además, a nivel molecular, se reportó una mayor síntesis de BDNF.
Este metabolito de la ketamina, 2R, 6R-hydroxynorketa- mine, tiene una eficacia antidepresiva a través del receptor AMPA R, independientemente del antagonismo NMDA.
Un estudio proteómico reveló que el metabolismo energéti- co está involucrado en los efectos antidepresivos rápidos de la (2R, 6R)- hidroxinorketamina.
Se observó que la HNK mejoró la síntesis anormal de ATP, en la glicólisis alterada y en el sistema de defensas y, por lo tanto, proveen una perspectiva de mecanismos y dianas moleculares para el desarrollo de nuevos antidepresivos. El efecto antidepresivo de la HNK involucra una mejora en el metabolismo energético. La HNK no produjo efectos secunda- rios adictivos como la ketamina en modelos animales, lo que sugiere no sólo un tratamiento alternativo prometedor, sino también mecanismos subyacentes potencialmente diferentes. La hidroxinorketamina mejoró la glicólisis alterada para pro- ducir ATP y el ciclo de los ácidos tricarboxílicos en los tejidos hipocampales de animales deprimidos, mejorando la síntesis
anormal de ATP y la homeostasis energética deteriorada.
Los efectos de la HNK son independientes del antagonis- mo NMDAR. Estos resultados plantean un interrogante muy importante en relación con si se requiere el antagonismo NM- DAR para que la HNK tenga un efecto antidepresivo eficaz y así, ésta podría ser una mejor alternativa que la ketamina dada su ausencia de potencial adictivo en la activación de pensamientos disociativos.
Una función mitocondrial alterada y una reducción en la producción de ATP están involucradas en procesos patológi- cos similares a los depresivos.
Hallazgos recientes indicaron que la HNK exhibía un anta- gonismo NMDA débil pero fuertes efectos antidepresivos, y no tenía efectos secundarios adictivos. Estos resultados presen- tan una oportunidad para identificar moléculas potenciales que subyacen a estos mecanismos (12).
Sistema opioide
Una vía que está surgiendo para el desarrollo de nuevos medicamentos es la modulación del tono opioide endógeno. Los derivados de opioides naturales se han usado para aliviar la melancolía durante siglos (Pecina et al., 2019).
El funcionamiento del sistema opioide puede jugar un papel
en la mediación de respuestas hedónicas en humanos, y la ac- tividad top-down (de arriba hacia abajo) de la corteza prefron- tal lateral puede jugar un papel modulador particularmente importante en un circuito de recompensa subcortical con gran cantidad de receptores opioides (por ejemplo, la amígdala y el núcleo accumbens).
Se sugiere que el receptor opioide Mu con un antagonista de los receptores NMDA como ketamina, podría tener una po- tencial terapéutica en dosis intermitentes para los trastornos afectivos y de ansiedad.
Los importantes avances en la comprensión de la señali- zación de opioides endógenos y el comportamiento han brin- dado un marco que permite considerar los posibles roles de diferentes vías de señalización de opioides en endofenotipos relevantes para la depresión.
Al actuar en los receptores opioides Mu (MOR, por sus si- glas en inglés), se cree que las propiedades euforigénicas in- herentes de estos agonistas ejercen su influencia en el humor mediante la modulación de la neurotransmisión glutamatérgi- ca y dopaminérgica.
Densamente expresados en la neocorteza, en todo el me- sencéfalo y las regiones subcorticales, incluidas la vía estria- topalidal, la amígdala, el hipocampo, el tálamo y la ínsula, los MOR son activados de manera preferencial por el péptido opioide endógeno b-endorfina y la ENK (encefalina), depen- diendo de la región (Beleslin, Samardzic, Krstic, & Micic, 1982; Hughes, Kosterlitz, & Smith, 1977; Nicoll, Siggins, Ling, Bloom, & Guillemin, 1977; Rossier et al., 1977).
Sujetos diagnosticados con trastorno depresivo mayor (TDM) presentaron un menor potencial de unión a MOR en la corteza insular anterior, el tálamo anterior y posterior, los ganglios basales ventrales, la amígdala y la corteza periamig- dalina en comparación con el grupo control. Todas estas áreas están involucradas en la neurobiología de la depresión (15).
Los sujetos deprimidos que no tuvieron una mejora en los síntomas luego de 10 semanas de tratamiento con fluoxeti- na, presentaron disminuciones aún mayores del potencial de unión a MOR.
El funcionamiento social deficiente ha sido descripto como una característica de muchos individuos diagnosticados con TDM, que provoca un alejamiento de los seres queridos y com- portamientos de evasión social (Kupferberg, Bicks, & Hasler, 2016). La evasión del apego en la adultez se correlacionó negativamente con la disponibilidad de MOR en el tálamo, la corteza cingulada anterior (CCA), la amígdala y la ínsula en sujetos deprimidos (Nummenmaa et al., 2015), mientras que una mayor resiliencia al rechazo se correlacionó positivamente con la activación de MOR en la amígdala, la sustancia gris periacueductal (AGPA) y la CCA (Hsu et al., 2013) (14).
Las personas con trastorno depresivo mayor (TDM) con fre- cuencia sufren de disfunción cognitiva. En general, los défi- cits cognitivos más replicables en pacientes con TDM se ob- servan en el campo de la función ejecutiva, incluso cuando se logra la remisión completa y se realiza la corrección de síntomas residuales de trastornos en el estado de ánimo (17).
Se estima que aproximadamente el 37 % de los individuos diagnosticados con TDM sufren anhedonia en niveles signifi- cativos desde el punto de vista clínico.
Por ejemplo, el manual DSM-5 establece que los individuos que reúnen los criterios de anhedonia pueden manifestar sen- tirse “menos interesados en pasatiempos, ‘que ya no les im- porta nada’, o que no sienten alegría en las actividades que antes consideraban placenteras”, y “los miembros de la fami- lia generalmente observan el alejamiento social o el abandono de pasatiempos placenteros”.
El Sistema de norepinefrina (NE) del locus coeruleus (LC) es un importante sistema de activación que también regula los procesos cognitivos mediante sus proyecciones del pro- sencéfalo (Mather & Harley, 2016). Durante el estrés, la acti- vidad del LC se encuentra co-regulada por el neuropéptido re- lacionado al estrés, el factor liberador de corticotrofina (CRF) que actúa sobre la CRFR1, y la encefalina (ENK), que actúa sobre el MOR.
Las terminales axónicas que contienen ENK que derivan de células del núcleo paragigantocelular y las terminales axóni- cas que contienen CRF de las células del núcleo central de la amígdala convergen en dendritas comunes del LC.
La activación de CRFR1 y de MOR genera, respectivamen- te, efectos inhibitorios y excitatorios opuestos en las neuro- nas del LC (15).
La relación entre la neurotransmisión opioide y el estado de ánimo en humanos
Se ha destacado la participación de la corteza prefrontal lateral en la patofisiología de la depresión. Específicamente, las regiones prefrontales dorsolateral y ventrolateral han es- tado implicadas en la eudemonía (es decir, el bienestar) y la anhedonia, respectivamente, en particular cuando se intenta utilizar medios cognitivos para sobreexpresar (up regulate) o subexpresar (down regulate) el afecto positivo, respectivamen- te. Por lo tanto, la corteza prefrontal dorsolateral (CPFDL) y la corteza prefrontal ventrolateral (CPFVL) son regiones en re- lación con la cognición y al afecto positivo. Se sugiere que la CPFVL cumple un papel en el afecto positivo y la cognición (particularmente la regulación de emociones positivas), debi- do a sus probables interacciones con estructuras subcortica- les como por ejemplo el núcleo accumbens (una región clave del cerebro involucrada en la motivación y el placer), consti- tuye un sustrato válido para la co-ocurrencia de síntomas de anhedonia y disfunción ejecutiva en humanos.
El sistema opioide Mu endógeno en la corteza prefrontal se relaciona directamente con la emocionalidad positiva y la fun- ción ejecutiva en humanos con TDM. Los resultados indican que hay una influencia significativa del sistema opioide Mu endógeno en la CPFVL.
El funcionamiento de los receptores opioides-Mu en la CP- FVL mediarían el efecto observado.
La CPFVL es parte de la zona paleocortical de la corteza prefrontal que surge de la corteza orbitofrontal caudal. Está íntimamente conectada con los núcleos límbicos involucrados
en el procesamiento emocional.
Se considera que las deficiencias en la función ejecutiva pueden tener repercusiones posteriores en la capacidad de un individuo de experimentar emociones placenteras.
Dos ensayos controlados realizados por Fava y colegas en los que se utilizó un agonista del receptor opioide Mu, bu- prenorfina, en conjunto con un inhibidor selectivo de la re- captación de serotonina (ISRS) o un inhibidor selectivo de la recaptación de norepinefrina, en una muestra de pacientes con TDM resistentes al tratamiento proporcionaron una evi- dencia suficiente.
Estos resultados apoyan la idea de que los receptores opioi- des Mu juegan, en efecto, un papel en la modulación de la sintomatología de la depresión y pueden ser blancos efectivos de futuros enfoques terapéuticos.
Se ha demostrado recientemente que dentro del núcleo central de la amígdala (CeA), el CRF facilita la liberación de dinorfinas (DYN), que a su vez activa los KOR (kappa) y de manera efectiva atenúan los aumentos en la liberación presi- náptica de GABA inducidos por CRF dentro del núcleo amig- dalino. Estos datos indican claramente la importante función reguladora de los KOR en la neurotransmisión de la amígdala, una región clave en la aparición de valencia negativa.
El agonismo de KOR es un modulador importante de la neu- rotransmisión GABAérgica, glutamatérgica y monoaminérgica (Halasy, Racz, & Maderspach, 2000; Hjelmstad & Fields, 2003; Land et al., 2009; Lemos et al., 2011; McFadzean, Lacey, Hill, & Henderson, 1987; Reyes et al., 2010; Wagner,Etemad, & Thompson, 2001).
Dentro del núcleo dorsal del rafe (DRN), los KOR se en- cuentran en las interneuronas GABAérgicas que inhiben el disparo de serotonina (5-HT). En consecuencia, la activación de los KOR produce un aumento general de la liberación de 5-HT en el prosencéfalo.
La neurotransmisión de DA es un sistema de neurotransmi- sión clave alterado en el contexto de aversión y recompensa y se encuentra fuertemente modulado por los receptores opioides.
A nivel del núcleo accumbens (NAc), los KOR se colocali- zan con los transportadores de dopamina (DAT, por sus siglas en inglés), en las terminales de dopamina (DA), donde pueden controlar la intensidad de la recaptación de DA (Fuentealba, Gysling, Magendzo, & Andres, 2006).
En condiciones normales, los agonistas KOR disminuyen la liberación fásica de DA dentro del NAc; sin embargo, se ha demostrado que la exposición a un estrés agudo por restricción (Anstrom & Woodward, 2005) y al estrés crónico de derrota social (Cao et al., 2010; Krishnan et al., 2008; Razzoli, Andreoli, Michielin, Quarta, & Sokal, 2011; Wook Koo et al., 2016) induce aumentos persistentes en la liberación fásica de DA en neuronas que se proyectan del área tegmental ventral (VTA) al NAcc. Estos cambios fisiológicos fueron revertidos mediante la administración crónica del inhibidor selectivo de la recaptación de serotonina, fluoxetina (Cao et al., 2010), lo que sugiere que las alteraciones inducidas por el estrés en la actividad fásica de la liberación de DA dentro del estriado ventral puede servir como un biomarcador del estrés.
La repetida activación de KOR podría reducir la liberación de DA en la CPF durante la exposición al estrés, e inhibir la liberación del glutamato presináptico en las neuronas pirami- dales dentro de la CPF.
Un mecanismo de regulación de respuestas al estrés y la aparición de trastornos como la depresión ocurre a nivel del eje HPA (eje hipotálamo hipófiso adrenal).
Del mismo modo que con otros receptores opioides, los re- ceptores opioides delta (DOR) se encuentran frecuentemente co-localizados con neuronas CRF-positivas en el hipotálamo y en neuronas GABAérgicas somatostatina- positivas en la región CA1 del hipocampo. Las neuronas DOR/CRF co-loca- lizadas fuera del hipotálamo también están presentes en la BLA (núcleo basolateral de la Amígdala), donde el 55 % de las neuronas CRF son inmunoreactivas a los DOR, y en el CeA (núcleo central de la Amigdala), donde el 67 % de las neuronas identificadas como CRF son DOR positivas (Reyes, Kravets, Connelly, Unterwald, & Van Bockstaele,
Se demostró que dentro del núcleo central de la amígdala (CeA), el CRF facilita la liberación de dinorfinas (DYN), que a su vez activa a los KOR, que de manera efectiva atenúan los aumen- tos en la liberación presináptica de GABA inducidos por CRF.
Estos datos indican claramente la importante función regu- ladora de los KOR en la neurotransmisión de la amígdala, una región clave en la aparición de valencia negativa.
Asimismo, el pretratamiento con N/OFQ (nociceptina/orfa- nina) bloqueó los efectos ansiogénicos del CRF. Bajo estas condiciones ansiogénicas, la N/OFQ redujo significativamente los niveles de 5-HT en la corteza frontal y aumentó la densi- dad del receptor 5HT1A.
En conjunto, estos hallazgos ilustran la interrelación entre el CRF y la N/OFQ en la modulación de comportamientos re- gulados por la neurotransmisión de 5-HT.
La buprenorfina, tiene una actividad sobre múltiples recep- tores opioides. Es antagonista del receptor KOR y agonista parcial del MOR.
La buprenorfina puede administrarse para el tratamiento de la depresión mediante parches dérmicos, inyecciones de depósito, o un implante subcutáneo, que constituyen rutas de administración que no tendrían un potencial adictivo.
Se observaron efectos antiestrés y la mejoría en el procesa- miento emocional de estímulos después del tratamiento con buprenorfina. (Bershad, Jaffe, Childs, & de Wit, 2015; Bers- had, Seiden, & de Wit, 2016). Se está tratando de sintetizar derivados de la buprenorfina que puedan aprovechar los efec- tos beneficiosos y eliminar cualquier probabilidad de generar adicción en relación con el compuesto.
A medida que la evidencia sobre la eficacia antidepresiva de la buprenorfina se vuelva más sólida, lo riesgos/beneficios en pacientes resistentes al tratamiento deberán ser reevaluados.
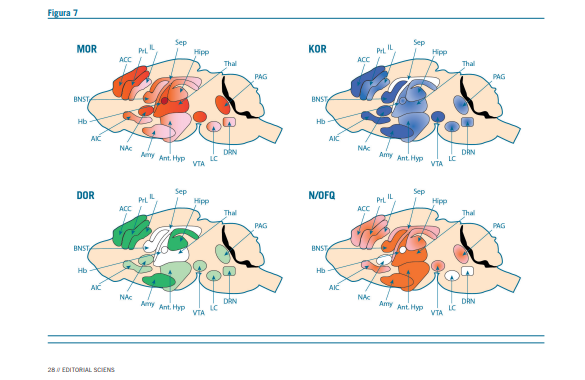
Expresión de MOR, KOR, DOR y NOP en los núcleos cere- brales implicados en los estados afectivos, incluidos los nú- cleos monoaminérgicos, el área tegmental ventral (VTA), el locus coeruleus (LC) y el núcleo dorsal del rafe (DRN). Es- tos receptores están co-localizados en el hipotálamo anterior
(Ant. Hypo), donde modulan la secreción neuroendócrina, las estructuras límbicas y las regiones corticales requeridas para el funcionamiento cognitivo y del estado de ánimo, y se en- cuentran densamente expresados en el núcleo de la sustancia gris periacueductal (PAG), en donde son necesarios para el pro- cesamiento central del dolor. Núcleo basal de la estría termi- nal (BNST), septum (Sep), habénula (Hb), hipocampo (hipp), amígdala (Amy), tálamo (Thal), núcleo accumbens (NAc), cor- teza cingulada anterior (ACC), corteza prelímbica (PrL), corteza infralímbica (IL), y corteza insular anterior (AIC).
En suma, los resultados positivos asociados con compues- tos opioides en ensayos clínicos confirman que los compues- tos opioides multimodales podrían usarse para normalizar muchos de los endofenotipos centrales de la depresión (14).
Depresión postparto (PPD) (19)
La depresión postparto es una de las más comunes compli- caciones del nacimiento.
La prevalencia global, oscila en rangos entre 4 y 25 % y se produce en donde prevalece la mortalidad infantil, mortalidad materna e ingresos insuficientes.
Afecta al 20 % de mujeres durante la gestación o después del nacimiento impactando en el neurodesarrollo y el RN (re- cién nacido).
Si no se trata este cuadro podría traer efectos adversos en la madre y el RN, desarrollando consecuencias a largo plazo como un impacto en la cognición, en el comportamiento y emociones. La vida estresante está asociada con altos grados de recu-
rrencia en futuros peripartos y no peripartos.
En la gestación hay cambios en el eje HPA incluida la su- presión hipotalámica de CRH e incremento en el plasma de CRH, ACTH Y cortisol, que pueden ser factores de riesgo para el desarrollo de PPD, así como también la predisponen los elevados niveles de estrés.
La evidencia considera el rol de NAS (esteroides neuroacti- vos) y el GABA en la fisiopatología de la depresión postparto. La disregulación del metabolismo de NAS, incluyendo allopregnanolona y pregnanolona y / o sus interacciones con
GABA, han sido implicadas en la depresión postparto.
Los NAS (neuroesteroides) elevados antes del parto, están asociados con la inhibición de la enzima (glutámica decarboxi- lasa) reduciendo en el cerebro los niveles de GABA, mientras el postparto se caracteriza por reducida allopregnanolona y una mayor síntesis neuronal de GABA, elevando los niveles de GABA en importantes regiones relacionadas con el cuidado maternal. El periparto es un periodo caracterizado por cambios fisio- lógicos rápidos en los niveles de plasma de hormonas tiroi- deas neurohormonas, péptidos y NAS, oxitocina, prolactina, testosterona, (CRH), corticotrofina ACTH, hormonas tiroideas
y esteroides neuroactivos (NAS).
Se identifica una falla en el periparto en la neuroplasticidad de GABA-A.
Los síntomas son semejantes a los de una depresión severa: persistente tristeza, anhedonia, culpa, irritabilidad, agitación psicomotriz, deterioro en la concentración, disturbios en el
sueño, cambios en el apetito. Puede haber infanticidio, pen- samientos suicidas y riesgo de abuso.
En el postparto CRH, ACTH y los niveles de cortisol de- clinan 4 días después del parto y las hormonas del eje HPA retornan a los niveles previos a la gestación alrededor de 12 semanas después.
En el postparto los niveles de GABA cortical son bajos com- parados con mujeres no deprimidas durante la fase folicular del ciclo menstrual, lo que puede determinar una consecuen- cia prolongada de la exposición a NAS previamente al parto.
Mujeres con previos episodios de PPD tiene un riesgo de recurrencia aproximado de 25 %.
La allopregnanolona tiene un mecanismo regulatorio en el eje HPA debido a la modulación de los receptores GABA A.
La brexanolona es el preparado en solución isotónica estéril de allopregnanolona.
La FDA propone que es un riesgo la pérdida de conciencia, presíncope asociado con el uso de brexanolona, pero induce una potente mejoría dependiente de la concentración de las corrientes mediadas por GABA.
La brexanolona es un neuroesteroide, modulador alostérico del receptor GABA A, que está formado por 5 subunidades. Tiene un canal de ingreso de Cloro. La unión al GABA estáregulada por moduladores alostéricos (14).Los barbitúricos aumentan el tiempo de apertura del canal, mientras que las benzodiacepinas aumentan la frecuencia de apertura del canal, afectando menos la conductancia.Los NAS presentan un efecto intermedio entre ambos (2). La brexanolona produce sedación y pérdida de conocimiento.La brexanolona y esketamina juntas han demostrado ser efectivas en la depresión (13).Ganaxolona es un modulador alostérico positivo de GA- BAA-R similar a la allopregnanolona, pero no igual a ella. No tiene afinidad por receptores estrogénicos o progesterónicos. La formulación IV está siendo testeada en Fase II, doble ciego, controlada con placebo, con diferentes dosis. La formulación oral está siendo testeada en fase II, doble ciego, con placebo en moderada PPD. Hay otras líneas de investigación que incluyen a la inflamación y su relación con la depresión.
Se espera que éstas nuevas teorías y antidepresivos amplíen el abanico de fármacos especialmente en las depresiones se- veras con riesgo de vida, produciéndose así una disminución de la población en plena edad productiva, que presenta se- cuelas de éste debilitante padecimiento, con las consecuencias en su entorno (17).
Referencias bibliográficas
- 1. Roman M, Irwin MR. Novel Neuroimmu- nologic Therapeutics in Depression: A Clinical Perspective on What We Know So Far, Brain, Behavior, and Immunity. Elsevier [Internet]. 16 de septiembre de 2019; Disponible en: http:// dx.doi.org/10.1016/j.bbi
- 2. Alvano S. Psicofarmacología: Desde las ba- ses fisiopatológicas hasta las normativas de tra- tamiento [Apuntes]. APNA (Asociación de Psi- cofarmacología y Neurociencia Argentina) APSA (Asociación de Psquiatras Argentinos). 2020.
- 3. Cui Y et al. Astroglial Kir4.1 in the lateral habenula drives neuronal bursts in depression. Nature [Internet]. febrero de 2018;554:323-7. Disponible en: http://dx.doi.org/10.1038.
- 4. Gronemann FH et al. Treatment patterns in patients with treatment-resistant depression in Danish patients with major depressive disor- der. Journal of Affective Disorders [Internet]. 17 de marzo de 2021;287:204-13. Disponible en: http://dx.doi.org/10.1016/j.jad.2021.03.029
- 5. Tornesea P et al. Chronic mild stress indu- ces anhedonic behavior and changes in gluta- mate release, BDNF tracking and dendrite mor- phology only in stress vulnerable rats. The rapid restorative action of ketamine. Neurobiology of Stress [Internet]. Disponible en: http://dx.doi. org/10.1016/j.ynstr.2019.100160.
- 6. von Bohlen und Halbach O, von Bohlen und Halbach V. BDNF effects on dendritic spine morphology and hippocampal function. Springer-Verlag GmbH Germany, part of Sprin- ger Nature 2018 [Internet]. 15 de febrero de 2018; Disponible en: http://dx.doi.org/10.1007/
s00441-017.
- 7. Andero R, Choi D, Ressler K. BDNF–TrkB Receptor Regulation of Distributed Adult Neural Plasticity, Memory Formation, and Psychiatric Disorders. En: Progress in Molecular Biology and Translational Science, Volume 122 [Internet]. El- sevier; 2014. p. 169-92. Disponible en: http://dx. doi.org/10.1016/B978-0-12-420170-5.00006-4.
- 8. Kinboshi M et al. Inhibition of Inwardly Rec- tifying Potassium (Kir) 4.1 Channels Facilitates Brain-Derived Neurotrophic Factor (BDNF) Ex- pression in Astrocytes. Frontiers in mole [Inter- net]. 7 de diciembre de 2017;10. Disponible en: http://dx.doi.org/10.3389/fnmol.2017.00408
- 9. Ohno Y, Kinboshi M , Shimizu S. Inwardly Rectifying Potassium Channel Kir4.1 as a Novel Modulator of BDNF Expression in Astrocytes. Inter- national Journal of Molecular Sciences [Internet]. 24 de octubre de 2019;19(11):3313. Disponible en: http://dx.doi.org/10.3390/ijms19113313.
- 10. Lei T et al. Rislenemdaz treatment in the lateral habenula improves despair-like behavior in mice. Neuropsychopharmacology [Internet]. 8 de marzo de 2020;45. Disponible en: http:// dx.doi.org/10.1038/s41386-020-0652-9
- 11. Pochwat B, Nowak G, Szewczyk B. An upda- te on NMDA antagonists in depression. Expert Re- view of Neurotherapeutics [Internet]. noviembre de 2019;19(11):1055-67. Disponible en: http:// dx.doi.org/10.1080/14737175.2019.1643237.
- 12. Rahman SU et al. Proteomic study reveals the involvement of energy metabolism in the fast antidepressant effect of (2R, 6R)-hydroxy norketamine. Proetomics Clinical Applications [Internet]. 14 de julio de 2020;4:e1900094.
Disponible en: http://dx.doi.org/10.1002/ prca.201900094.
- 13. Cristea IA, Naudet F. US Food and Drug Ad- ministration approval of esketamine and brexa- nolone. Lancet Psychiatry [Internet]. 31 de oc- tubre de 2019;12:975-7. Disponible en: http:// dx.doi.org/10.1016/S2215-0366(19)30292-5.
- 14. Light SN, Bieliauskas LA, Zubieta JK.
«Top-Down» Mu-Opioid System Function in Hu- mans: Mu-Opioid Receptors in Ventrolateral Pre- frontal Cortex Mediate the Relationship Between Hedonic Tone and Executive Function in Major Depressive Disorder. The Journal of Neuropsy- chiatry and Clinical Neurosciences [Internet]. 2017;29(4):357-64. Disponible en: http://dx. doi.org/10.1176/appi.neuropsych.16090171
- 15. Browne CA, Lucki I. Targeting opioid dys- regulation in depression for the development of novel therapeutics. Pharmacology & Therapeu- tics [Internet]. septiembre de 2019;201:51-76. Disponible en: http://dx.doi.org/10.1016/j.phar- mthera.2019.04.009.
- 16. Jacobson LH, Vlachou S, Slattery DA LX, Cryan JF. The Gamma-Aminobutyric Acid B Receptor in Depression and Reward. Bio- logical Psychiatry [Internet]. 1 de junio de 2018;83(11):963-76. Disponible en: http://dx. doi.org/10.1016/j.biopsych.2018.02.006.
- 17. Frieder A, Fersh M, Hainline R, Deligian- nidis KM. Pharmacotherapy of Postpartum De- pression: Current Approaches and Novel Drug Development. CNS Drugs [Internet]. marzo de 2019;33(3):265-82. Disponible en: http://dx. doi.org/10.1007/s40263-019-00605-7.







No comments! Be the first commenter?