Manía en la población infanto-juvenil.Clínica y tratamiento
Resumen
El trastorno bipolar (TB) de inicio en la infancia es una patología grave con una sintomatología específica que se distingue de las presentaciones en la población adulta (1, 2). Sin embargo, los criterios diagnósticos utilizados en el último Manual de Diagnóstico y Tratamiento de la Asociación Americana de Psiquiatría (DSM 5) no hacen distinción por grupo etario.
Es frecuente que los niños con TB experimenten síntomas inespecíficos, con fluctuaciones diarias del humor con inicio y fi- nalización poco definidas acompañadas de irritabilidad y euforia. También suelen presentar síntomas psicóticos y los trastornos comórbidos son una regla más que una excepción (1, 2, 7).
Existen distintos fármacos aprobados por la agencia reguladora del uso de medicamentos en Estados Unidos (Food and Drug Administration FDA) como la risperidona, el aripiprazol, la quetiapina, la olanzapina, la asenapina y el litio (9, 52).
El presente trabajo es una revisión narrativa que tiene como objetivo analizar las manifestaciones clínicas del TB en la infan- cia y actualizar los tratamientos farmacológicos disponibles.
Palabras clave
Trastorno bipolar – Población infantojuvenil – Manía – Episodio mixto – Tratamiento.
Iveli MF, Ferreyra V. “Manía en la población infanto-juvenil. Clínica y tratamiento”. Psicofarmacología 2021;129:22-30. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El trastorno bipolar (TB) es una patología grave y discapa- citante con una tasa de prevalencia de vida del 2,1 % que no solo afecta a la población adulta, sino también a los ni- ños y adolescentes. Aunque la mayoría de los pacientes son diagnosticados entre los 15 y 35 años, el inicio precoz es frecuente. Se ha reportado que el 5 % de los pacientes inician la sintomatología antes de los 12 años y el 28 % entre los 13 y los 17 años (1, 2).
Si bien el TB se define por episodios de manía, hipomanía o depresión, es habitual que los niños experimenten presen- taciones mixtas con características clínicas diferentes y habi- tualmente más complejas que las que ocurren en la adoles- cencia tardía o en la adultez (3, 4).
Los síntomas iniciales suelen ser inespecíficos tales como irritabilidad, ansiedad, hiperactividad e insomnio, los cuales son comúnmente precursores y suelen persistir durante varios años hasta el desarrollo del episodio afectivo franco y la emergencia del TB (5, 6).
Distintos autores estiman un retraso en el diagnóstico del TB pediátrico de aproximadamente 9 años, el cual podría estar asociado a la heterogeneidad clínica y a la alta comorbilidad con otros trastornos psiquiátricos (5). En una revisión sistemática y metaanálisis en donde se analizaron 11 estudios que involucraron 1365 niños y adolescentes con TB, el 55,2% (95 % CI 40,1-70,3) presentó sintomatología mixta y alta comorbilidad, en particular con trastorno por déficit atencional con hiperactividad, trastorno oposicionista desafiante y trastorno de ansiedad (1, 2, 7).
El curso del TB es variable, sin embargo, los pacientes ra- ramente experimentan un único episodio, estimándose una recurrencia del 70 % a los 5 años. Se ha reportado que los niños con TB suelen estar la mayor parte del tiempo sintomá- ticos lo que propicia un significativo deterioro funcional en el desenvolvimiento psicosocial y académico (8, 9).
El diagnóstico temprano es necesario para la implementa- ción del tratamiento específico ya que la demora en el mismo empeora el curso y el pronóstico de la enfermedad (6).
Clínica
El TB pediátrico posee manifestaciones clínicas específi- cas, sin embargo, los criterios diagnósticos de la última ver- sión del Manual de Diagnóstico y Tratamiento de la Asocia- ción Americana de Psiquiatría (DSM 5), son los mismos que los utilizados en la población adulta. En dicho manual, el TB tipo I se define por la presencia de un episodio maníaco pu- diendo existir períodos de hipomanía, depresión mayor o euti- mia. Por otro lado, el especificador con características mixtas puede incluirse en aquellos pacientes con criterios de manía y coexistencia de al menos tres síntomas depresivos (10).
La manía es un estado del humor patológico que puede manifestarse tanto como euforia o como irritabilidad. Ambas manifestaciones han sido ampliamente descritas en niños y en adolescentes y suelen ser el principal motivo de consulta con el psiquiatra (5).
La euforia se caracteriza por un estado de exaltación con máxima energía, disminución de las horas de sueño e ideas y sentimientos de grandiosidad. Los niños en este estado se muestran alegres, extremadamente divertidos, con frecuencia muestran comportamientos inmaduros y desinhibidos que son difíciles de contener por sus padres. Estos niños también pue- den sentir grandiosidad, mostrándose extremadamente confiados asumiendo proyectos pocos realistas y desafiando la autoridad de los adultos. Por otro lado, la irritabilidad puede evidenciarse como episodios explosivos de agresión, ira, culpa y/o llanto que pueden ser físicamente difíciles de controlar e incluso ser peligrosos. Este síntoma sin la presencia de euforia se ha reportado como la presentación más frecuente en la población pediátrica, es altamente disfuncional y propicia comportamientos de riesgo violentos e impulsivos, así como también ideación suicida (5).
Mientras que los pacientes adultos y adolescentes mayores experimentan cuadros clásicos y definidos de manía o depresión, los niños con TB suelen tener más ciclados ultradianos, es decir cambios diarios del humor y la energía que van de un extremo a otro, descontextualizados del entorno y no precipitados por estímulos externos (2). Esta pronunciada fluctuación afectiva dificulta la identificación del inicio y finalización de cada episodio. Además, los niños no tienen la capacidad de describir de manera clara sus síntomas por lo que puede ser muy difícil diferenciar los cambios (1).
El TB pediátrico se caracteriza por presentar mayor severidad y riesgo de recaída, menos intervalos interepisódicos, más ciclados rápidos, más síntomas psicóticos, altas tasas de suicidios y patología comórbida comparado con el TB de desarrollo en la vida adulta (7).
Es habitual que los niños pequeños cumplan con los criterios del DSM 5 para trastorno bipolar no especificado. Según un estudio naturalístico que incluyó 140 niños y adolescentes con TB no especificado, el 53,6 % evolucionó a TB tipo I o II, en su mayoría durante los cinco años posteriores al diagnóstico (11).
Por otro lado, la historia familiar de trastornos del humor y en particular de TB aumenta el riesgo del desarrollo de TB pediátrico. Según un estudio de Birmaher et al, el 10 % de los niños de padres con TB poseen características clínicas com- patibles con un trastorno del espectro bipolar en comparación con el 0.8 % de los hijos de padres sin dicha patología (2).
Es fundamental considerar los antecedentes y las mani- festaciones clínicas del TB pediátrico. El diagnóstico y trata- miento precoz de los episodios agudos mejoran el pronóstico al reducir el riesgo de recaída y al aumentar la tasa de res- puesta a la medicación (8, 12).
Tratamiento
En las últimas dos décadas ha habido un incremento exponencial de las publicaciones referidas al tratamiento del TB en niños y adolescentes. Los múltiples ensayos clínicos han permitido aumentar el nivel de evidencia científica y así contar con fármacos para el tratamiento de la manía pediátri- ca (13). A pesar de dichos avances, muchas guías de práctica clínica se encuentran desactualizadas. Este es el caso de la guía del Instituto Nacional de Excelencia para la Salud y Atención del Reino Unido (The national institute for Health and Care Excellence – NICE) y la guía de práctica clínica del trastorno bipolar del Ministerio de sanidad, servicios sociales e igualdad de España (14, 15). En el año 2020 se publicó la guía del Colegio Real de psiquiatras de Australia y Nueva Zelanda (The Royal Australian and New Zeland College of Psy- chiatrist) la cual no incluye recomendaciones de tratamiento farmacológico específicas para la población pediátrica (16). Sin embargo, en el año 2018 el Grupo de Trabajo para el tratamiento de los trastornos afectivos y de ansiedad de Canadá (Canadian Network for Mood and Anxiety Treatments) junto con la Sociedad internacional de Trastorno Bipolar (In- ternational Society for Bipolar Disorder – ISBD) publicaron la guía CANMAT en la cual un grupo de expertos ha destacado un apartado para el abordaje de la manía en la población in- fantojuvenil, incorporándose recientemente un anexo para el abordaje de las presentaciones mixtas pediátricas (3, 17). En esta guía se organizan las recomendaciones como primera,
Tabla 1
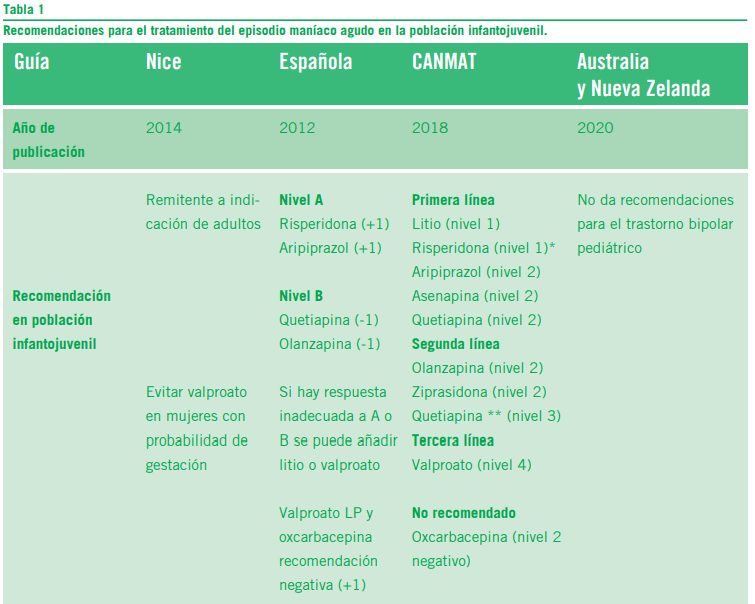
Recomendaciones para el tratamiento del episodio maníaco agudo en la población infantojuvenil.
*Recomendada antes que el litio en comorbilidad con Trastorno por déficit atencional con hiperactividad.
** Quetiapina como terapia coadyuvante.
Niveles de evidencia guía Española: +1 metaanálisis bien realizados, revisiones sistemáticas de ensayos clínicos o ensayos clí- nicos bien realizados con poco riesgo de sesgo, -1 metaanálisis, revisiones sistemáticas de ensayos clínicos o ensayos clínicos con alto riesgo de sesgo.
Niveles de evidencia CANMAT: nivel 1 al menos un metaanálisis con un intervalo de confianza estrecho o ensayos clínicos aleatorizados doble ciego en donde se compare con placebo o con un control activo con un número de pacientes mayor de 30 en cada rama activa, el nivel 2 al menos un metaanálisis con un amplio intervalo de confianza o ensayo clínicos aleato- rizados doble ciego en donde se compare con placebo o con un control activo con un número de pacientes menor de 30 en cada rama activa, el nivel 3 al menos un ensayo clínico aleatorizado doble ciego comparado con placebo o droga activa con un número de 10 a 29 pacientes en cada rama o registros del sistema de salud y por último, el nivel 4 ensayos clínicos no comparativos, reporte de casos u opinión de expertos.
segunda y tercera línea de tratamiento en función a la ma- yor o menor evidencia científica sobre eficacia y seguridad. También se incluye un apartado para aquellos fármacos no recomendados por haber demostrado falta de eficacia. Este es el caso de la oxcarbacepina que posee evidencia negativa para el abordaje de la manía pediátrica (3) (Tabla 1).
Previo al inicio del tratamiento farmacológico se deberá rea- lizar un análisis costo beneficio que oriente a la elección de la mejor opción terapéutica. En la mayoría de los casos el tra- tamiento farmacológico se realiza de manera ambulatorio, sin embargo, los pacientes con manía muchas veces se exponen a situaciones de riesgo que requieren internación (8, 12).
Los síntomas maníacos muchas veces no responden a la monoterapia por lo que es necesario la combinación de fármacos lo cual aumenta el riesgo de desarrollar efectos ad- versos (18). Según resultados de uno de los estudios obser- vacionales vigentes más importantes de niños y adolescentes con trastorno bipolar conocido como COBY (Course and Out- come of Bipolar Illnes in Youth – COBY) los pacientes con TB presentaron mayor sobrepeso y obesidad comparado con la población general siendo factores de riesgo la menor edad y la utilización de más de dos fármacos (9). Por otro lado, un artículo publicado recientemente en donde se analizaron 162 adolescentes y adultos jóvenes bipolares enrolados en el estudio COBY reportó un aumento de cuatro veces en la prevalencia de síndrome metabólico comparado con la población general encontrándose una mayor asociación en pacientes con persistencia sintomática (19).
Si bien en este artículo se revisarán los distintos fármacos recomendados para el tratamiento agudo del episodio maníaco y mixto, es de resaltar que el TB es una patología crónica por lo que luego de remitida la fase aguda, se deberá continuar con una terapia de mantenimiento a fin de evitar las recaídas (20).
Litio
El litio fue el primer agente farmacológico que demostró efi- cacia en el tratamiento de los trastornos del estado del ánimo y fue la primera medicación aprobada por la agencia regula- dora del uso de medicamentos en Estados Unidos (Food and Drug Administration – FDA) para el tratamiento de la manía pediátrica a partir de los 7 años (21).
Múltiples estudios han demostrado su efectividad en los cuadros maníacos y depresivos en el trastorno bipolar, así como su efecto anti-suicidio (22). Recientemente se publicaron los resultados del estudio naturalístico COBY con seguimiento a 10 años en donde se evaluó la mejoría y el riesgo de suicidio en niños y adolescentes medicados con litio y con otros estabilizadores. Los autores concluyeron que el tratamiento con litio se asoció a menor suicidabilidad, menos síntomas depresivos y mejor funcionamiento social (23).
También, se ha demostrado que el litio en dosis terapéuticas presenta efecto cognitivo beneficioso (24). A pesar de estos resultados prometedores, el estrecho intervalo de confianza y su efecto letal en sobredosis limita su uso (25).
La farmacocinética de litio en los pacientes pediátricos no es diferente a la presentada en adultos cuando se considera el tamaño corporal. En niños con peso menor a 30 kilos, se recomienda iniciar con una dosis de 300 mg/día repartidas en dos tomas, pudiendo ser incluso menor en niños pequeños, con incrementos de 300 mg cada 4-5 días (26). El trata- miento con litio requiere del monitoreo de su nivel plasmático que debe realizarse a la semana de iniciado el tratamiento, repitiéndose semanalmente durante el primer mes y mensual- mente durante los 3 a 6 meses subsiguientes. La muestra de sangre se debe obtener luego de 12 horas de la ingesta de la última dosis (27, 28). Algunos autores recomiendan una dosis de mantenimiento en niños y adolescentes de 25-mg/k/día con un rango de nivel plasmático entre 0,6 y 1,2 mEq/L (29). Existen situaciones que pueden llegar a aumentar los nive- les plasmáticos de litio como la deshidratación, diarrea, fiebre, disminución en la ingesta de sodio o la utilización de los antiinflamatorios AINES. En el caso de ser necesaria la utilización de un analgésico se recomienda el paracetamol (27).
En el año 2015 se realizó el primer estudio aleatorizado doble ciego de ocho semanas de duración que incluyó 81 pacientes jóvenes entre 7 a 17 años con manía. El mismo demostró una respuesta del grupo tratado con litio superior al placebo y buena tolerabilidad (30). Estos resultados apoyaron hallazgos previos en estudios abiertos (31, 32).
La guía CANMAT recomienda al litio como tratamiento de primera línea en la manía pediátrica (nivel de evidencia 2) (17).
Risperidona
La risperidona es un antipsicótico atípico aprobado por FDA para el tratamiento agudo de la manía y episodio mixto a partir de los 10 años con una dosis recomendada entre 0.25 y 2.5 mg/día (33, 34).
En un ensayo clínico aleatorizado doble ciego realizado en niños y adolescentes, la risperidona mostró eficacia a dosis de 0,5 a 6 mg/día para el tratamiento de la manía (35). A su vez, en otro estudio comparativo de monoterapia con valproato, el grupo en tratamiento con risperidona presentó una respuesta más rápida y efectiva (36).
En un ensayo clínico aleatorizado doble ciego en donde se evaluó la incorporación de litio, divalproato o risperidona en pacientes que previamente no habían respondido a la mono- terapia con alguno de los fármacos antes mencionados, la risperidona presentó mejor respuesta. El aumento de peso fue similar en todos los grupos (33).
Si bien en la mayoría de los estudios la risperidona fue bien tolerada, los efectos adversos más frecuentes fueron somnolencia, cefalea, fatiga y aumento de peso (35). También existen reportes de alteraciones metabólicas e hiperprolactinemia en una relación dosis dependiente (37, 38, 39).
La guía CANMAT, recomienda a la risperidona como prime- ra línea de tratamiento tanto para la manía (nivel de evidencia 1) como para los episodios mixtos (nivel de evidencia 2). In- cluso, se sugiere su utilización antes que el litio en aquellos pacientes sin obesidad y con comorbilidad con trastorno por déficit atencional con hiperactividad (3, 17).
Aripiprazol
El aripiprazol es un antipsicótico atípico con un efecto agonista parcial sobre el receptor D2, mecanismo de acción que lo distingue del resto de su grupo y estabiliza la neurotransmisión sin provocar un bloqueo excesivo (40).
La FDA ha aprobado al aripiprazol para el tratamiento de la manía y episodios mixtos en niños y adolescentes a partir de los 10 años, para su uso como monoterapia o en combinación con litio o valproato con un rango terapéutico recomendado entre 2 a 30 mg/día (34, 41). Ha demostrado eficacia y tolerabilidad para el tratamiento de distintos trastornos psiquiátricos y múltiples revisiones han subrayado su seguridad en la población pediátrica (41, 42). El aripiprazol posee una menor probabilidad que otros antipsicóticos de producir un aumento en los niveles séricos de prolactina y síntomas extrapiramidales (40).
En un ensayo clínico aleatorizado a doble ciego con segui- miento a 30 semanas en 296 pacientes entre 10 a 17 años con manía aguda o episodio mixto, el aripiprazol demostró eficacia superior al placebo en dosis de 10 a 30 mg/día con buena tolerabilidad siendo los efectos adversos más frecuen- temente reportados cefalea, somnolencia y síndrome extrapi- ramidal (43).
El aripiprazol se encuentra recomendado en la guía CAN- MAT como tratamiento de primera línea para la manía aguda (nivel 2 de evidencia) (17).
Olanzapina
La olanzapina es un antipsicótico atípico que se encuentra aprobado por la FDA para el tratamiento de la manía y episo- dios mixtos a partir de los 13 años con un rango terapéutico entre 2,5 a 20 mg/día (34).
En un ensayo clínico aleatorizado doble ciego, controlado con placebo y multicéntrico en donde se evaluaron 161 pa- cientes de 13 a 17 años con episodio maníaco, la olanzapi- na demostró una efectividad superior pero baja tolerabilidad siendo los efectos adversos más frecuentemente reportados el aumento de peso y el incremento de las enzimas hepáticas, la glucemia, el colesterol, el ácido úrico y la prolactina (44).
En una revisión de metaanálisis en donde se comparó la seguridad de los distintos antipsicóticos, la olanzapina presentó el peor perfil de efectos adversos (45).
La guía CANMAT recomienda a la olanzapina como segunda línea de tratamiento para la manía y los episodios mixtos en la población pediátrica (nivel de evidencia 2) (3, 17).
Asenapina
La asenapina es un antipsicótico atípico que se encuentra aprobada por la FDA como monoterapia en el tratamiento agu- do de la manía y episodios mixtos en niños y adolescentes con TB. Esta aprobación se basó en un ensayo clínico aleatorizado controlado con placebo realizado en 403 pacientes de 10 a 17 años en donde se administraron dosis fijas de 2.5, 5 y 10 mg/día. Todos los grupos tratados con asenapina presentaron mejoría estadísticamente significativa en la escala de manía pediátrica (Young-Mania Rating Scale -YMRS) (46, 47).
A diferencia de otros antipsicóticos atípicos, se administra vía sublingual y posee en la población pediátrica una farma- cocinética similar a la de los adultos por la que no requiere un ajuste en la dosis (48). La ingesta de agua o alimentos dentro de los 10 minutos posteriores a la absorción alteran sustancialmente su biodisponibilidad. Los efectos adversos más frecuentemente reportados son sedación, somnolencia, aumento de peso y alteración metabólica (34).
La asenapina se encuentra recomendada en la guía CAN- MAT como tratamiento de primera línea tanto para la manía como para los episodios mixtos (nivel 2 de evidencia) (3, 17).
Quetiapina
La quetiapina es un fármaco del grupo de los antipsicóticos atípicos con afinidad por múltiples receptores (49). Presenta una baja afinidad como antagonista de los receptores D2 y produce un bloqueo de los receptores serotoninérgicos tipo 2A que se asociaría a un menor desarrollo de efectos adversos motores y mejoría de los síntomas cognitivos y afectivos de los trastornos psiquiátricos (50). Por otro lado, se ha propuesto que la rápida disociación de la quetiapina de los receptores D2 genera a un menor impacto sobre los síntomas motores y a el aumento de la prolactina (51).
El perfil farmacocinético de la quetiapina en la población pediátrica es similar al de los adultos siendo el rango terapéu- tico recomendado para el tratamiento de la manía de 400 a 600 mg/día (20, 34, 52).
La quetiapina se encuentra aprobada por la FDA para el tratamiento de la manía aguda y episodios mixtos entre los 10 y 17 años como monoterapia o como terapia conjunta con litio o divalproato de sodio (52).
En un ensayo clínico aleatorizado doble ciego con seguimiento durante tres semanas se evaluó la eficacia y seguridad de la quetiapina en dosis de 400 y 600 mg/día en 277 niños y adolescentes. Los pacientes en tratamiento con quetiapina mostraron una mejoría estadísticamente significativa y buena tolerabilidad en comparación al grupo con placebo (53). Por otro lado, en un estudio abierto de 26 semanas de seguimiento en donde se utilizaron dosis de quetiapina de 400 a 800 mg/día los efectos adversos más frecuentes fueron somnolencia, sedación, aumento de peso y vómitos (54).
La guía CANMAT recomienda a la quetiapina para episodio maníaco agudo, como monoterapia en primera línea (nivel de evidencia 2) y en segunda línea de tratamiento como terapia coadyuvante (nivel 3 de evidencia). Para episodio mixto se recomienda como tercera línea de tratamiento (nivel de evi- dencia 4) (3, 17).
Ziprazidona
La ziprazidona es un antipsicótico atípico antagonista de los receptores D2, 5HT2A, 5HT1D y agonista del receptor 5HT1A. También posee un efecto inhibidor sobre la recapta- ción de serotonina y noradrenalina (55).
En un estudio abierto con seguimiento a ocho semanas en donde se evaluaron 21 pacientes entre 6 y 17 años con TB, la ziprazidona demostró efectividad superior al placebo (56). Coincidentemente, otro estudio abierto realizado en 63 niños y adolescentes con TB, esquizofrenia y trastorno esquizoafectivo con seguimiento a 6 meses, reportó buena eficacia y to- lerabilidad (58).
Un ensayo clínico realizado en niños y adolescentes, alea- torizado doble ciego comparado con placebo, la ziprazidona en dosis de 40 a 160 mg/día demostró eficacia para el trata- miento de la manía aguda. En este estudio se concluyó que la ziprazidona fue bien tolerada sin impacto en el perfil metabó- lico. Dentro de los efectos adversos más frecuentes se reporta- ron la sedación, la somnolencia, la cefalea y el insomnio (58). Si bien la ziprazidona no se encuentra aprobada por la FDA para su utilización en la población pediátrica, la guía CANMAT la recomienda como segunda línea de tratamiento para la manía aguda y el episodio mixto (nivel de evidencia 2) (3, 17).
Divalproato de Sodio
Si bien el divalproato de Na+ ha demostrado propiedades estabilizantes en adultos, en la población infantojuvenil la evi- dencia es menor. La FDA ha aprobado al divalproato de Na+ para el tratamiento de la manía y episodios mixtos en adultos, pero no en niños.
En un estudio aleatorizado doble ciego en donde se compa- ró divalproato de Na+ con quetiapina en pacientes pediátricos con manía aguda, la quetiapina mostró una respuesta más rápida y mayor (59). Por otro lado, en un estudio aleatorizado doble ciego comparado con placebo realizado en pacientes pe- diátricos con manía aguda, el divalproato de Na+ LP no mostró mejoría significativa en las 4 semanas de seguimiento (60).
La guía CANMAT recomienda al divalproato de Na+ como tercera línea de tratamiento (nivel 4 de evidencia) (17).
Conclusión
El TB de inicio en la infancia y en la adolescencia es una patología grave con una sintomatología específica que se dis- tingue de las presentaciones en la población adulta (1, 2).
Es habitual que los niños experimenten falta de episodios bien definidos con fluctuaciones del humor diarias las cuales suelen acompañarse de irritabilidad y euforia. También son frecuentes los síntomas psicóticos y los trastornos comórbidos como el trastorno por déficit de atención con hiperactividad, el trastorno de conducta y el trastorno de ansiedad (1, 2, 7).
Estas características hacen suponer que la enfermedad po- dría ser más severa y disfuncional que en la población adulta (4, 18). Por este motivo, el diagnóstico precoz y la instaura- ción de un tratamiento específico son fundamentales y deter- minantes del pronóstico.
Dentro de los fármacos aprobados por la FDA se encuentra la risperidona, el aripiprazol, la quetiapina, la olanzapina, la asenapina y el litio (9, 52). Si bien la mayoría de las guías ofrecen pocas recomendaciones para la población pediátrica, la guía CANMAT es un recurso de marcada utilidad para orien- tar el ejercicio clínico en niños y adolescentes con TB.
Bibliografía
- 1. Saxena, K., Kurian, S., Saxena, J., Gol- dberg, A., Chen, E., & Simonetti, A. (2020). Mixed states in early-onset bipolar disorder. The Psychiatric Clinics of North America, 43(1), 95–111.
- 2. Kowatch, R. A. (2016). Diagnosis, phe- nomenology, differential diagnosis, and co-
morbidity of pediatric bipolar disorder. The Journal of Clinical Psychiatry, 77 Suppl E1(- Suppl E1).
- 3. Yatham, L. N., Chakrabarty, T., Bond,
D. J., Schaffer, A., Beaulieu, S., Parikh, S. V., McIntyre, R. S., Milev, R. V., Alda, M.,
Vazquez, G., Ravindran, A. V., Frey, B. N.,
Sharma, V., Goldstein, B. I., Rej, S., O’Do-
novan, C., Tourjman, V., Kozicky, J.-M.,
Kauer-Sant’Anna, M., … Post, R. (2021). Canadian Network for Mood and Anxiety Treatments (CANMAT) and International So- ciety for Bipolar Disorders (ISBD) recommen- dations for the management of patients with bipolar disorder with mixed presentations. Bipolar Disorders, 23(8), 767–788.
- 4. Baldessarini, R. J., Tondo, L., Vazquez,
G. H., Undurraga, J., Bolzani, L., Yildiz, A.,
Khalsa, H.-M. K., Lai, M., Lepri, B., Lolich, M., Maffei, P. M., Salvatore, P., Faedda, G. L., Vieta, E., & Tohen, M. (2012). Age at on- set versus family history and clinical outco- mes in 1,665 international bipolar-I disorder patients. World Psychiatry: Official Journal of the World Psychiatric Association (WPA), 11 (1), 40–46.
- 5. Serra, G., Uchida, M., Battaglia, C., Ca- sini, M. P., De Chiara, L., Biederman, J., Vi- cari, S., & Wozniak, J. (2017). Pediatric ma- nia: The controversy between euphoria and irritability. European Psychiatry: The Journal of the Association of European Psychiatrists, 41(S1), S224–S225.
- 6. Post, R. M., Rowe, M., Kaplan, D., & Findling, R. L. (2017). A multisymptomatic child with bipolar disorder: How to track and sequence treatment. The Primary Care Com- panion to CNS Disorders, 19(4).
- 7. Janiri, D., Conte, E., De Luca, I., Simo- ne, M. V., Moccia, L., Simonetti, A., Mazza, M., Marconi, E., Monti, L., Chieffo, D. P. R., Kotzalidis, G., Janiri, L., & Sani, G. (2021). Not only mania or depression: Mixed states/ mixed features in paediatric Bipolar Disor- ders. Brain Sciences, 11(4), 434.
- 8. Price, A. L., & Marzani-Nissen, G. R. (2012). Bipolar disorders: a review. American Family Physician, 85(5), 483–493.
- 9. Goldstein, B. I., Birmaher, B., Axelson,
D. A., Goldstein, T. R., Esposito-Smythers, C., Strober, M. A., Hunt, J., Leonard, H.,
Gill, M. K., Iyengar, S., Grimm, C., Yang, M., Ryan, N. D., & Keller, M. B. (2008). Prelimi- nary findings regarding overweight and obe- sity in pediatric bipolar disorder. The Journal of Clinical Psychiatry, 69(12), 1953–1959.
- 10. Cooper, R. (2019). Diagnosing the diagnostic and statistical manual of mental disorders: Fifth edition. Routledge.
- 11. Birmaher, B., Merranko, J. A., Golds- tein, T. R., Gill, M. K., Goldstein, B. I., Hower, H., & Keller. (2018). A risk calcula- tor to predict the individual risk of conver- sion from subthreshold bipolar symptoms to bipolar disorder I or II in youth. Journal of the American Academy of Child & Adolescent Psychiatry, 57(10), 755–763.
- 12. Findling, R. L. (2016). Evidence-based pharmacologic treatment of pediatric bipolar disorder. The Journal of Clinical Psychiatry, 77 Suppl E1(Suppl E1), e2.
- 13. Goldstein, B. I., Birmaher, B., Carl- son, G. A., DelBello, M. P., Findling, R. L.,
Fristad, M., Kowatch, R. A., Miklowitz, D. J., Nery, F. G., Perez-Algorta, G., Van Meter, A., Zeni, C. P., Correll, C. U., Kim, H.-W., Wozniak, J., Chang, K. D., Hillegers, M., & Youngstrom, E. A. (2017). The International Society for Bipolar Disorders Task Force re- port on pediatric bipolar disorder: Knowledge to date and directions for future research. Bi- polar Disorders, 19(7), 524–543.
- 14. NICE (2015) Bipolar disorder: the as- sessment and management of bipolar disor- der in adults, children and young people in primary and secondary care. NICE Clinical Guideline, vol. 185, p. 2015.
- 15. Ortiz, M. F. B., & De, G. D. T. D. L. G.
D. P. C. S. T. (2012). Guía de Práctica Clíni- ca sobre Trastorno Bipolar [Versión completa y Versión resumida. Revista de la Asociación Española de Neuropsiquiatría, 32(115), 639–641.
- 16. Malhi, G. S., Bell, E., Bassett, D., Boyce, P., Bryant, R., Hazell, P., Hopwood, M., Lyndon, B., Mulder, R., Porter, R., Sin- gh, A. B., & Murray, G. (2021). The 2020 Royal Australian and New Zealand College of Psychiatrists clinical practice guidelines for mood disorders. The Australian and New Zealand Journal of Psychiatry, 55(1), 7–117.
- 17. Yatham, L. N., Kennedy, S. H., Parikh,
S. V., Schaffer, A., Bond, D. J., Frey, B. N., Sharma, V., Goldstein, B. I., Rej, S., Beau- lieu, S., Alda, M., MacQueen, G., Milev, R. V., Ravindran, A., O’Donovan, C., McIntosh, D., Lam, R. W., Vazquez, G., Kapczinski, F.,
… Berk, M. (2018). Canadian Network for Mood and Anxiety Treatments (CANMAT) and International Society for Bipolar Disorders (ISBD) 2018 guidelines for the management of patients with bipolar disorder. Bipolar Di- sorders, 20(2), 97–170.
- 18. Geller, B., Luby, J. L., Joshi, P., Wag-
ner, K. D., Emslie, G., Walkup, J. T., Axel-
son, D. A., Bolhofner, K., Robb, A., Wolf, D.
V., Riddle, M. A., Birmaher, B., Nusrat, N., Ryan, N. D., Vitiello, B., Tillman, R., & La- vori, P. (2012). A randomized controlled trial of risperidone, lithium, or divalproex sodium for initial treatment of bipolar I disorder, ma- nic or mixed phase, in children and adoles- cents. Archives of General Psychiatry, 69(5), 515–528.
- 19. Li, C., Birmaher, B., Rooks, B., Gill, M. K., Hower, H., Axelson, D. A., Dickstein, D. P., Goldstein, T. R., Liao, F., Yen, S., Hunt,
J., Iyengar, S., Ryan, N. D., Strober, M. A.,
Keller, M. B., & Goldstein, B. I. (2019). High prevalence of metabolic syndrome among adolescents and young adults with bipolar disorder. The Journal of Clinical Psychiatry, 80(4).
- 20. Yee, C. S., Hawken, E. R., Baldessarini,
R. J., & Vázquez, G. H. (2019). Maintenance pharmacological treatment of juvenile bipo- lar disorder: Review and meta-analyses. The International Journal of Neuropsychophar- macology, 22(8), 531–540. https://doi. org/10.1093/ijnp/pyz034.
- 21. Pisano, S., Pozzi, M., Catone, G., Scrin- zi, G., Clementi, E., Coppola, G., & Masi. (2019). Putative mechanisms of action and clinical use of lithium in children and adoles- cents: a critical review. Current neuropharma- cology, 17(4), 318–341.
- 22. Smith, K. A., & Cipriani, A. (2017). Lithium and suicide in mood disorders: Up- dated meta-review of the scientific literature. Bipolar Disord, 19(7), 575–586.
- 23. Hafeman, D. M., Rooks, B., Merranko, J., Liao, F., Gill, M. K., Goldstein, T. R., Di- ler, R., Ryan, N., Goldstein, B. I., Axelson, D. A., Strober, M., Keller, M., Hunt, J., Hower, H., Weinstock, L. M., Yen, S., & Birmaher,
B. (2020). Lithium versus other mood-stabi- lizing medications in a longitudinal study of youth diagnosed with bipolar disorder. Jour- nal of the American Academy of Child and Adolescent Psychiatry, 59(10), 1146–1155.
- 24. Mauer, S., Vergne, D., & Ghaemi, S. N. (2014). Standard and trace-dose lithium: a systematic review of dementia prevention and other behavioral benefits. The Australian and New Zealand Journal of Psychiatry, 48(9), 809–818.
- 25. Naguy, A. (2016). Lithium is Clearly Underutilized in Child Psychiatry. Chinese Medical Journal, 129(3), 376.
- 26. Grant, B., & Salpekar, J. A. (2018). Using lithium in children and adolescents with bipolar disorder: Efficacy, tolerabili- ty, and practical considerations. Paediatric Drugs, 20(4), 303–314.
- 27. Tondo, L., Alda, M., Bauer, M., Ber-
gink, V., Grof, P., Hajek, T., Lewitka, U., Li- cht, R. W., Manchia, M., Müller-Oerlinghau- sen, B., Nielsen, R. E., Selo, M., Simhandl, C., Baldessarini, R. J., & International Group for Studies of Lithium (IGSLi). (2019). Clini- cal use of lithium salts: guide for users and prescribers. International Journal of Bipolar Disorders, 7(1), 16.
- 28. Landersdorfer, C. B., Findling, R. L., Frazier, J. A., Kafantaris, V., & Kirkpatrick,
C. M. J. (2017). Lithium in paediatric pa- tients with bipolar disorder: Implications for selection of dosage regimens via population pharmacokinetics/pharmacodynamics. Clini- cal Pharmacokinetics, 56(1), 77–90.
- 29. Amerio, A., Ossola, P., Scagnelli, F., Odone, A., Allinovi, M., Cavalli, A., Iacope- lli, J., Tonna, M., Marchesi, C., & Ghaemi,
S. N. (2018). Safety and efficacy of lithium in children and adolescents: A systematic re- view in bipolar illness. European Psychiatry: The Journal of the Association of European Psychiatrists, 54, 85–97.
- 30. Findling, R. L., Robb, A., McNamara,
N. K., Pavuluri, M. N., Kafantaris, V., Sche- ffer, R., Frazier, J. A., Rynn, M., DelBello, M., Kowatch, R. A., Rowles, B. M., Lingler,
J., Martz, K., Anand, R., Clemons, T. E., & Taylor-Zapata, P. (2015). Lithium in the acute treatment of bipolar I disorder: A dou- ble-blind, placebo-controlled study. Pedia- trics, 136(5), 885–894.
- 31. Rajeev, J., Srinath, S., Girimaji, S., Seshadri, S. P., & Singh, P. (2004). A syste- matic chart review of the naturalistic course and treatment of early-onset bipolar disorder in a child and adolescent psychiatry center. Comprehensive Psychiatry, 45(2), 148–154.
- 32. Bailly, D. (2017). Pharmacological treatment of bipolar disorder in children and adolescents. L’Encephale, 43(3), 254–258.
- 33. Walkup, J. T., Wagner, K. D., Miller, L.,
Yenokyan, G., Luby, J. L., Joshi, P. T., Axel-
son, D. A., Robb, A., Salpekar, J. A., Wolf, D., Sanyal, A., Birmaher, B., Vitiello, B., & Ridd- le, M. A. (2015). Treatment of Early-Age Ma- nia: Outcomes for partial and nonresponders to initial Treatment. Journal of the American Academy of Child and Adolescent Psychiatry, 54(12), 1008–1019.
- 34. Stepanova, E., & Findling, R. L. (2017). Psychopharmacology of bipolar disorders in children and adolescents. Pediatric Clinics of North America, 64(6), 1209–1222.
- 35. Haas, M., Delbello, M. P., Pandina, G., Kushner, S., Van Hove, I., Augustyns, I., Qui- roz, J., & Kusumakar, V. (2009). Risperidone for the treatment of acute mania in children and adolescents with bipolar disorder: a ran- domized, double-blind, placebo-controlled study. Bipolar Disorders, 11(7), 687–700.
- 36. Pavuluri, M. N., Henry, D. B., Findling,
R. L., Parnes, S., Carbray, J. A., & Moham- med, T. (2010). Double-blind randomized trial of risperidone versus divalproex in pe- diatric bipolar disorder: Risperidone vs. di- valproex in pediatric mania. Bipolar Disord, 12(6), 593–605.
- 37. Anderson, G. M., Scahill, L., Mccrac- ken, J. T., Mcdougle, C. J., Aman, M. G., & Tierney, E. (2007). Effects of short-and long- term risperidone treatment on prolactin levels in children with autism. Biological psychiatry, 61(4), 545–550.
- 38. Findling, R. L., & Daneman, D. (2016). Prolactin Levels During Long-Term Risperido- ne Treatment in Children and Adolescents: a reanalysis of data: A reanalysis of data. The Journal of Clinical Psychiatry, 77(2), e155-70.
- 39. Sun, A. Y., Woods, S., Findling, R. L., & Stepanova, E. (2019). Safety considerations in the psychopharmacology of pediatric bipo- lar disorder. Expert Opinion on Drug Safety, 18(9), 777–794.
- 40. Kikuchi, T. (2007). The research and development of aripiprazole and its mecha- nism of action. Jpn J Clin Psychopharmacol, 10(3), 464–468.
- 41. Kirino, E. (2014). Profile of aripipra- zole in the treatment of bipolar disorder in children and adolescents. Adolescent Health, Medicine and Therapeutics, 5, 211–221.
- 42. Doey, T. (2012). Aripiprazole in pediatric psychosis and bipolar disorder: a clinical review. Journal of Affective Disorders, 138 Suppl, S15- 21.
- 43. Findling, R. L., Correll, C. U., Nyilas, M., Forbes, R. A., Mcquade, R. D., & Jin, N. (2013). Aripiprazole for the treatment of pe- diatric bipolar I disorder: a 30-week, rando- mized, placebo-controlled study: Aripiprazole in pediatric bipolar disorder. Bipolar Disord, 15(2), 138–149.
- 44. Tohen, M., Kryzhanovskaya, L., Carl- son, G., Delbello, M., Wozniak, J., Kowatch, R., Wagner, K., Findling, R., Lin, D., Robert-
son-Plouch, C., Xu, W., Dittmann, R. W., & Biederman, J. (2007). Olanzapine versus placebo in the treatment of adolescents with bipolar mania. The American Journal of Psy- chiatry, 164(10), 1547–1556.
- 45. Solmi, M., Fornaro, M., Ostinelli, E. G., Zangani, C., Croatto, G., Monaco, F., Krinits- ki, D., Fusar-Poli, P., & Correll, C. U. (2020). Safety of 80 antidepressants, antipsychotics, anti-attention-deficit/hyperactivity medica-
tions and mood stabilizers in children and adolescents with psychiatric disorders: a lar- ge scale systematic meta-review of 78 adver- se effects. World Psychiatry: Official Journal of the World Psychiatric Association (WPA), 19(2), 214–232.
- 46. Findling, Robert L., Landbloom, R. L., Szegedi, A., Koppenhaver, J., Braat, S., Zhu, Q., Mackle, M., Chang, K., & Mathews, M. (2015). Asenapine for the acute treatment of pediatric manic or mixed episode of bipolar I disorder. Journal of the American Academy of Child and Adolescent Psychiatry, 54(12), 1032–1041.
- 47. Stepanova, E., Grant, B., & Findling,
R. L. (2018). Asenapine treatment in pedia- tric patients with bipolar I disorder or schi- zophrenia: A review. Paediatric Drugs, 20(2), 121–134.
- 48. Citrome, L. (2014). Asenapine review, part I: chemistry, receptor affinity profile, pharmacokinetics and metabolism. Expert Opinion on Drug Metabolism & Toxicology, 10(6), 893–903.
- 49. Zhornitsky, S., Potvin, S., Moteshafi, H., Dubreucq, S., Rompré, P.-P., & Stip, E. (2011). Dose-response and comparative effi- cacy and tolerability of quetiapine across psy- chiatric disorders: a systematic review of the placebo-controlled monotherapy and add-on trials. International Clinical Psychopharma- cology, 26(4), 183–192.
- 50. Jensen, K. G., Correll, C. U., Rudå, D., Klauber, D. G., Decara, M. S., Fagerlund, B., Jepsen, J. R. M., Eriksson, F., Fink-Jensen, A., & Pagsberg, A. K. (2019). Cardiometa- bolic adverse effects and its predictors in Children and adolescents with first-episode psychosis during treatment with quetiapi- ne-extended release versus aripiprazole: 12- week results from the tolerance and Effect of antipsychotics in Children and Adolescents With Psychosis (TEA) trial. Journal of the American Academy of Child and Adolescent Psychiatry, 58(11), 1062–1078.
- 51. Ribolsi, M., Magni, V., & Rubino, I. A.
(2010). Quetiapine fumarate for schizophrenia and bipolar disorder in young patients. Drugs of Today (Barcelona, Spain: 1998), 46(8),
581–587.
- 52. http://www.accessdata.fda.gov/scripts/ cder/daf/
- 53. Pathak, S., Findling, R. L., Earley, W. R., Acevedo, L. D., Stankowski, J., & Delbello,
M. P. (2013). Efficacy and safety of quetia- pine in children and adolescents with mania associated with bipolar I disorder: a 3-week, double-blind, placebo-controlled trial. The Journal of Clinical Psychiatry, 74(1), e100-9.
- 54. Findling, Robert L., Pathak, S., Earley,
W. R., Liu, S., & DelBello, M. (2013). Safe- ty, tolerability, and efficacy of quetiapine in youth with schizophrenia or bipolar I disorder: a 26-week, open-label, continuation study. Journal of Child and Adolescent Psychophar- macology, 23(7), 490–501.
- 55. Elbe, D., & Carandang, C. G. (2008). Focus on ziprasidone: a review of its use in child and adolescent psychiatry. Journal de l’Academie Canadienne de Psychiatrie de l’enfant et de l’adolescent [Journal of the Canadian Academy of Child and Adolescent Psychiatry], 17(4), 220–229.
- 56. Biederman, J., Mick, E., Spencer, T., Dougherty, M., Aleardi, M., & Wozniak, J. (2007). A prospective open-label treatment trial of ziprasidone monotherapy in children
and adolescents with bipolar disorder: Zipra- sidone for pediatric bipolar disorder. Bipolar Disorders, 9(8), 888–894.
- 57. DelBello, M. P., Versavel, M., Ice, K., Keller, D., & Miceli, J. (2008). Tolerability of oral ziprasidone in children and adoles- cents with bipolar mania, schizophrenia, or schizoaffective disorder. Journal of Child and Adolescent Psychopharmacology, 18(5), 491–499.
- 58. Findling, Robert L., Cavus, I., Pappa- dopulos, E., Vanderburg, D. G., Schwartz, J. H., Gundapaneni, B. K., & DelBello, M. P. (2013). Efficacy, long-term safety, and tole- rability of ziprasidone in children and adoles- cents with bipolar disorder. Journal of Child and Adolescent Psychopharmacology, 23(8), 545–557.
- 59. Delbello, M. P., Kowatch, R. A., Adler,
C. M., Stanford, K. E., Welge, J. A., Barz- man, D. H., Nelson, E., & Strakowski, S.
M. (2006). A double-blind randomized pilot study comparing quetiapine and divalproex
for adolescent mania. Journal of the Ameri- can Academy of Child and Adolescent Psy- chiatry, 45(3), 305–313.
- 60. Wagner, K. D., Redden, L., & Kowatch,
R. A. (2009). A double-blind, randomized, placebocontrolled trial of divalproex exten- ded-release in the treatment of bipolar disor- der in children and adolescents. J Am Acad Child Adolesc Psychiatry, 48(5), 519–532.







No comments! Be the first commenter?