El endotelio como blanco terapéutico Disfunción endotelial,biomarcadores y medicina de precisión cardiovascular
Resumen
La disfunción endotelial representa un fenómeno central en la fisiopatología de las enfermedades cardiovasculares. Este proceso, dinámico y multi- factorial, implica alteraciones en la biodisponibilidad del óxido nítrico, estrés oxidativo, inflamación crónica y desorganización estructural de la barrera endotelial. Su detección precoz y caracterización molecular permiten no solo comprender mejor el origen de patologías como la aterosclerosis, hipertensión o insuficiencia cardíaca, sino también identificar blancos terapéuticos clave. Este artículo revisa los mecanismos celulares de la disfunción endotelial, los métodos clínicos de evaluación funcional del endotelio y los biomarcadores circulantes más relevantes, con especial énfasis en su integración en estrategias de Medicina Cardiovascular de Precisión..
Palabras clave
Disfunción endotelial – Óxido nítrico – Estrés oxidativo – Biomarcadores vasculares – Medicina de Precisión – Enfermedad cardiovascular.
Introducción
El endotelio vascular ha pasado de ser considerado una sim- ple barrera pasiva a ser reconocido como un órgano dinámico y multifuncional, fundamental para la homeostasis cardio- vascular. Esta monocapa celular, que recubre el interior de todos los vasos sanguíneos, regula funciones esenciales como el tono vascular, la coagulación, la respuesta inflamatoria y la permeabilidad capilar. En las últimas décadas, se ha es- tablecido que su disfunción constituye un evento temprano y reversible que precede a la manifestación clínica de múltiples enfermedades cardiovasculares, incluyendo aterosclerosis, hi- pertensión arterial e insuficiencia cardíaca (1–3).
La disfunción endotelial se caracteriza por alteraciones en la integridad estructural y funcional del endotelio que con- ducen a una reducción de la biodisponibilidad de óxido ní- trico (NO), un aumento del estrés oxidativo, una activación del estado inflamatorio crónico. Estos cambios promueven un entorno proaterogénico, procoagulante y vasoconstrictor, que
Forcada P. “El endotelio como blanco terapéutico. Disfunción endotelial, biomarcadores y medicina de precisión cardiovascular”. Farmacología Cardiovascular 2025;64:4-14.
farmacología cardiovascular 64 | Octubre de 2025
facilita la progresión de la enfermedad cardiovascular desde las etapas subclínicas, a las clínicas más avanzadas y es un actor principal en las grandes complicaciones cardiovasculares (4, 5).
A su vez, los avances en farmacología cardiovascular y en biología molecular han permitido identificar biomarcadores circulantes y nuevas herramientas funcionales para evaluar la salud endotelial, abriendo la posibilidad de detectar precozmente la disfunción y desarrollar estrategias terapéuticas más específicas y personalizadas. En este contexto, el endotelio es arte y parte del daño vascular, y constituye un blanco terapéu- tico estratégico de una Medicina de Precisión (6–8).
Este artículo tiene como objetivo revisar de manera integrada los mecanismos moleculares implicados en la disfunción endotelial, sus los métodos actuales de para su evaluación clínica, los biomarcadores más relevantes y las oportunidades terapéuticas emergentes en el manejo contemporáneo de la enfermedad cardiovascular.
Concepto histórico y evolución del término “Disfunción Endotelial”
El término disfunción endotelial emergió a fines del siglo XX para describir una alteración funcional del endotelio vascular, caracterizada por la pérdida de su capacidad de mantener la homeostasis de la estructura y función vascular. Su reco- nocimiento marcó un cambio de paradigma en la compren- sión de la fisiopatología cardiovascular, al evidenciarse que muchos de los procesos patológicos atribuibles a los vasos sanguíneos, tenían en su origen en una sutil pero poderosa alteración endotelial, dada la extensión del endotelio en todo el árbol vascular.
Durante gran parte del siglo XX, el endotelio fue considerado una estructura pasiva, meramente anatómica. Sin embargo, a partir de investigaciones pioneras entre los 50s y los 90s, se reconoció su rol activo como órgano secretor y modulador de en múltiples funciones vasculares, incluyendo la liberación de óxido nítrico (NO), prostaciclinas, endotelina-1, diversas citokinas moduladoras de la inflamaciòn y factores pro y anticoagulantes (9).
En la década de 1990, el concepto de disfunción endotelial se formalizó, impulsado por evidencias que demostraban su asociación temprana con los factores de riesgo cardiovascular tradicionales, como hipertensión, tabaquismo, dislipidemia y diabetes mellitus. Se observó que estas condiciones inducían alteraciones funcionales endoteliales incluso antes de la aparición de lesiones estructurales en la pared vascular, y que tales cambios eran detectables mediante pruebas fisiológicas no invasivas (10).
Posteriormente, estudios prospectivos demostraron que la disfunción endotelial no solo precede a la enfermedad cardiovascular clínica, sino que también actúa como un predictor independiente de eventos mayores, como infarto de miocardio, accidente cerebrovascular e insuficiencia cardíaca (11, 12). Este hallazgo consolidó su valor clínico y la posicionó como una herramienta útil para la estratificación del riesgo.
En la actualidad, se considera que la disfunción endotelial representa un proceso dinámico, multifactorial y potencial- mente reversible, que afecta tanto a la macro como a la mi- crovasculatura. Se reconoce su carácter subclínico en muchas ocasiones, por lo que es muy importante su identificación temprana mediante métodos funcionales y biomarcadores circulantes. Además, se ha consolidado como un blanco tera- péutico relevante en la Medicina de Precisión, al demostrarse que ciertas intervenciones —como estatinas, inhibidores del sistema renina-angiotensina, inhibidores de SGLT2 y ejercicio físico estructurado entre otras tantas— pueden restaurar parcialmente la función endotelial y reducir el riesgo cardiovas- cular global (13–15).
Este recorrido histórico refleja la evolución de una visión estructuralista hacia una concepción integradora y funcional del endotelio, como órgano clave en la salud cardiovascular.
Homeostasis endotelial y homeostasis cardiovascular
El endotelio vascular, compuesto por una sola capa de célu- las endoteliales que recubre el interior del sistema circulato- rio, cumple funciones esenciales para el mantenimiento de la homeostasis cardiovascular. A lo largo de las últimas décadas, se ha reconocido su papel como un órgano activo y altamente especializado, cuya función va mucho más allá de una mera barrera física.
En condiciones fisiológicas, el endotelio actúa como un regulador clave del tono vascular, la hemostasia, la inflamación y el equilibrio oxidativo. Esta capacidad depende de un balance dinámico entre factores vasodilatadores y vasoconstrictores, su intervención en los mecanismos hemostáticos, así como modular señales proinflamatorias y antiinflamatorias, lo que le confiere una notable plasticidad funcional. El endotelio sano promueve la vasodilatación, la anticoagulación y la supresión de la inflamación. Sin embargo, bajo determinadas condiciones patológicas, puede adoptar un fenotipo opuesto, caracterizado por vasoconstricción, activación plaquetaria, expresión de moléculas de adhesión y liberación de citocinas inflamatorias (16, 17).
Entre las funciones homeostáticas más relevantes se en- cuentran:
- Regulación del tono vascular y la presión arterial, mediada principalmente por la síntesis de óxido nítrico (NO) a través de la óxido nítrico sintasa endotelial (eNOS). El NO induce relajación del músculo liso vascular, inhibe la proliferación celular y reduce la agregación plaquetaria. Su acción se contrarresta por factores vasoconstrictores como la endotelina-1, la angiotensina II y el tromboxano A2, y requiere de un equilibrio fino para mantener una presión arterial y el un flujo tisular adecuados (18).
- Control de la hemostasia y la trombosis, mediante la liberación de prostaciclina, trombomodulina, inhibidores de la coagulación (como TFPI y antitrombina III), así como activadores de la fibrinólisis (t-PA). El endotelio regula así tanto la formación como la resolución del coágulo, asegurando una respuesta eficaz pero limitada ante lesiones vasculares [19]. Por otro lado, el inhibidor de activador de Plasminogeno 1 (PAI1) y otros factores producidos por disfunción endotelial promueven la trombogénesis.
- Modulación de la inflamación y la permeabilidad capilar, a través de la expresión controlada de moléculas de adhesión (ICAM-1, VCAM-1, E-selectina), interleucinas (IL-6, IL-10) y especies reactivas de oxígeno. En este contexto, el endotelio
no solo responde a estímulos inflamatorios, sino que también actúa como una célula inmunocomunicadora, capaz de orquestar respuestas especificas o generales, tanto promoviendo como suprimiendo respuestas inmunes locales y sistémi- cas (20, 21).
Cuando se rompe este el equilibrio, como ocurre en la dis- función endotelial, se produce una cascada de eventos que favorece el desarrollo de enfermedades cardiovasculares. La pérdida de biodisponibilidad de NO, junto con el aumento del estrés oxidativo y la expresión de mediadores proinflamatorios y factores procoagulantes y trombogénicos, constituye una firma bioquímica común a patologías como la aterosclerosis, la hipertensión arterial, la diabetes tipo 2 y la insuficiencia cardíaca (22).
Desde una perspectiva clínica, actualmente el estudio de la función endotelial adquiere creciente relevancia diagnóstica, terapéutica y pronóstica. La evaluación de la salud endotelial mediante pruebas funcionales (como la dilatación mediada por flujo) o biomarcadores plasmáticos permite identificar estados preclínicos de disfunción vascular y orientar intervenciones específicas que pueden revertir o atenuar el proceso. A su vez, se ha demostrado que la mejora de la función en-

dotelial se asocia con una reducción del riesgo de eventos cardiovasculares mayores, consolidando su valor como blanco terapéutico (23–25).
En síntesis, el endotelio se ha consolidado como un actor central en la regulación de la estructura y función vascular, cuya integridad funcional condiciona de manera directa la evolución clínica de múltiples enfermedades cardiovasculares crónicas. Su comprensión no solo permite detectar de forma temprana alteraciones vasculares, sino también intervenir más precoz y efectivamente y en forma precisa y personalizada.
Mecanismos moleculares de disfunción endotelial
La disfunción endotelial es un proceso complejo y multifac- torial generado por una alteración progresiva en las funciones fisiológicas del endotelio. Se caracteriza principalmente por la pérdida de la capacidad vasodilatadora dependiente de óxido nítrico (NO), el aumento del estrés oxidativo, la activación de vías inflamatorias crónicas, y el deterioro estructural de las uniones intercelulares y del glicocálix. Estos eventos mole- culares no se producen de forma aislada, sino que se inte- rrelacionan, generando un entorno vascular que favorece el desarrollo de múltiples enfermedades cardiovasculares, meta- bólicas e inflamatorias (26–28).
Reducción de la biodisponibilidad de óxido nítrico (NO)
La síntesis de Óxido Nítrico (ON) por la óxido nítrico sintasa endotelial (eNOS) es un mecanismo central en la protección vascular. Esta molécula favorece la vasodilatación, inhibe la agregación plaquetaria, modula la proliferación del músculo liso y tiene propiedades antiinflamatorias. Diversos factores estimulan el endotelio para que libere ON, entre ellos estí- mulos mecánicos sobre la superficie (glicocálix y cilios) e in- cluso la estructura celular endotelial (el citoesqueleto), men- sajeros celulares, bioquímicos y neurohumorales que actúan sobre múltiples receptores endoteliales (citokinas, hormonas, angiotensina II, etc.). Por ello, su disminución es un evento temprano y crítico en la disfunción endotelial (29).
Diversos mecanismos contribuyen a la menor disponibilidad de ON. Uno de los más relevantes es la disminución de la expresión y/o de la actividad de la eNOS, inducida por estrés oxidativo, disfunción mitocondrial, hiperglucemia o deficien- cia de cofactores como la tetrahidrobiopterina (BH4). Además, la sobreexpresión de arginasa reduce la disponibilidad de L-arginina, sustrato esencial para la producción de NO. Otro inhibidor endógeno, la dimetilarginina asimétrica (ADMA), se acumula en condiciones como insuficiencia renal o diabetes mellitus, bloqueando competitivamente la actividad de la eNOS (30, 31).
Un fenómeno particularmente dañino es el desacople de la
eNOS, en el cual la enzima pasa de producir NO a generar es- pecies reactivas de oxígeno (ROS), como el anión superóxido. Este superóxido se combina rápidamente con el NO, formando peroxinitrito (ONOO⁻), una molécula altamente reactiva que perpetúa el daño endotelial (32).
Desde el punto de vista clínico, la disminución del ON se traduce en alteraciones detectables mediante pruebas como la dilatación mediada por flujo (FMD) y clínicamente, en un aumento del riesgo de eventos trombóticos y vasculares ma- yores. Asimismo, niveles plasmáticos reducidos de nitritos/ni- tratos y un cociente elevado endotelina-1/NO se correlacionan con mayor severidad de enfermedad cardiovascular (33).
Estrés oxidativo
El estrés oxidativo se define como el desequilibrio entre la producción de especies reactivas de oxígeno (ROS) y la capa- cidad antioxidante del sistema vascular para neutralizarlas. En condiciones fisiológicas, las ROS participan en la señali- zación celular; sin embargo, su producción excesiva resulta lesiva para lípidos, proteínas y ADN (34).
En el endotelio, las principales fuentes de ROS incluyen la NADPH oxidasa (activada por angiotensina II, LDL oxidada e hiperglucemia), la mitocondria (por disfunción de la cadena respiratoria), la xantina oxidasa y la eNOS desacoplada. Estas enzimas generan especies como el anión superóxido, peróxido de hidrógeno y radicales hidroxilo, los cuales dañan la estruc- tura y función endotelial (35).
La formación de peroxinitrito a partir de ON y superóxido, además de reducir la disponibilidad de ON, induce nitrosi- lación de proteínas y disfunción mitocondrial. Esta cascada molecular se asocia a condiciones como hipertensión, diabe- tes mellitus tipo 2, aterosclerosis y envejecimiento vascular (36–38).
Aunque los antioxidantes inespecíficos (como la vitamina C o E) han mostrado resultados limitados en ensayos clínicos, algunas estrategias farmacológicas, como el uso de estatinas, inhibidores del sistema renina-angiotensina y antioxidantes mitocondriales dirigidos (como MitoQ), han demostrado bene- ficios sobre la función endotelial (39).
Activación inflamatoria endotelial
El endotelio también participa activamente en la respues- ta inmunoinflamatoria vascular. En condiciones crónicas de activación, adopta un fenotipo proinflamatorio y proadhesivo, expresando moléculas como ICAM-1, VCAM-1, E-selectina y P-selectina, además de liberar citoquinas como IL-1b, IL-6, TNF-a e IL-10 [40].
Estas señales favorecen la adhesión y migración de mono- citos al espacio subendotelial, generando un microambiente inflamatorio persistente que contribuye al desarrollo de ate-
rosclerosis, disfunción microvascular e incluso inflamación sistémica en enfermedades metabólicas y autoinmunes (41).
Desde un punto de vista terapéutico, la restauración de la homeostasis inflamatoria del endotelio representa un objeti- vo clave. Fármacos como estatinas, inhibidores de SGLT2, y agentes biológicos como canakinumab (anti-IL-1b) han de- mostrado efectos beneficiosos en la reducción de la inflama- ción vascular (42).
Activación de vías procoagulantes
En estado de salud, el endotelio mantiene una superficie anticoagulante mediante la expresión de trombomodulina, prostaciclina, NO y la secreción de activadores de la fibri- nólisis. Sin embargo, en presencia de disfunción, se observa un cambio hacia un fenotipo procoagulante, con expresión de factor tisular, aumento de PAI-1, secreción de factor von Willebrand (vWF) y pérdida de trombomodulina (43).
Este cambio favorece la formación de trombos in situ y se asocia con eventos clínicos graves, como infarto agudo de mio- cardio, accidente cerebrovascular o fenómenos de microtrom- bosis en enfermedades inflamatorias como el COVID-19 (44).
Alteración estructural de uniones intercelulares y glicocálix
La integridad de las uniones intercelulares endoteliales, especialmente aquellas mediadas por VE-cadherina y ZO-1, es esencial para mantener la función de barrera y regular la permeabilidad vascular. Factores como la uremia, la angiotensina II, el estrés inflamatorio o la hiperglucemia inducen la disrupción de estas estructuras, favoreciendo la extravasación de solutos y células inflamatorias (45).
El glicocálix endotelial, una capa de proteoglicanos y glicoproteínas que recubre la superficie luminal de la célula endotelial, actúa de forma sinérgica con las uniones intercelulares. Su degradación no solo compromete la barrera vascular, sino
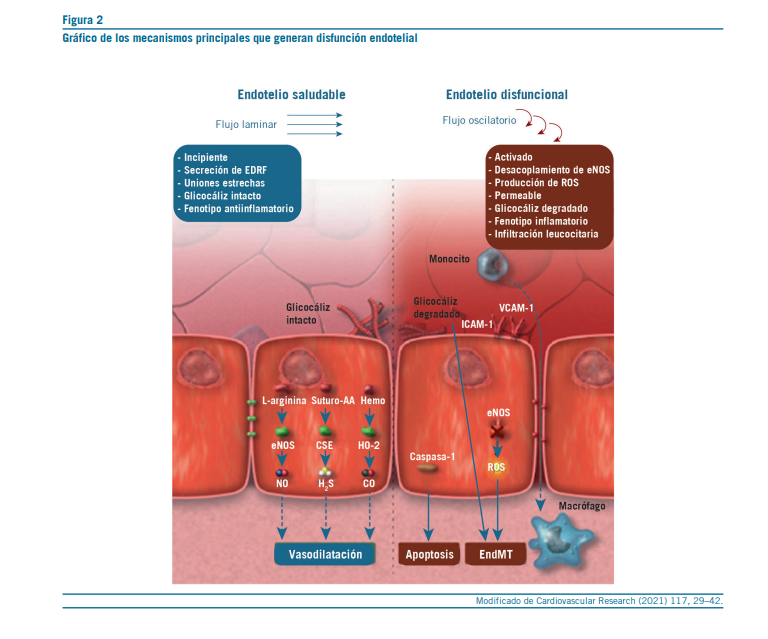
que exacerba el daño endotelial y se asocia con peor pronós- tico en enfermedades cardiovasculares, renales e infecciosas (46, 47).
Evaluación clínica de la disfunción endotelial
El estudio clínico de la función endotelial ha evolucionado en las últimas décadas desde una herramienta experimental hasta convertirse en un elemento potencialmente útil en la práctica cardiovascular preventiva y personalizada. La disfunción endotelial precede a la lesión vascular estructural y puede detectarse en estadios preclínicos, lo que permite una intervención temprana antes de que la enfermedad cardiovascular se manifieste clínicamente (48).
Desde una perspectiva clínica, su evaluación tiene tres implicancias clave: diagnóstica, terapéutica y pronóstica. En primer lugar, permite identificar a pacientes con riesgo vascular subyacente, incluso en ausencia de enfermedad manifiesta. En segundo lugar, facilita la selección de intervenciones dirigidas, como el uso de estatinas, inhibidores del sistema renina-angiotensina-aldosterona (SRAA), ejercicio físico o modificaciones dietéticas. Por último, aporta valor pronóstico: varios estudios han demostrado que la mejoría en la función endotelial se asocia con una reducción en la incidencia de eventos cardiovasculares mayores (49, 50).
Métodos disponibles para la evaluación clínica
Actualmente, existen distintas herramientas para valorar la función endotelial, que incluyen pruebas funcionales no invasivas, mediciones basadas en imágenes y biomarcadores circulantes.
Una de las técnicas más utilizadas es la dilatación mediada por flujo (FMD), que evalúa la respuesta vasodilatadora del endotelio frente a un estímulo de hiperemia reactiva. Se realiza generalmente en la arteria braquial, mediante ultrasonografía
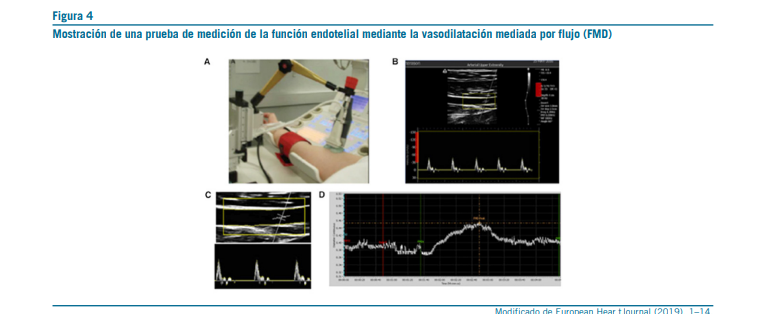
de alta resolución, y se considera un método sensible para de- tectar alteraciones subclínicas del endotelio en grandes vasos. Sin embargo, requiere personal entrenado y control estricto de variables fisiológicas (51).
Otra opción es la tonometría arterial periférica, particular- mente mediante dispositivos como el EndoPAT, que calculan el índice de hiperemia reactiva (RHI). Esta prueba es más senci- lla de aplicar y mide la respuesta microvascular en los dedos, lo cual refleja la función endotelial en la microcirculación. Si bien su correlación con los eventos clínicos es más variable, ha demostrado valor en poblaciones seleccionadas, como mu- jeres con angina sin obstrucciones coronarias o pacientes con insuficiencia cardíaca con fracción de eyección preservada (HFpEF) (52).
Por otro lado, los biomarcadores circulantes representan una herramienta complementaria, especialmente útil en contextos donde no se dispone de métodos funcionales. Entre los más estudiados se encuentran la ADMA (inhibidor endógeno de la eNOS), las micropartículas endoteliales, las moléculas de adhesión (VCAM-1, ICAM-1, E-selectina) y los niveles de nitri- tos/nitratos como reflejo de la producción de NO. Aunque aún se encuentran en proceso de validación clínica, estos marca- dores podrían integrarse a estrategias de Medicina personali- zada en el futuro cercano (53, 54).
Guías y consensos científicos
Diversas sociedades científicas han reconocido el valor de la función endotelial en la práctica cardiovascular. La Euro- pean Society of Cardiology (ESC), en colaboración con grupos de investigación en biología vascular, ha publicado recomen- daciones sobre la evaluación de la FMD como herramienta de investigación clínica, y sugiere su uso en la estratificación de riesgo individual, particularmente en pacientes con isquemia sin enfermedad coronaria obstructiva (INOCA) o HFpEF (55).
Asimismo, la American Heart Association (AHA) y el Ameri- can College of Cardiology (ACC) han incorporado el concepto de disfunción endotelial en sus guías recientes sobre enfer- medad coronaria crónica, recomendando considerar el uso de estatinas, aspirina e inhibidores del SRAA en pacientes con evidencia de disfunción microvascular, con el objetivo de me- jorar la perfusión y reducir el riesgo de eventos (56).
Un metaanálisis de más de 17.000 pacientes confirmó que una reducción en la FMD o en el índice RHI se asocia de for- ma independiente con un mayor riesgo de infarto, accidente cerebrovascular y mortalidad cardiovascular, consolidando así su valor pronóstico (50).
La evaluación de la función endotelial proporciona información valiosa sobre la salud vascular, anticipa el riesgo de eventos cardiovasculares y permite intervenir de forma temprana y dirigida. Su incorporación gradual en algoritmos clínicos refleja una medicina cada vez más centrada en la prevención y la personalización del tratamiento.
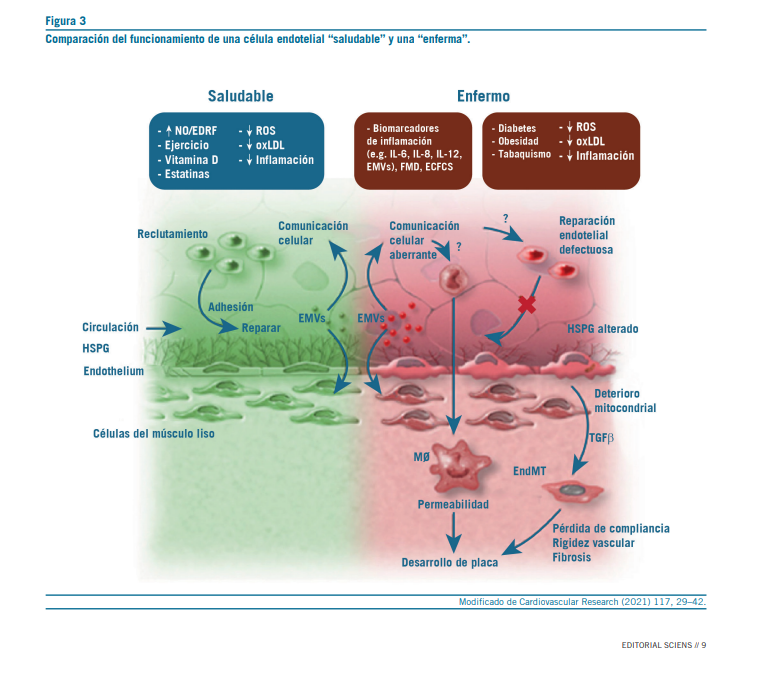
Biomarcadores circulantes de disfunción endotelial
En los últimos años, el interés por los biomarcadores endoteliales ha crecido significativamente, no solo como herramientas de diagnóstico precoz, sino también como predictores de riesgo cardiovascular y posibles guías terapéuticas en el marco de la medicina de precisión. A diferencia de las pruebas funcionales que evalúan la reactividad vascular en tiempo real, los biomarcadores ofrecen una visión bioquímica del estado del endotelio, reflejando procesos como activación, daño o alteraciones en la síntesis de óxido nítrico (NO) (57).
Aunque muchos de estos marcadores aún no han sido incor- porados de forma rutinaria en la práctica clínica, su validación progresiva en cohortes de riesgo podría consolidarlos como herramientas complementarias en la evaluación del riesgo vascular.
Biomarcadores de activación endotelial
La activación del endotelio es un fenómeno caracterizado por la expresión aumentada de moléculas de adhesión, que favorecen la interacción con leucocitos y plaquetas. Entre los biomarcadores más estudiados en este contexto se encuentran:
- VCAM-1 (molécula de adhesión celular vascular-1)
- ICAM-1 (molécula de adhesión intercelular-1)
- E-selectina
Estas moléculas son liberadas al plasma en respuesta a es- tímulos inflamatorios y hemodinámicos, y su elevación se ha asociado con la progresión de la aterosclerosis, la hipertensión arterial y la insuficiencia cardíaca (58). Además, pueden ac- tuar como indicadores de inflamación endotelial persistente, incluso en pacientes sin manifestaciones clínicas evidentes.
Biomarcadores de daño endotelial
El daño estructural del endotelio puede reflejarse en la pre- sencia de elementos celulares o subcelulares en circulación. Entre ellos, destacan:
- Células endoteliales circulantes (CEC): representan células maduras desprendidas de la monocapa endotelial, ge- neralmente en respuesta a injuria directa. Su conteo se ha propuesto como un indicador de daño agudo o crónico en enfermedades como la hipertensión severa, la vasculitis y la insuficiencia renal (59).
- Micropartículas endoteliales (EMP): vesículas extracelulares derivadas de células endoteliales activadas o apoptóticas. Se han identificado como marcadores sensibles de disfunción endotelial y microvascular, con implicancias en la aterogénesis, trombosis y disfunción orgánica múltiple (60).
La presencia de estos marcadores en sangre periférica ofrece una ventana hacia la biología endotelial en tiempo real y puede integrarse a perfiles de riesgo más amplios en el futuro.
Biomarcadores de síntesis y función endotelial
Los productos derivados de la actividad endotelial también son útiles para evaluar la capacidad funcional del endotelio. Los más destacados incluyen:
- Niveles plasmáticos de nitritos y nitratos (NOx): representan productos estables de la oxidación de NO. Su concentración se correlaciona inversamente con la presencia de disfunción endotelial y enfermedad coronaria, aunque pueden verse in- fluidos por factores dietarios y renales (61).
- Endotelina-1: potente vasoconstrictor producido por el endotelio, cuya elevación indica activación endotelial desequili- brada y se asocia a hipertensión pulmonar, insuficiencia car- díaca y enfermedad renal crónica.
- Trombomodulina: proteína endotelial con propiedades anticoagulantes; su liberación al plasma ocurre en situaciones de injuria endotelial, siendo útil como marcador de daño vascular difuso (62).
El cociente entre endotelina-1 y nitritos/nitratos ha sido propuesto como un índice funcional del tono vasomotor endo- telial, con potencial aplicación en estudios clínicos y evalua- ción terapéutica.
Marcadores emergentes en Medicina de Precisión
Con el avance de la genómica y la biología molecular, nue- vos biomarcadores endotelio-específicos están ganando pro- tagonismo, especialmente en el ámbito de la medicina per- sonalizada.
- MicroARNs (miRNAs): pequeñas moléculas no codifican-tes que regulan la expresión génica. Algunos miRNAs, como miR-34a, miR-126 o miR-342-3p, han demostrado estar implicados en la regulación de eNOS, la respuesta inflamatoria y la regeneración endotelial [63]. Su perfil circulante podría utilizarse como herramienta diagnóstica, pronóstica o incluso terapéutica.
- Proteómica y transcriptómica endotelial: tecnologías que permiten mapear la expresión de proteínas o ARN mensajeros en células endoteliales, incluso a partir de muestras periféricas. Estas aproximaciones permiten caracterizar fenotipos vasculares específicos, con implicancias en la selección de terapias dirigidas.
Aunque estas herramientas aún se encuentran en fases ex- perimentales o en investigación clínica, su integración en pla- taformas multiómicas podría revolucionar la forma de evaluar y tratar la disfunción endotelial en los próximos años.
Los biomarcadores circulantes representan una vía prometedora para mejorar la detección, monitorización y tratamiento de la disfunción endotelial. Su combinación con métodos funcionales y de imagen permitirá un abordaje más completo del riesgo cardiovascular individual.
Disfunción endotelial en enfermedades cardiovasculares
La disfunción endotelial ha sido reconocida como un mecanismo fisiopatológico transversal que participa en la génesis y progresión de múltiples enfermedades cardiovasculares. Su carácter temprano y potencialmente reversible la convierte en un marcador subclínico de daño vascular y, al mismo tiempo, en un blanco terapéutico relevante. Como ejemplo, se abordan tres patologías clave donde el papel del endotelio ha sido extensamente documentado: la aterosclerosis, la hipertensión arterial y la insuficiencia cardíaca con fracción de eyección preservada (HFpEF).
Aterosclerosis
La disfunción endotelial constituye uno de los primeros eventos en la cascada aterogénica. Una reducción en la bio- disponibilidad de óxido nítrico y el aumento de la expresión de moléculas de adhesión facilitan la adherencia de monocitos al endotelio, su migración al espacio subendotelial y la transformación en macrófagos cargados de lípidos. Este microambiente inflamatorio inicial se perpetúa a lo largo del tiempo, favoreciendo la formación de placas ateromatosas (64).
La exposición crónica a factores de riesgo como dislipidemia, tabaquismo o diabetes incrementa la producción de especies reactivas de oxígeno, lo cual potencia la oxidación de LDL y genera un círculo vicioso de inflamación, estrés oxidativo y daño vascular. Además, la disfunción endotelial se ha asociado a la progresión de la placa y a su vulnerabilidad, con riesgo de rotura y trombosis secundaria (65).
Desde el punto de vista clínico, se ha demostrado que la disfunción endotelial es un predictor independiente de even- tos cardiovasculares, incluso en pacientes sin obstrucciones coronarias significativas. Su evaluación permite una mejor es- tratificación del riesgo y puede guiar decisiones terapéuticas en la prevención primaria y secundaria (66).
Las estrategias terapéuticas dirigidas a mejorar la función endotelial incluyen el uso de estatinas, inhibidores de PCSK9, ezetimibe y modificaciones del estilo de vida. Estas intervenciones no solo reducen el colesterol LDL, sino que también disminuyen la inflamación vascular y mejoran la biodisponibilidad de ON (67).
Hipertensión arterial
En la hipertensión arterial esencial, la disfunción endote- lial se presenta en fases tempranas, incluso antes de que se establezca un aumento sostenido de la presión arterial. La reducción del tono vasodilatador mediado por ON, combinada con un incremento de vasoconstrictores como la endotelina-1 o la angiotensina II, altera la regulación del tono vascular y contribuye al aumento de la resistencia periférica (68).
Asimismo, la activación del sistema renina-angiotensina-al- dosterona induce inflamación vascular y estrés oxidativo, lo cual agrava el deterioro endotelial. Estos cambios se reflejan también a nivel estructural, con aumento de la rigidez arterial y pérdida de la elasticidad de grandes vasos, fenómenos que pueden medirse mediante índices como la velocidad de onda de pulso (VOP) o el índice de aumento(IAix) (69).
Intervenciones antihipertensivas como los inhibidores de la enzima convertidora de angiotensina (IECA), antagonistas de los receptores de angiotensina II (ARA-II) y bloqueadores de los canales de calcio han demostrado restaurar parcialmente la función endotelial. Su efecto vasoprotector parece exceder el simple control de la presión arterial, actuando también sobre mecanismos inflamatorios y redox (70).
Insuficiencia cardíaca con fracción de eyección preservada (HFpEF)
La HFpEF representa un fenotipo clínico de presentación clínica creciente, caracterizado por síntomas de insuficiencia cardíaca a pesar de una fracción de eyección preservada. En este contexto, la disfunción endotelial, en particular a nivel de la microcirculación, ha emergido como un componente cen- tral en su fisiopatología (71).
Diversos estudios han demostrado que los pacientes con HFpEF presentan inflamación vascular sistémica, aumento de la rigidez ventricular y fibrosis miocárdica, fenómenos en los cuales el endotelio desempeña un rol mediador. La activación inflamatoria crónica conduce a una menor perfusión tisular y disfunción diastólica progresiva (72).
Los biomarcadores endoteliales como ADMA, endotelina-1 y las micropartículas endoteliales se han propuesto como pre- dictores de progresión en este fenotipo. Además, las guías re- cientes destacan el beneficio potencial de fármacos como los inhibidores del cotransportador sodio-glucosa tipo 2 (SGLT2i), los inhibidores de neprilisina combinados con antagonistas de receptores de angiotensina (ARNI), y las estatinas, no solo por sus efectos metabólicos o hemodinámicos, sino también por su acción directa sobre la función endotelial (73, 74).
La identificación y corrección de la disfunción endotelial en estas entidades clínicas puede mejorar el pronóstico cardio- vascular, reducir la progresión de la enfermedad y optimizar la selección de terapias. Integrar el estudio del endotelio a la práctica clínica no solo amplía la comprensión fisiopatológica, sino que aporta herramientas concretas para una medicina cardiovascular más precisa y personalizada.
Conclusión
La disfunción endotelial se ha consolidado como un eje patogénico clave en la Medicina Cardiovascular contemporánea. Lejos de ser una alteración secundaria o colateral, constituye un fenómeno temprano, dinámico y multifactorial que anticipa el desarrollo de enfermedades como la aterosclerosis, la hipertensión arterial y la insuficiencia cardíaca con fracción de eyección preservada.
Su caracterización ha evolucionado desde modelos fisiológicos clásicos hacia una comprensión molecular más profunda, que incluye desequilibrios redox, activación inflamatoria, daño estructural y alteraciones epigenéticas. Esta complejidad, sin embargo, ha permitido también identificar nuevas oportunidades terapéuticas y predictivas, en línea con los principios de la Medicina personalizada.
Las técnicas clínicas de evaluación funcional, junto con la incorporación progresiva de biomarcadores circulantes y herramientas ómicas, brindan hoy un enfoque integral para detectar, monitorizar y tratar el daño endotelial. Intervenciones como las estatinas, los inhibidores del sistema renina-angiotensina, los SGLT2i, planes de alimentación adecuada y el ejercicio estructurado han demostrado beneficios concretos sobre la salud endotelial, independientemente de sus efectos hemodinámicos tradicionales.
Comprender al endotelio como un órgano dianablanco y no solo como un marcador del daño vascular amplía el horizonte terapéutico y mejora la estratificación del riesgocardiovascu- lar. Su estudio no solo permite anticiparse a la enfermedad, sino también guiar decisiones clínicas más eficaces y perso- nalizadas en la Prevención Cardiovascular del siglo XXI.
Conflicto de intereses
El autor declara que no existen conflictos de intereses rele- vantes con respecto al contenido de este artículo.
Declaración sobre el uso de inteligencia ar- tificial
Se utilizó inteligencia artificial como herramienta de apoyo en la redacción, edición y revisión lingüística del presente manuscrito. El contenido científico, la interpretación de los datos y las conclusiones reflejan exclusivamente el criterio del autor.
Referencias bibliográficas
- 1. Flammer AJ, Lüscher TF. Threedecades of endotheliumresearch: fromthedetection of nitric oxide to theeverydayimplementation of endothelialfunctionmeasu- rements. SwissMedWkly. 2010;140:w13122.
- 2. Godo S, Shimokawa H. Divergent roles of endothelialnitric oxide synthasessystem in maintaining cardiovascular homeostasis. Free RadicBiolMed.2017;109:4–10.
- 3. Poredos P, Poredoš AV, Gregoric I. Endothelialdysfunction and itsclinicalimplications. Angiology. 2021;72(7):604–15.
- 4. Shimabukuro M. L-Arginine, nitric oxide, and endothelialdysfunction in atherosclerotic cardiovascular disease. J AtherosclerThromb.2023;30:1311–12.
- 5. Tousoulis D, Kampoli AM, Tentolouris C, Papageorgiou N, Stefanadis C. The role of nitric oxide onendothelialfunction. CurrVascPharmacol. 2012;10(1):4–18.
- 6. EuropeanSociety of Cardiology. Endothelialdysfunction in COVID-19: a position paper of the ESC WorkingGroupforAtherosclerosis and Vascular Biology. Eur- Heart J. 2020.
- 7. Matsuzawa Y, Kwon TG, Lennon RJ, Lerman LO, Lerman A. Prognosticvalue of flow-mediatedvasodilation in brachial and fingertiparteries. J Am HeartAssoc. 2015;4(11):e002270.
- 8. Thijssen DHJ, Bruno RM, van Mil AC, et al. Expertconsensus and evidence-basedrecommendationsfortheassessment of flow-mediateddilation in humans. EurHeart J. 2019;40(30):2539–50.
- 9. Little PJ, Askew C, Xu S, Kamato D. Endothelialdysfunction and cardiovascular disease: history and analysis of theclinicalutility of therelationship. Biomedi- cines. 2021;9(7):699.
- 10. Pepine CJ. Clinicalimplications of endothelialdysfunction. ClinCardiol. 1998;21(11 Suppl 2):II-1–5.
- 11. Forgione MA, Leopold JA, Loscalzo J. Roles of endothelialdysfunction in coronaryarterydisease. CurrOpinCardiol. 2000;15(6):409–15.
- 12. Endemann DH, Schiffrin EL. Endothelialdysfunction. J Am SocNephrol. 2004;15(8):1983–92.
- 13. AHA/ACC. 2023 AHA/ACC GuidelinefortheEvaluation and Management of ChronicCoronaryDisease. J Am CollCardiol. 2023.
- 14. Gumanova N, Gorshkov AU, Klimushina M, Kots A. Associations of endothelialbiomarkers, nitric oxide metabolites and endothelin, withbloodpressure and coronarylesions. Horm Mol BiolClinInvestig. 2020;41(3).
- 15. Suri A, Singh R, Tyagi S, Bhattacharjee J. The role of endothelin-1 and nitric oxide in endothelialdysfunction in ischemicheartdisease. Int J ClinBiochem Res. 2018;5(4).
- 16. Apostolova N, Rocha M, Rovira-Llopis S, et al. Mitochondria-targetedantioxidants as a therapeuticstrategyforprotectingendothelium in cardiovascular diseases. CurrMedChem. 2014;21(25):2989–3006.
- 17. Dios S de, Sobey CG, Drummond GR. Oxidative stress and endothelialdysfunction. In: Handbook of Oxidants and Antioxidants in Exercise. Springer; 2010.
p. 37–64.
- 18. Gioscia-Ryan RA, LaRocca TJ, Sindler AL, et al. MitoQimprovesage-related vascular dysfunction. J Physiol.2014;592:2549–61.
- 19. Schulz E, Jansen T, Wenzel P, et al. Nitric oxide, oxidative stress and hypertension. AntioxidRedoxSignal. 2008;10(6):1115–26.
- 20. Shen G. Oxidative stress and diabetic cardiovascular disorders. Can J PhysiolPharmacol. 2010;88(3):241–48.
- 21. Kraiss LW. Endothelialdysfunction and vascular inflammation. J VascSurg. 2020;72(6):2110–20.
- 22. Muñoz-Vega M, et al. Exercise and endothelialinflammation. ClinInvestigArterioscler. 2020;32(6):260–68.
- 23. Ridker PM, et al. Anti-inflammatorytherapywithcanakinumab. N Engl J Med. 2017;377(12):1119–31.
- 24. Ortega-Paz L, Jiménez L, et al. Endothelialdysfunction and thrombosis. Int J Mol Sci. 2023;24(6):5473.
- 25. Sabbatinelli J, Graciotti L, et al. Endothelialdysfunction and thromboticrisk. Biomedicines. 2021;9(2):142.
- 26. Maciel TT, et al. Chronickidneydisease and junctionalproteinloss. Nephrol Dial Transplant. 2018;33(1):94–103.
- 27. Hellenthal FA, et al. Endothelialglycocalyxdisruption and cardiovascular disease. Cardiovasc Res. 2022;118(3):655–69.
- 28. Radeva MY, Waschke J. VE-cadherin and vascular permeability. CellTissue Res. 2018;371(3):437–56.
- 29. Flammer AJ, Anderson T, Celermajer DS, et al. Theassessment of endothelialfunction: fromresearchintoclinicalpractice. Circulation. 2012;126(6):753–67.
- 30. Ras RT, Streppel MT, Draijer R, Zock PL. Flow-mediateddilation and cardiovascular risk: a systematicreview and meta-analysis. Int J Cardiol. 2013;168(1):344–51.
- 31. Corretti MC, Anderson TJ, Benjamin EJ, et al. Guidelinesforultrasoundassessment of endothelial-dependentflow-mediatedvasodilation. J Am CollCardiol. 2002;39(2):257–65.
- 32. Kim SH, Park J. Validity and repeatability of a new reactive hyperemiaindex in endothelialfunction. J Hypertens. 2017;35(Suppl 1):e162.
- 33. Deanfield JE, Halcox JP, Rabelink TJ. Endothelialfunction and dysfunction. Circulation. 2007;115(10):1285–95.
- 34. De Caterina R, Libby P, Peng HB, et al. Endothelialdysfunction and leukocyteadhesionmolecules in atherosclerosis. J Am CollCardiol. 1997;29(7):1276–84.
- 35. Boos CJ, Lip GY. Elevatedcirculatingendothelialcells in cardiovascular diseases. J Am CollCardiol. 2006;48(8):1538–47.
- 36. Boulanger CM, Loyer X, Rautou PE, Amabile N. Extracellularvesicles in coronaryarterydisease. NatRevCardiol. 2017;14(5):259–72.
- 37. Esmon CT. Role of coagulationinhibitors in inflammation. ThrombHaemost. 2001;86(1):51–6.
- 38. Zhang Y, Wang Y, Wang X, et al. CirculatingendothelialmicroRNAs and cardiovascular disease. J Cell Mol Med. 2017;21(4):542–54.
- 39. Gimbrone MA Jr, García-Cardeña G. Endothelialcelldysfunction and thepathobiology of atherosclerosis. Circ Res. 2016;118(4):620–36.
- 40. Libby P. Inflammation in atherosclerosis. ArteriosclerThrombVasc Biol. 2012;32(9):2045–51.
- 41. Yeboah J, Crouse JR, Hsu FC, et al. Brachialflow-mediateddilationpredictsincident cardiovascular events. Circulation. 2007;115(18):2390–97.
- 42. Liao JK. Effects of statinson vascular function. ArteriosclerThrombVasc Biol. 2005;25(1):21–28.
- 43. Virdis A, Ghiadoni L, Taddei S. Endothelialdysfunction and vascular disease in hypertension. NatRevCardiol. 2010;7(9):527–36.
- 44. Laurent S, Cockcroft J, Van Bortel L, et al. Expertconsensuson arterial stiffness: methodologicalissues and clinicalapplications. EurHeart J. 2006;27(21):2588–605.
- 45. Napoli C, de Nigris F, Palinski W. Multiple role of reactive oxygenspecies in the arterial wall. J CellBiochem. 2001;82(4):674–82.
- 46. Paulus WJ, Tschöpe C. A novel paradigmforheartfailurewithpreservedejectionfraction. J Am CollCardiol. 2013;62(4):263–71.
- 47. Franssen C, Chen S, Unger A, et al. Myocardialmicrovascularinflammatoryendothelialactivation in HFpEF. J Am CollCardiol. 2016;68(18):2325–38.
- 48. Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomeswithempagliflozin in heartfailure. N Engl J Med. 2020;383(15):1413–24.
- 49. Solomon SD, McMurray JJV, Anand IS, et al. Angiotensin–neprilysininhibition in heartfailurewithpreservedejectionfraction. N Engl J Med. 2019;381(17):1609–20.
- 50. De Caterina R, Libby P, Peng HB, et al. Endothelialdysfunction and leukocyteadhesionmolecules in atherosclerosis. J Am CollCardiol. 1997;29(7):1276–84.
- 51. Boos CJ, Lip GY. Elevatedcirculatingendothelialcells in cardiovascular diseases. J Am CollCardiol. 2006;48(8):1538–47.
- 52. Boulanger CM, Loyer X, Rautou PE, Amabile N. Extracellularvesicles in coronaryarterydisease. NatRevCardiol. 2017;14(5):259–72.
- 53. Gumanova N, Gorshkov AU, Klimushina M, Kots A. Associations of endothelialbiomarkers and nitric oxide metabolites. Horm Mol BiolClinInvestig. 2020;41(3).
- 54. Esmon CT. Role of coagulationinhibitors in inflammation. ThrombHaemost. 2001;86(1):51–6.
- 55. Zhang Y, Wang Y, Wang X, et al. CirculatingendothelialmicroRNAs and cardiovascular disease. J Cell Mol Med. 2017;21(4):542–54.
- 56. Godo S, Suda A, Takahashi J, et al. Coronarymicrovasculardysfunction in patientswithmicrovascular angina: clinicalimplications. J Am CollCardiol. 2021;78(14):1323–38.
- 57. BaireyMerz CN, Pepine CJ, Walsh MN, Fleg JL. Ischemia and no obstructivecoronaryarterydisease (INOCA): developingevidence-basedtherapies and research agenda. EurHeart J. 2020;41(2):132–42.
- 58. Gimbrone MA Jr, García-Cardeña G. Endothelialcelldysfunction and thepathobiology of atherosclerosis. Circ Res. 2016;118(4):620–36.
- 59. Libby P. Inflammation in atherosclerosis. ArteriosclerThrombVasc Biol. 2012;32(9):2045–51.
- 60. Yeboah J, Crouse JR, Hsu FC, et al. Brachialflow-mediateddilationpredictsincident cardiovascular events. Circulation. 2007;115(18):2390–97.
- 61. Liao JK. Effects of statinson vascular function. ArteriosclerThrombVasc Biol. 2005;25(1):21–28.
- 62. Virdis A, Ghiadoni L, Taddei S. Endothelialdysfunction and vascular disease in hypertension. NatRevCardiol. 2010;7(9):527–36.
- 63. Laurent S, Cockcroft J, Van Bortel L, et al. Expertconsensuson arterial stiffness: methodologicalissues and clinicalapplications. EurHeart J. 2006;27(21):2588–605.
- 64. Napoli C, de Nigris F, Palinski W. Multiple role of reactive oxygenspecies in the arterial wall. J CellBiochem. 2001;82(4):674–82.
- 65. Paulus WJ, Tschöpe C. A novel paradigmforheartfailurewithpreservedejectionfraction. J Am CollCardiol. 2013;62(4):263–71.
- 66. Franssen C, Chen S, Unger A, et al. Myocardialmicrovascularinflammatoryendothelialactivation in HFpEF. J Am CollCardiol. 2016;68(18):2325–38.
- 67. Packer M, Anker SD, Butler J, et al. Cardiovascular and renal outcomeswithempagliflozin in heartfailure. N Engl J Med. 2020;383(15):1413–24.
- 68. Solomon SD, McMurray JJV, Anand IS, et al. Angiotensin–neprilysininhibition in heartfailurewithpreservedejectionfraction. N Engl J Med. 2019;381(17):1609–20.
- 69. Ridker PM, Everett BM, Thuren T, et al. Antiinflammatorytherapywithcanakinumabforatheroscleroticdisease. N Engl J Med. 2017;377(12):1119–31.
- 70. Santos-Gallego CG, Vargas-Delgado AP, Requena-Ibáñez JA, et al. Randomized trial of empagliflozin in nondiabeticpatientswithheartfailurewithpreservedejec- tionfraction. J Am CollCardiol. 2021;77(8):970–81.
- 71. Edsfeldt A, Gonçalves I. Nitric oxide in atherosclerosis: friendorfoe?Int J Mol Sci. 2021;22(22):12069.
- 72. Tousoulis D, Psarros C, Demosthenous M, et al. Endothelialdysfunction in conduitarteries and microcirculation: a pathophysiologicalapproach. Cardiovasc- Ther. 2012;30(5):e124–31.
- 73. Reriani MK, Lerman LO, Lerman A. Endothelialfunction as a functionalexpression of cardiovascular riskfactors. BiomarkMed. 2010;4(3):351–60.
- 74. Ghiadoni L, Taddei S, Virdis A. Endothelialfunction and hypertension. CurrOpinNephrolHypertens. 2012;21(3):256–61.







No comments! Be the first commenter?