La depresión postparto (DPP) es una entidad clínica habitual que afecta a 2 de cada 10 mujeres que se convierten en ma- dres. Constituye una patología con gran impacto en la Salud Pública. El tratamiento de las mujeres con diagnóstico de DPP se basa en un enfoque multidisciplinario (terapia psicológica, tratamiento psiquiátrico, apoyo grupal, entre otras estrategias). Actualmente los inhibidores selectivos de la recaptación de serotonina (ISRS) son los fármacos de primera elección para el tra- tamiento de la DPP moderada a severa. Por otro lado, hasta hace unos años, la DPP se encontraba huérfana de un tratamiento farmacológico específico. Sin embargo, desde el año 2019 se han aprobado un par de fármacos para el tratamiento específico de las mujeres que padecen de DPP moderada a severa basados en la modulación de la neurotransmisión GABAergica: brexa- nolona y zuranolona.
Palabras clave
Depresión – Posparto – Antidepresivos.
Mejías Delamano AM, Serra HA. “Actualización del tratamiento de la depresión postparto”. Psicofarmacología 2025;137:04-14x. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
La depresión postparto (DPP) es una entidad clínica habi- tual que afecta a 2 de cada 10 mujeres que se convierten en madres. Mas allá del impacto en la salud psíquica de la propia mujer, la DPP posee una serie de implicancias a nivel del re- cién nacido, su pareja o persona significativa que la acompa- ña, sus familiares y/o amigos cercanos. La DPP constituye una patología con gran impacto en la Salud Pública, no solo desde la perspectiva de la frecuencia poblacional sino también en términos de Salud Mental.
Desde la antigüedad es bien conocido que, durante los meses posteriores al parto, la mujer experimenta una mayor
vulnerabilidad psíquica y anímica (1). La DPP es una afec- ción clínica que se encuentra presente aproximadamente en el 20% de las mujeres, constituyendo la complicación más frecuente del parto (2, 3). La incidencia de DPP oscila entre el 7 y el 15% en los primeros 3 meses posparto, lo que su- giere que las mujeres en la etapa postparto presentan tasas de depresión similares a la población general (2). La tasa de prevalencia de DPP tiene un rango entre el 7 y el 13% en los países de elevados ingresos y una prevalencia mayor del 20% en aquellos países con bajos ingresos (4).
El factor de riesgo más fuerte de DPP es un episodio previo en otro embarazo, por lo cual se estima que entre el 25 y el 50%% de las mujeres presentaran una recurrencia de este
cuadro (5). La severidad de la depresión periparto es variable, siendo en algunos casos muy grave y requerir un tratamien- to intensivo debido a las potenciales consecuencias para la propia paciente, el recién nacido y su entorno familiar (1-3).
Embarazo y sus efectos fisiológicos
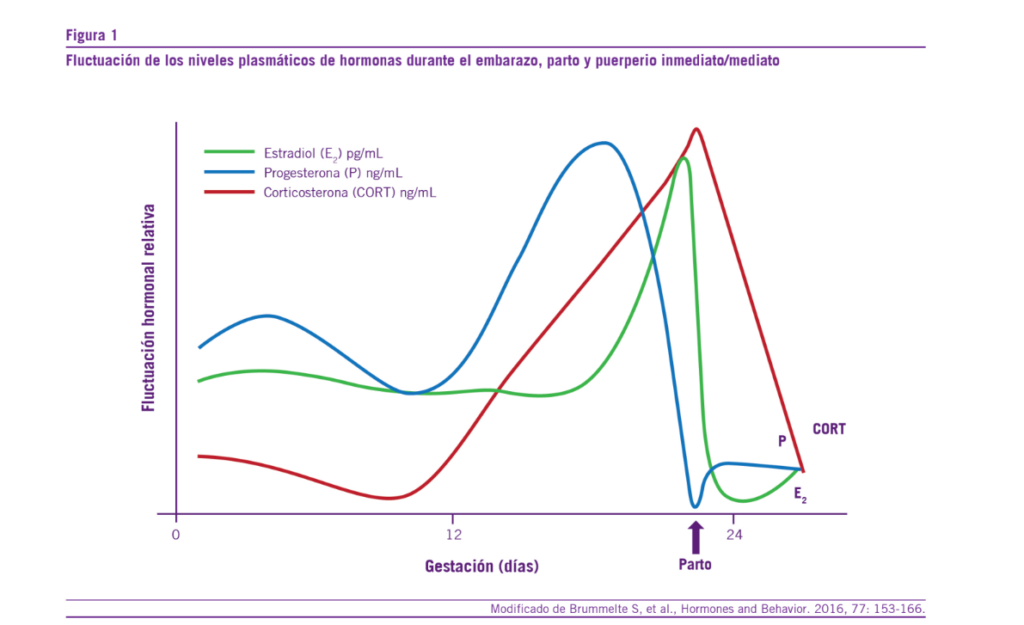
El embarazo es una etapa de grandes cambios en el cuerpo y la mente de la mujer, tiene una duración de 40 semanas, pero existe una gran variabilidad de la extensión que oscila entre las 38 y las 42 semanas (6, 7). Al principio, la mujer embarazada presenta varios síntomas producto de los cambios hormonales, tales como náuseas, vómitos, mareos, micción frecuente, amenorrea, sueño frecuente. Estos cambios son los que permitirán que se generen los procesos necesarios en el cuerpo de la mujer para gestar una nueva vida (6-9). Existe una serie de cambios hormonales en la mujer que abarcan tanto el embarazo como el parto y el puerperio inmediato y mediato. La figura 1 resume estos cambios plasmáticos hor- monales (principalmente estradiol, progesterona y cortisol) (10, 11) (Ver Figura 1).
El embarazo es una experiencia estresante, provocada por las variaciones corporales y anímicas de la mujer que impac- tan en su biología al alterarse sus hábitos, el ciclo sueño-vi- gilia y la percepción del mundo que la rodea. Todos estos cambios la hacen propensa a padecer estados de ansiedad,
cambios frecuentes de humor y ambivalencia afectiva. Esta si- tuación estará más acentuada en el primer y último trimestre del embarazo. Cabe destacar que la mujer embarazada puede tener diversas patologías, como anemia, disfunción tiroidea, diabetes gestacional, que en general suelen confundirse con la presencia de sintomatología depresiva (15).
Tratamiento psiquiátrico
El tratamiento de las mujeres con diagnóstico de depresión postparto se basa en un enfoque multidisciplinario (terapia psicológica, tratamiento psiquiátrico, apoyo grupal, etc.) te- niendo en cuenta la especificidad de la etapa perinatal. El objetivo principal del tratamiento, desde el punto de vista psiquiátrico, es mejorar el estado de ánimo de la mujer y mi- nimizar los riesgos para el embrión/feto (1-3). Una de las ne- cesidades a tener en cuenta en el tratamiento de la DPP es el mantenimiento del contacto de la madre con su bebé. Los enfoques terapéuticos a llevar cabo dependen de la severidad de la DPP:
- Depresión postparto leve a moderada: psicoterapia indivi- dual o grupal asociada o no con antidepresivos, terapia cog- nitivo-conductual (TCC), terapia interpersonal, psicoterapia psicodinámica, intervenciones psicosociales.
- Depresión postparto moderada a severa: antidepresivos asociada a psicoterapia.
Tratamiento farmacológico
El objetivo principal del tratamiento farmacológico es la remisión de los síntomas depresivos y la posterior prevención del episodio depresivo, con el fin de que la paciente retorne a los niveles de funcionamiento y calidad de vida previos. El tratamiento farmacológico de la DPP se compone de 2 fa- ses: la fase aguda y la de mantenimiento. La etapa aguda del tratamiento tiene una duración promedio de 12 semanas y depende de la severidad del cuadro clínico. La etapa de mantenimiento puede tener una duración de hasta 2 años, o incluso, más tiempo.
Se ha evidenciado que aquellas mujeres que padecen de depresión y abandonan su medicación antidepresiva cerca del momento de la concepción, presentan una mayor tasa de re- currencia de la sintomatología depresiva en comparación con las mujeres que continúan con el tratamiento antidepresivo. Asimismo, se ha observado en diversos estudios que las mu- jeres con un episodio depresivo cercano al embarazo o con antecedente de 4 o más episodios depresivos previos, poseen un mayor riesgo de presentar una recurrencia de la depresión durante el embarazo (4).
El tratamiento de base de la depresión postparto es la ad- ministración de fármacos antidepresivos. Es importante te- ner en cuenta que todos los antidepresivos se excretan en la leche materna, lo que no contraindica necesariamente su uso durante la lactancia materna. La elección del fármaco debe basarse, principalmente, en los antecedentes de res- puesta favorable durante el embarazo o episodios depresivos anteriores, el diagnóstico de la paciente (o fenotípico de la depresión) y sus comorbilidades. Si se inicia un tratamiento antidepresivo de novo (o sea en mujeres que nunca recibieron terapia antidepresiva anteriormente), es importante elegir un antidepresivo con perfil de uso más favorable durante la lac- tancia. Si hubiera que emplear un antidepresivo no seguro en la lactancia materna, existe siempre la opción de evitar la ex- posición del bebé no lactando. La dosis a utilizar deberá ser la más baja posible dentro del rango de dosis de cada fármaco, ya que las mujeres en el periodo postparto tienen un aumento de la sensibilidad a los efectos adversos de los fármacos. Una estrategia posible es el uso de las dosis más bajas durante los primeros 4 días para, posteriormente, titular a la mínima dosis efectiva (5-8).
Existen situaciones en las cuales las pacientes a pesar de
recibir tratamiento antidepresivo presentan recurrencia de su sintomatología depresiva. En ocasiones este hecho se debe a que la paciente está recibiendo dosis inadecuadas, ya que las concentraciones plasmáticas del antidepresivo son más bajas que las esperadas debido a los cambios farmacocinéticos que sufren los fármacos durante el embarazo (esto se ha obser- vado con el uso de sertralina, citalopram, fluoxetina, escita- lopram), por lo cual se requiere el ajuste de las dosis ante la presencia de síntomas tempranos de recaída de la depresión con el objetivo de evitar la recurrencia del cuadro (4).
Por otro lado, existe una frecuente percepción de elevado
riesgo con el uso de fármacos durante el embarazo, tanto en las propias mujeres como en los profesionales de la salud, en especial en el caso de los psicofármacos. Esto puede desen- cadenar en la decisión por parte de la mujer de interrumpir el tratamiento antidepresivo durante el embarazo, con las con- secuencias de la depresión no tratada (mencionadas más ade- lante en la Tabla) y la consecuente recaída de la enfermedad
(9). En el caso que la mujer embarazada decida suspender el tratamiento con fármacos antidepresivos, se debe realizar un monitoreo cercano para detectar en forma temprana la re- aparición de la sintomatología depresiva, teniendo un plan terapéutico consensuado con la paciente para llevar a cabo ante tal situación (4).
Actualmente los inhibidores selectivos de la recaptación de serotonina (ISRS) son los fármacos de primera elección para el tratamiento de la DPP moderada a severa, debido a su perfil de seguridad favorable y su seguridad relativa ante casos de sobredosis en comparación con los antidepresivos tricíclicos (ATC). La sertralina y el citalopram son los ISRS de primera elección para la depresión durante el embarazo y la lactancia. La sertralina se considera de elección en el caso de un inicio de un tratamiento de novo y durante la lactancia materna, debido a su menor pasaje a leche materna y la menor cantidad de efectos adversos que genera. La exposición del lactante parece ser mayor con fluoxetina (como consecuencia de su prolongada vida media de eliminación), por lo que debe uti- lizarse con precaución durante la lactancia y solamente en mujeres con historia de respuesta previa favorable al fármaco. La paroxetina pertenece actualmente a la categoría D en el embarazo de acuerdo con la clasificación de la FDA (Food and Drug Administration) debido a que aumenta entre 1,5 y 2 veces el riesgo de malformaciones cardiovasculares (defectos en la formación del septo ventricular). La dosis de 25 mg/día de paroxetina se ha asociado al desarrollo de efecto teratogé- nico. Sin embargo, la paroxetina tiene clasificación L2 con relación a su uso durante la lactancia materna, por lo que se considera una opción terapéutica adecuada en esta etapa (5, 7, 8, 10-13).
Otros grupos farmacológicos (antidepresivos duales como la venlafaxina y el modulador de la serotonina y noradrenalina mirtazapina) pueden ser usados cuando la madre alcanzó la remisión clínica con ellos en la etapa antenatal o en el caso que los ISRS de primera línea sean inefectivos o pobremente tolerados. Se ha observado que el uso de venlafaxina en el tercer trimestre del embarazo aumenta el riesgo de hemorra- gias y produce el incremento de la frecuencia de síntomas de mala adaptación perinatal. Con respecto a los ATC (amitripti- lina, imipramina, desipramina), son un grupo terapéutico de reconocido perfil de seguridad en el embarazo y la lactancia. En la tabla 1 se resume el perfil de seguridad de los diversos antidepresivos en el embarazo (clasificación de la FDA) y/o lactancia (3, 5, 8, 10-12, 15).
Las consecuencias de una DPP no tratada son diversas (2, 3, 6), como se resume en la tabla 2. Asimismo, es frecuen- te que las pacientes con DPP requieran de un mayor tiempo
para obtener una respuesta terapéutica y suelen recibir más frecuentemente politerapia en comparación con las mujeres con TDM no perinatal (17).
Guías de tratamiento
Con respecto a los ISRS, las directrices actuales coinci- den en evitar el uso de paroxetina durante el embarazo, ya que su utilización se asocia con mayor riesgo de malformacio- nes cardiovasculares congénitas en el recién nacido (21-23). Por este hecho la FDA oportunamente re-clasificó a esta droga como categoría D en el embarazo. Asimismo, la Guía ACOG (American College of Obstetricians and Gynecologists, EE. UU.)
recomienda un examen fetal por ecocardiografía en el caso de un antecedente de exposición a paroxetina durante las etapas tempranas del embarazo (23).
La mayoría de las guías puntualizan a la fluoxetina como un fármaco desfavorable para el tratamiento de la DPP de- bido a su prolongada vida media y su detección en la leche materna (21-24). Cabe destacar que solamente una guía de tratamiento (NHS de España) sugiere el uso de fluoxetina en la DPP (23).
La mayoría de las guías coinciden plenamente sobre el uso de sertralina durante el período posparto, principalmente por su perfil favorable durante la lactancia (21-24). Tanto la Guía CANMAT (Canadian Network for Mood and Anxiety Treatment,
![]()
Tabla 1
Perfil de seguridad de los antidepresivos en el embarazo y la lactancia
| Grupo terapéutico | Antidepresivo | Categoría en el embarazo (FDA) | Categoría de riesgo en lactancia |
| Antidepresivo tricíclico | Amitriptilina | B y C | L2 |
| Antidepresivo tricíclico | Desipramina | ||
| Antidepresivo tricíclico | Nortriptilina | ||
| IMAO-A | Clomipramina | ||
| Bloqueante de receptores alfa-adrenérgicos pre-sinápticos | Mianserina | ||
| ISRS | Sertralina | ||
| Modulador de la serotonina | Trazodona | ||
| Inhibidor de la recaptación de noradrenalina | Reboxetina | ||
| IRSN | Venlafaxina | L3 | |
| Modulador de la serotonina y noradrenalina | Mirtazapina | ||
| ISRS | Citalopram | ||
| Inhibidor de la recaptación de noradrenalina y dopamina | Bupropión | ||
| ISRS | Escitalopram | ||
| Fluoxetina | |||
| Paroxetina | D | L2 |
Categorías de riesgo en la lactancia: L1: el más seguro, L2: más seguro, L3: moderadamente seguro, L: posiblemente peligroso, L5: contraindicado
Categoría de riesgo en embarazo según FDA: ver Anexo 1
Modificado de Samochowiec J, et. al., Psychiatr Pol. 2019, 53: 245-262.
Canadá) como la guía danesa (2014) coinciden en considerar al citalopram como un fármaco de preferencia en el manejo de la DPP debido al mínimo riesgo en su uso durante la lac- tancia y su eficacia durante el período posparto (23). La guía escocesa SIGN (Scottish Intercollegiate Guidelines Network) recomienda el uso de los ISRS y antidepresivos tricíclicos en los casos de DPP moderada a severa, teniendo consideración adicional en la lactancia (grado de recomendación B) (23). Asimismo, esta guía desaconseja el uso de la terapia hor- monal (derivados de estrógenos y progestágenos), como así tampoco, la utilización de la hierba de San Juan (también conocida como ácido hipérico). En la tabla 3 se resumen las principales recomendaciones de las diferentes guías de trata- miento internacionales (21-23) (Ver Tabla 3).
Nuevos fármacos
Hasta hace unos años, la depresión postparto se encon- traba huérfana de un tratamiento farmacológico específico. Sin embargo, el día 19 de marzo del año 2019 se aprobó por parte de la FDA el primer fármaco para el tratamiento especí- fico de las mujeres que padecen de DPP moderada a severa: la brexanolona.
Brexanolona
Durante el proceso de investigación clínica, la brexanolona estuvo incluida en un programa de desarrollo farmacoclínico como una terapia de avanzada, ya que estaba enfocada en el tratamiento de una patología grave y en los estudios clínicos preliminares se habían observado resultados clínicos sustanciales en comparación con el tratamiento disponible hasta ese momento (tratamiento estándar). Este programa de desarrollo clínico de brexanolona fue avalado por FDA y fue el primero
específicamente para el tratamiento farmacológico de la DPP (30-32). Finalmente, luego de un proceso de evaluación de los resultados de los estudios clínicos, en marzo del año 2019 se aprobó su comercialización (30, 31). Por lo tanto, brexanolona constituyó la primera droga aprobada por la FDA especí- ficamente para el tratamiento de la DPP. Asimismo, constituye el primer neuroesteroide aprobado en la Neuropsiquiatría (39).
La brexanolona se encuentra incluida en un Programa de Mitigación de Riesgos (REMS en sus siglas en inglés, Risk Evaluation and Mitigation Strategies) debido al riesgo de de- sarrollo de sedación excesiva o repentina pérdida de la con- ciencia durante su administración (30-34). La paciente trata- da con brexanolona debe ser monitoreada permanentemente por medio de oximetría de pulso en un centro médico durante la infusión de la droga y se aconseja que esté acompañada por su hijo/a durante el tratamiento (30-33).
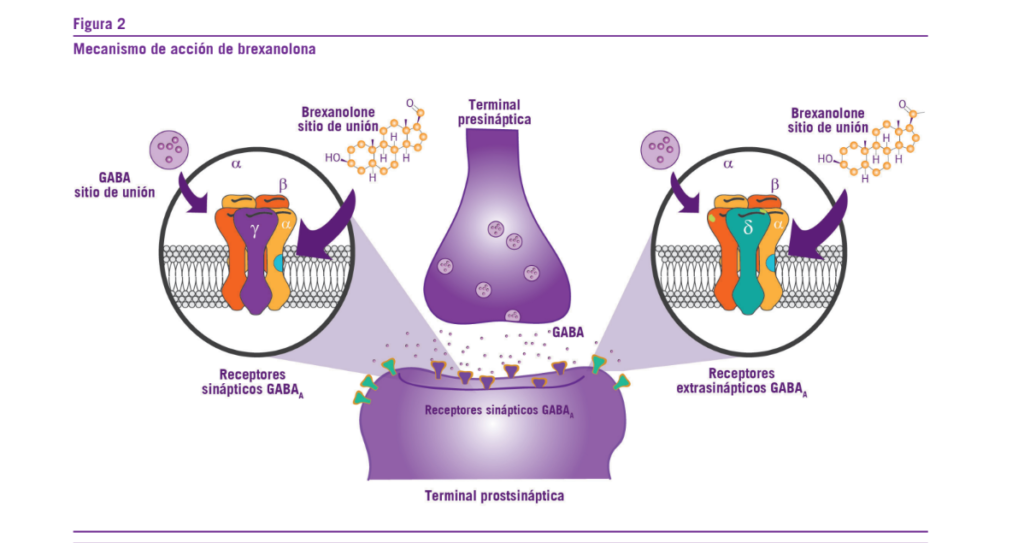
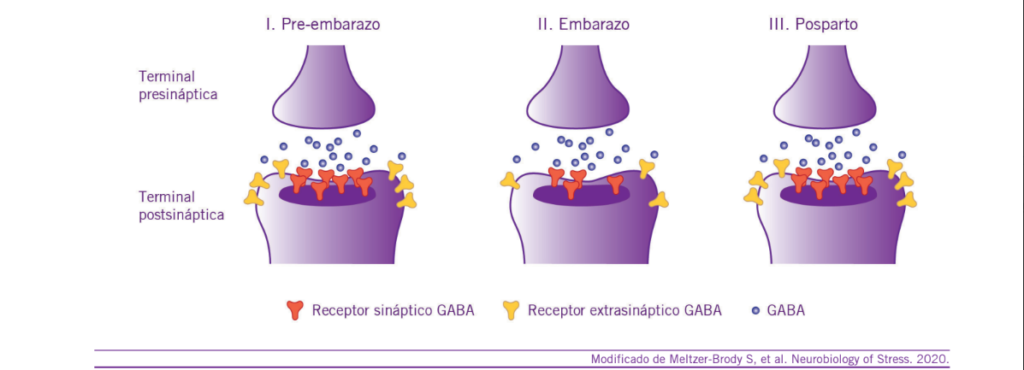
La brexanolona es un esteroide neuroactivo, de pequeño tamaño molecular y actúa como un modulador alostérico po- sitivo del receptor GABA-A sináptico y extra sináptico (30-35) (Ver Figura 2).
La brexanolona constituye una formulación sintética y solu- ble de la alopregnanolona, la cual posee baja solubilidad en agua, escasa biodisponibilidad oral y es rápidamente meta- bolizada. La alopregnanolona es una hormona cerebral y me- tabolito de la progesterona cuyas concentraciones aumentan rápidamente durante el embarazo, llegando a su pico máximo en el tercer trimestre de gestación. Es un neuroesteoide que se encuentra disminuido en el posparto, como así también, en diversos cuadros psiquiátricos tales como la depresión y ansiedad. Se considera a la reducción de los niveles de alo- pregnanolona como la principal causa fisiopatológica de la DPP. El estrés crónico y repetido genera una disminución sig-
Tabla 2
Consecuencias de la depresión postparto no tratada adecuadamente
| Alteraciones nutricionales por pérdida de apetito y desgano de la madre. |
| Pérdida de interés por los cuidados prenatales, descuido en el cumplimiento de indicaciones médicas. |
| Riesgo de abuso de sustancias (drogas psicoactivas, alcohol, tabaco) |
| Alteración del vínculo madre-hijo/a |
| Impacto en el desarrollo psicofísico del hijo/a (a nivel emocional, conductual y cognitivo) |
| Mayor incidencia de prematurez, bajo peso al nacer, bajos valores en la escala de Apgar, menor circunferencia cefálica. |
| Aumento del riesgo de depresión puerperal |
| Filicidio (20 al 30% de las mujeres que lo cometen tiene un episodio depresivo). |
| Muerte materna (21% de las muertes maternas ocurren durante un trastorno depresivo grave). |
nificativa de las concentraciones séricas de alopregnanolona. La alopregnanolona se sintetiza en el sistema nervioso central (SNC) y periférico, principalmente en las células gliales (as- trocitos, oligodendrocitos y células de Schwann) y diversas células neuronales progenitoras (34-38).
Cuando se encuentra en bajas concentraciones, la alopreg- nanolona actúa intensificando la acción del neurotransmisor
GABA sobre su receptor (alterando la frecuencia y duración de apertura del canal de cloro) y cuando se encuentra en altas concentraciones puede activar directamente el receptor GA- BA-A. Como consecuencia de la interacción con el receptor GABA, se incrementa la inhibición neuronal, con la conse- cuente acción ansiolítica y sedativa. En forma adicional, la alopregnanolona produce una potenciación de la liberación de
Tabla 3
Guías internacionales de tratamiento de la depresión durante el embarazo y postparto
| CANMAT | Canadá | 2016 | Sertralina, citalopram | Paroxetina, fluoxetina |
| Danesa | Dinamarca | 2014 | Sertralina, citalopram | Paroxetina, fluoxetina |
| VA/DoD | EE.UU. | 2016 | Sertralina | Paroxetina, fluoxetina |
| APA | EE.UU. | 2010 | – | Paroxetina |
| ACOG | EE.UU. | 2008 | – | Paroxetina |
| RANZCP | Australia y Nueva Zelanda | 2015 | – | Paroxetina, fluoxetina, venlafaxina |
| DGPPN | Alemania | 2017 | – | Paroxetina, fluoxetina |
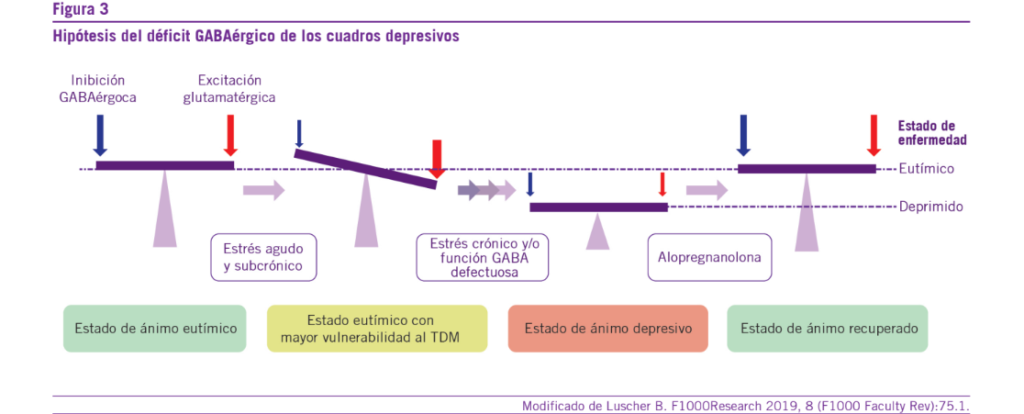
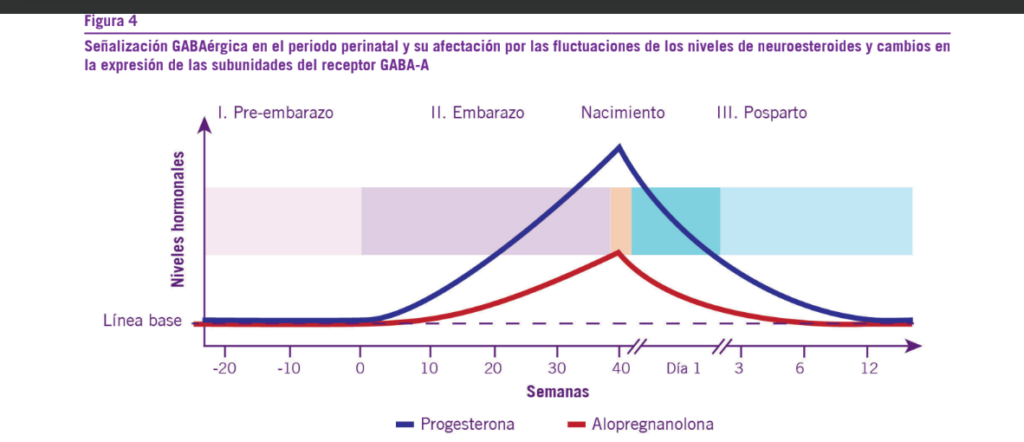
dopamina (DA) que intensifica los sentimientos de placer y re- compensa en los sujetos (30, 31, 34-38) (Ver Figuras 3 y 4).
La alopregnanolona es un potente modulador alostérico del receptor GABA-A con diversos efectos adicionales:
- Potenciación de la neurogénesis
- Favorece la mielinización
- Promueve la neuroprotección/neurotrofismo
- Reduce la muerte celular
- Efectos sobre el eje hipotálamo-hipófiso-adrenal (HHA)
La administración de brexanolona se realiza por vía parente- ral a través de una infusión continua durante 60 horas (apro- ximadamente 2 días y medio). La dosis se calcula de acuerdo con el peso corporal de la paciente, siendo la dosis máxima de 90 µg/kg/hora (incluyendo la titulación y descenso posterior de la dosis) (30-32). La dosis endovenosa alcanza las concen- traciones plasmáticas de alopregnanolona, acercándose a los valores séricos endógenos del final del embarazo. Las concen- traciones de alopregnanolona se detectan en la leche materna de las pacientes que se encuentran recibiendo brexanolona, siguiendo en forma cercana sus concentraciones plasmáticas y declinan en forma rápida cuando finaliza la infusión de 60 horas, siendo las concentraciones totalmente indetectables luego de 3 días de suspendida la administración de la droga. No se ha evidenciado la acumulación de alopregnanolona en plasma o leche materna luego del tratamiento con brexanolo- na (36, 40, 41).
Con respecto a su farmacocinética, la brexanolona después
de su administración parenteral presenta una elevada unión a proteínas plasmáticas (99%) con una vida media de elimi- nación de 9 horas. Tiene un volumen de distribución de 3 L/ kg, lo cual sugiere una amplia distribución en los tejidos. Se metaboliza a nivel extrahepático por medio de vías no relacio- nadas al citocromo P450 (principalmente a través de cetore- ducción, glucuronidación y sulfatación). Por lo anteriormente mencionado, no se requiere ajuste de la dosis de brexanolona en caso de alteración de la función hepática normal. La ex- creción de brexanolona se realiza por heces (47%) y orina (42%). La brexanolona pasa a leche materna, sin embargo, es muy baja la exposición del infante a este fármaco. Luego de 36 horas de finalizada la infusión de la droga, se han encon- trado concentraciones menores a 10 ng/ml del fármaco. Esto sugiere que la máxima dosis relativa al infante fue del 1 al 2% durante la infusión de brexanolona. Sumado a esto, la base de datos denominada Drugs and Lactation Database (Lact- Med) recomienda lo siguiente: “debido a la baja cantidad de brexanolona en la leche materna y su baja biodisponibilidad, no se debería esperar que este fármaco genere algún efecto adverso en infantes que amamantan” (40, 41). Sin embargo, los efectos de cualquier dosis de brexanolona sobre el infante son desconocidos (30, 32, 42-44).
La brexanolona se caracteriza por su marcada rapidez de acción, muy superior a los antidepresivos convencionales actualmente comercializados (ISRS, antidepresivos duales, antidepresivos tricíclicos, antidepresivos multimodales) los cuales tienen una latencia de acción terapéutica (entre 4 a 6 semanas) junto con bajas tasas de remisión sintomática. En
diversos estudios clínicos se observó que a las 24 horas de la administración de brexanolona las pacientes presentaban una significativa mejoría de la sintomatología depresiva Esta mejoría sintomática se sostenía, inclusive, hasta el séptimo día post-administración del fármaco. Esta rapidez de acción antidepresiva de la brexanolona favorece la recuperación en breve tiempo de las pacientes depresivas, reduciendo el riesgo de autolesiones y el riesgo para el propio bebé, como con- secuencia de la falta de atención o interacción/cuidados por parte de la madre (42-44).
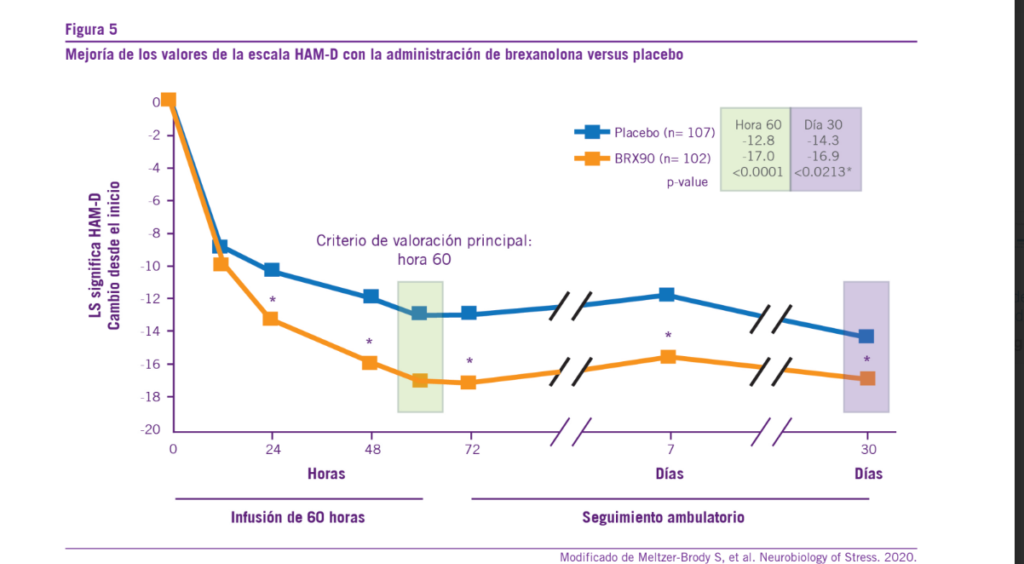
También se ha evidenciado una significativa disminución de la sintomatología depresiva en pacientes con DPP con la administración de 90 µg/kg/h de brexanolona, más allá del antidepresivo utilizado hasta ese momento (sertralina, bupro- pión). Esta mejoría sintomática se reflejaba en una reducción significativa (p=0.028) a las 60 horas de infusión de brexa- nolona en los valores de la escala HAM (Escala de Depre- sión y Ansiedad de Hamilton). El efecto terapéutico sostenido (durante al menos 1 mes posterior a la única administración endovenosa) es una arista que le brinda a esta molécula una importancia destacada dentro del arsenal terapéutico actual de la depresión postparto (42-44).
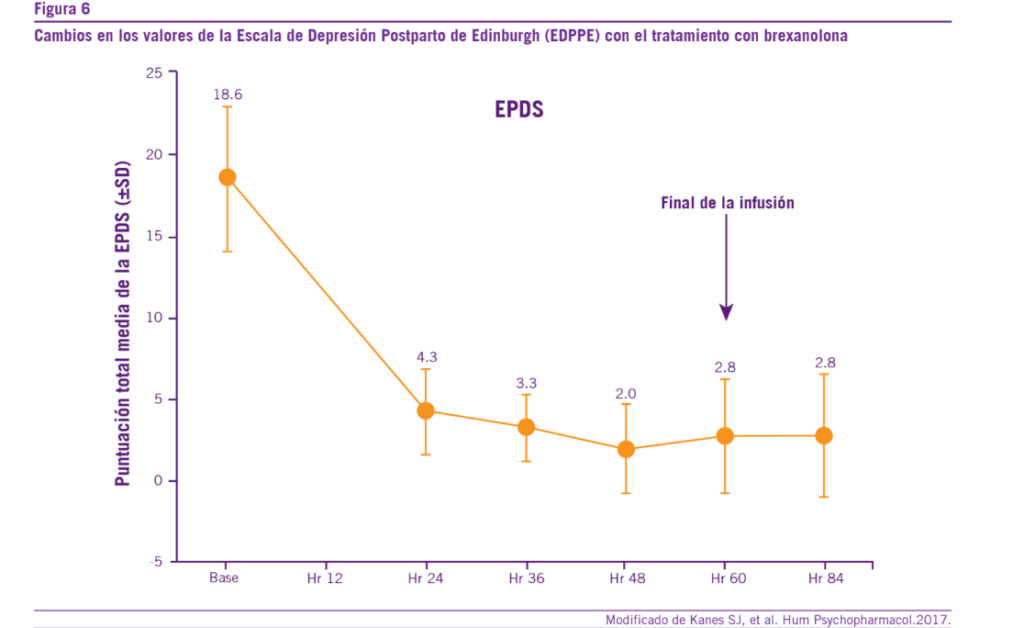
Otro estudio clínico evaluó la eficacia y seguridad de la brexanolona en mujeres con DPP severa. Se observó una mejo- ría de la sintomatología depresiva en forma rápida y sostenida
determinada por medio de diversas escalas (HAM-D, EDPPE, GAD-7) (30). Los valores de todas las escalas disminuyeron luego del inicio de la terapia con brexanolona y permanecieron bajas a través de todo el período de administración del fárma- co hasta el final de su infusión (a las 60 horas). Asimismo, al obtenerse una reducción menor de 7 puntos en la escala HAM-D, se logró la remisión sintomática de las pacientes (30) (Ver Figura 6).
Dentro de los efectos adversos más frecuentes (mayor al 10%) que se observan con el tratamiento con brexanolona se incluyen: cefalea, mareos, somnolencia/sedación, xerostomía, sofocos. En los casos de pacientes que presentaron pérdida de la conciencia en los estudios clínicos, se recuperaron com- pletamente entre los 15 y 60 minutos de la interrupción de la administración de la dosis del fármaco. En los casos de las pa- cientes que presentan un empeoramiento de la sintomatolo- gía depresiva o incluso desarrollan ideación o comportamiento suicida se debe considerar la suspensión de la administración de la droga en forma completa. Cabe destacar que, aunque se administre a casi el doble de la mayor dosis recomendada (90 µg/kg/día), brexanolona genera un aumento mínimo del intervalo QTc (30, 32).
Zuranolona
Recientemente, la FDA aprobó la zuranolona (más específi- camente el 4 de agosto de 2023), convirtiéndola en el primer
tratamiento oral específico para el tratamiento de la depresión posparto (45, 46). La eficacia de la zuranolona se demostró en estudios aleatorizados, doble ciego, controlados con pla- cebo en los cuales las participantes recibieron el fármaco du- rante 14 días y mostraron una reducción significativa de los síntomas depresivos en tan solo 3 días de administración de la droga (47, 49-51). Una de las diferencias más significati- vas con respecto a la brexanolona es que su administración es por vía oral en 1 sola toma diaria (en comparación a la infu- sión parenteral de la brexanolona). Esto le agrega un aspecto de practicidad y autonomía a la paciente en relación con su tratamiento (46, 51).
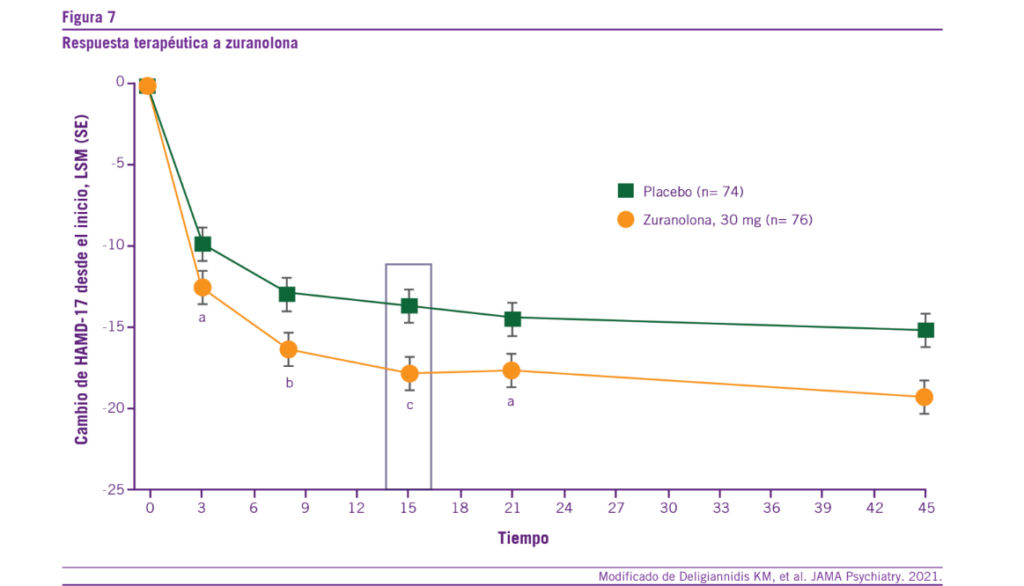
La zuranolona también actúa como un modulador alostérico positivo de los receptores GABA-A. Presenta un perfil farma- cocinético y de metabolismo mejorado en comparación con la brexanolona (menor clearance con la consecuente mayor biodisponibilidad por vía oral, que permite una administra- ción más cómoda) (46-48). En diversos trabajos científicos, zuranolona demostró mejorar significativamente los síntomas depresivos en las mujeres que presentaban DPP. Cabe desta- car su rapidez de acción terapéutica y su efecto terapéutico sostenida hasta los 45 días del comienzo del tratamiento far- macológico (Ver Figura 7) (47).
Con respecto a sus características farmacocinéticas, la zu- ranolona se administra por vía oral durante 14 días con una
buena absorción, lo que permite alcanzar concentraciones te- rapéuticas adecuadas en el plasma. Se une en gran medida a las proteínas plasmáticas y tiene un volumen de distribución amplio, lo que indica que se distribuye bien en los tejidos del cuerpo. La zuranolona es metabolizada principalmente en el hígado por enzimas del citocromo P450 con la producción de varios metabolitos activos e inactivos, que también pueden contribuir a su efecto terapéutico. La vida media de elimi- nación es relativamente corta, lo que permite un régimen de dosificación diario. Se excreta principalmente a través de la orina, tanto en forma de metabolitos como de fármaco inalte- rado (48, 51).
La aprobación de la zuranolona representa un avance sig- nificativo en el tratamiento de la DPP, proporcionando una segunda opción terapéutica más rápida y menos invasiva que la brexanolona para las mujeres que transitan esta condición clínica en el contexto de un tratamiento ambulatorio.
En resumen, existe guías de tratamiento que permiten orientar el tratamiento de las mujeres con diagnóstico de DPP, especialmente aquellas con una intensidad sintomatológica moderada a severa. Al mismo tiempo, los últimos 5 años se han incorporado al arsenal terapéutico nuevas moléculas mo- duladoras del receptor GABA-A especificas para esta entidad clínica que permiten una mejoría sintomática rápida y eficaz, pero que hasta el día de la fecha no se encuentran disponibles en la mayoría de los mercados farmacéuticos mundiales.
Referencias bibliográficas
- 1. Jadresic Enrique. Depresión perinatal: detec- ción y tratamiento. Rev Med Clin Condes. 2014, 25(6): 1019-1028.
- 2. Stewart Donna and Vigod Simone. Postpartum depression: pathophysiology, treatment and emer- ging therapeutics. Annual Review of Medicine. 2019, 70: 183-196.
- 3. Stewart DE, Vigod S. Postpartum depression.
N. Engl. J. Med. 2016, 37:2177–86.
- 4. Cauli G, Iapichino E, Rucci P, et al. Promoting the well-being of mothers with multidisciplinary psy- chosocial interventions in the perinatal period. Jour- nal of Affective Disorders. 2019, 246: 148-156.
- 5. Hirst Kathryn & Moutier Christine. Postpartum major depression. Am Fam Physician. 2010, 82(8): 926-933.
- 6. Carvajal Jorge y Ralph Constanza. Manual de Obstetricia y Ginecología. Escuela de Medicina. Fa- cultad de Medicina. Pontificia Universidad Católica de Chile. 9° Edición, año 2018. Capítulo 3: Cam- bios fisiológicos del embarazo y placentación.
- 7. Alcolea Flores Silvia, Mohamed Mohamed Dina. Guía de cuidados en el embarazo Consejos de su ma- trona. Hospital Universitario de Ceuta. Instituto Nacio- nal de Gestión Sanitaria. Madrid, España. Año 2011.
- 8. Brummelte S, Galea L. Postpartum depression: etiology, treatment and consequences for maternal care. Hormones and Behavior. 2016, 77: 153-166.
- 9. Hacker and Moore´s Essential of Obstetrics and Gynecology. Hacker Neville, Gambone Joseph and Hobel Calvin. Elsevier. Sixth Edition. 2016.
- 10. Sharma Verinder and Sharma Priya. Postpar- tum and depression: diagnostic and treatment is- sues. J Obstet Gynaecol Can. 2012, 34: 436-442.
- 11. Garcia-Esteve Lluisa, Valdés Miyar Manuel. Manual de Psiquiatría Perinatal. Guía para el mane- jo de los trastornos mentales durante el embarazo, posparto y lactancia. Editorial Médica Panamerica- na. 2017.
- 12. Mesches G, Wisner K, Betcher H, et al. A Common Clinical Conundrum: Antidepressant Treatment of Depression in Pregnant Women. Se- minars in Perinatology. 2020, doi.org/10.1016/j. semperi.2020.151229.
- 13. Hirst Kathryn & Moutier Christine. Postpartum major depression. Am Fam Physician. 2010, 82(8): 926-933.
- 14. Jufe Gabriela, Wikinski Silvia. El tratamiento farmacológico en Psiquiatría. Indicaciones, esque- mas terapéuticos y elementos para su aplicación ra- cional. Editorial Médica Panamericana. 2° edición, año 2013.
- 15. Fischer Fumeaux C, Morisod Harari M, Weiss- kopf E, et al. Risk-benefit balance assessment of SSRI antidepressant use during pregnancy and lac- tation based on best available evidence – an up- date. Expert Opinion on Drug Safety. 2019, DOI: 10.1080/14740338.2019.1658740.
- 16. Vitale S, Laganá A, Muscatello MR, et al. Psychopharmacotherapy in pregnancy and breastfe- eding. Obstetrical and Gynecological Survey. 2016, 71(12): 721-733.
- 17. Halsband S, Lorenzo L y Vázquez G. Actuali- zación clínica y psicofarmacológica de los trastornos depresivos, los trastornos bipolares y la depresión perinatal. Editorial Polemos. 1ra edición, año 2019. Capítulo 3: Depresión Perinatal: clínica y tratamiento.
- 18. Stewart DE, Vigod S. Postpartum depression.
N. Engl. J. Med. 2016, 37:2177–86.
- 19. Stewart Donna and Vigod Simone. Postpar- tum depression: pathophysiology, treatment and
emerging therapeutics. Annual Review of Medicine. 2019, 70: 183-196.
- 20. Appiani Francisco. Psicofármacos, embarazo y lactancia. Uso y seguridad. Librería AKADIA Edi- torial. Segunda edición. Año 2016.
- 21. Hallberg P, Sjoblom V. The use of selective serotonin reuptake inhibitors during pregnancy and breastfeeding: A review and clinical aspects. J Clin Psychopharmacol. 2005, 25: 59-73.
- 22. Sun Y, Werenberg Dreier J, Liu X, et al. Trend of antidepressants before, during, and after preg- nancy across two decades – A population-based study. Brain and Behavior. 2019; 9:e01441.
- 23. Samochowiec J, Rybakowski J, Galecki P, et al. Recommendations of the Polish Psychiatric Association for the treatment of affective disorders in women of childbearing age. Part I: treatment of depression. Psychiatr Pol. 2019, 53: 245-262.
- 24. Cox E, Sowa N, Meltzer-Brody S, et al. The Perinatal Depression Treatment Cascade: Baby Steps Toward Improving Outcomes. J Clin Psychia- try. 2016, 77(9): 1189-1200.
- 25. Molenaar N, Kamperman AM et al. Guidelines on treatment of perinatal depression with antide- pressants: an international review. Australian & New Zealand Journal of Psychiatry. 2018, 52: 320-27.
- 26. Sriraman N, Melvin K, Meltzer-Brody S, et al. ABM Clinical Protocol 18. Use of antidepressants in breastfeeding mothers. Breastfeeding Medicine. 2015, 10(6): 290-299.
- 27. Yonkers K, Wisner K, Stewart D, et al. The ma- nagement of depression during pregnancy: a report from the American Psychiatric Association and the American College of Obstetricians and Gynecolo- gists. Gen Hosp Psychiatry. 2009, 31(5): 403-413.
- 28. O´Hara Michael and Engeldinger Jane. Treat- ment of Postpartum Depression: recommendations for the Clinician. Clinical Obstetric and Gynecology. 2018, 61(3): 604-614.
- 29. SIGN 127. Management of Perinatal Mood Di- sorders. Scottish Intercollegiate Guidelines Network (SIGN). 2012
- 30. Kanes S, Colquhoun H, Gunduz-Bruce H, et al. Brexanolone (SAGE-547 injection) in postpar- tum depression: a randomised controlled trial. Lan- cet. 2017, 390: P480-89.
- 31. Scott Lesley. Brexanolone: First global appro- val. Drugs. 2019, doi.org/10.1007/s40265-019- 01121-0.
- 32. Wisner K, Stika C, Ciolino J. The first Food and Drug Administration-indicated drug for pos- tpartum depression – Brexanolone. JAMA Psychia- try. 2019, june 26. doi: 10.10001/jamapsychia- try.2029.1546.
- 33. Wilkinson ST, Sanacora G. A new generation of antidepressants: an update on the pharmaceuti- cal pipeline for novel and rapid-acting therapeutics in mood disorders based on glutamate/GABA neu- rotransmitter systems. Drug Discov Today. 2019, 24(2): 606-615.
- 34. Luscher Bernhard and Mohler Hanns. Brexa- nolone, a neurosteroid antidepressant, vindicates the GABAergic déficit hypothesis of depression and may foster resilience. F1000Research 2019, 8 (F1000 Faculty Rev):75.1
- 35. McEvoy K, Osborne LM. Allopregnanolone and reproductive psychiatry: an overview. International Review of Psychiatry. 2019, DOI:10.1080/095402 61.2018.1553775.
- 36. Pluchino N, Ansaldi Y, Genazzani A. Brain intracraniology of allopregnanolone during preg- nancy and hormonal contraception. Hormone Mo- lecular Biology and Clinical Investigation. 2019,
20180032: 1-6.
- 37. Frieder A, Fersh M, Hainline R, et al. Phar- macotherapy of Postpartum Depression: Current Approaches and Novel Drug Development.CNS Drugs. 2019, 33(3):265-282.
- 38. Meltzer-Brody S, Kanes SJ, Allopregnanolone in Postpartum Depression: Role in Pathophysiology and Treatment. Neurobiology of Stress. 2020, doi. org/10.1016/j.ynstr.2020.100212.
- 39. Powell J, Garland S, Preston K, et al. Brexano- lone (Zulresso): Finally, an FDA-Approved treatment for Postpartum Depression. Annals of Pharmacothe- rapy. 2020, 54(2): 157-163.
- 40. Hoffman E, Wald J, Colquhoun H. Evaluation of breast milk concentrations following brexanolone IV administration to healthy lactating women. Ame- rican Journal of Obstetrics and Gynecology. 2019, S556: poster 850.
- 41. US National Library of Medicine. Toxicolo- gy data network. Brexanolone. Link: https://toxnet. nlm.nih.gov/cgi-bin/sis/search2. Accessed April 15, 2019.
- 42. Clemson C, Meltzer-Brody S, Colquhoun H, et al. Brexanolone IV efficacy in postpartum depression in three pivotal trials: montgomery-asberg depression rating scale assessment. American Journal of Obste- trics and Gynecology. 2019, S69: Poster 86.
- 43. Meltzer-Brody S, Colquhoun H, Riesenberg R, et al. Efficacy of brexanolone injection in subjects with postpartum depression with and without base- line antidepressant therapy: insights from an inte- grated analysis of three trials. Biological Psychiatry. 2019, 85: S130-S379. Poster F73.
- 44. Kanes SJ, Colquhoun H, Doherty J, et al. Open-label, proof-of-concept study of brexanolone in the treatment of severe postpartum depression. Hum Psychopharmacol. 2017, 32: doi: 10.1002/ hup.2576.
- 45. Ragguett RM, Tamura JK, McIntyre RS. Kee- ping up with the clinical advances: depression. CNS Spectrum. 2019, 28: 1-9.
- 46. Barnes KN, Vogl CM, Nelson LA. Zuranolone: The First FDA-Approved Oral Treatment Option for Postpartum Depression. Annals of Pharmacothera- py. 2024, 58: 728-734.
- 47. Mehta R, Bhandari R, Kuhad A, et al. Zurano- lone. GABA-A receptor positive allosteric modulator, Treatment of major depressive disorder, Treatment of postpartum depression. Drugs of the Future. 2019, 44: 443.
- 48. Althaus AL, Ackley MA, Belfort GM, et al. Pre- clinical characterization of zuranolone (SAGE-217), a selective neuroactive steroid GABAA receptor positive allosteric modulator. Neuropharmacology. 2020, 181: 108333.
- 49. Deligiannidis KM, Meltzer-Brody S, Gun- duz-Bruce H, et al. Effect of Zuranolone vs Placebo in Postpartum Depression: A Randomized Clinical Trial. JAMA Psychiatry. 2021, 78: 951-959.
- 50. Marecki R, Kaluska J, Kolanek A, et al. Zu- ranolone – synthetic neurosteroid in treatment of mental disorders: narrative review. Front Psychia- try. 2023 Dec 5;14:1298359. doi: 10.3389/ fpsyt.2023.1298359.
- 51. Abdulqadir J. Nashwan, Syeda Tayyaba Re- han, Laiba Imran, et al. Exploring the clinical po- tentials of zuranolone in managing postpartum depression: A new therapeutic horizon, Progress in Neuro-Psychopharmacology and Biological Psychia- try, 2024, 132,110983.







No comments! Be the first commenter?