Microbiota intestinal y alergia a la proteína de leche de vaca
Resumen
La microbiota es el conjunto de microorganismos que coloniza nuestro cuerpo. En particular, la microbiota intestinal es la más diversa y abundante, albergando el colon más de 100 trillones (1014) de células microbianas que representan alrededor de 1.000 especies diferentes. Estos microorganismos llevan a cabo numerosas funciones para el ser humano, entre ellas la modulación de la respuesta inmune, incluyendo la tolerancia oral a los alimentos.
El término disbiosis hace referencia a alteraciones o desequilibrios de un sistema microbiano complejo, en su composición y/o función. La disbiosis intestinal se ha descrito en numerosos desórdenes metabólicos e inmunes, incluyendo enfermedad inflamatoria intestinal, enfermedad celíaca, obesidad, asma y alergias. La alergia a la proteína de la leche de vaca (APLV) es la alergia alimentaria más común en niños. Sin embargo, a pesar del desarrollo de las técnicas de secuenciación masiva y el avance del análisis bioinformático, aún no conocemos en detalle las bacterias implicadas en el desarrollo de enfermedades alérgicas. Además, es importante tener presente que la programación inmune inducida por la microbiota intestinal ocurre en los primeros años de vida, siendo este período la ventana de oportunidad para el desarrollo de estrategias destinadas a la prevención de las alergias.
El objetivo de este trabajo es hacer una revisión bibliográfica de las características de la microbiota intestinal en pacientes con APLV, identificando los factores más relevantes que influencian la conformación de la microbiota en la edad temprana, y analizando si ciertas alteraciones en la microbiota podrían asociarse con el desarrollo de APLV.
Palabras clave
microbiota intestinal, disbiosis, alergia alimentaria, alergia a la proteína de leche de vaca
Introducción
La microbiota es una comunidad compleja de microorganismos que coloniza nuestro cuerpo, principalmente bacterias, pero también virus, hongos (sobre todo levaduras), protozoos y arqueas. Se define como microbioma a todo el hábitat en que éstos se encuentran, incluyendo los microorganismos, sus genomas y las condiciones ambientales circundantes (metabolitos, elementos genéticos móviles, estructuras microbianas, moléculas de señalización, etc) [1,2].
La microbiota intestinal, especialmente la localizada en el colon, llega a alcanzar densidades de 1011-1012 células/ml [3,4]. Está compuesta principalmente, por dos filos bacterianos, Firmicutes y Bacteroidetes (que suponen el 90% de la microbiota intestinal) y, en menor medida, Actinobacteria, Proteobacteria y Verrucomicrobia [4,5]. El filo Firmicutes incluye un gran número de géneros, siendo algunos de los más importantes Lactobacillus, Clostridium y Ruminococcus. El filo Bacteroidetes incluye bacterias pertenecientes a los géneros Bacteroides y Prevotella. El principal género perteneciente al filo Actinobacteria es Bifidobacterium. Las proteobacterias están representadas fundamentalmente por miembros de la familia Enterobacteriaceae, mientras que el filo Verrucomicrobia tiene un único miembro, Akkermansia muciniphila. Las bacterias de la microbiota intestinal ejercen numerosas funciones, tales como la metabolización de alimentos que el organismo no puede procesar, como fibra dietética y carbohidratos complejos; la protección contra patógenos; la síntesis de metabolitos esenciales, como algunas vitaminas y neurotransmisores; el mantenimiento de la integridad de la mucosa intestinal y la modulación de la respuesta inmune, incluyendo la tolerancia oral a los alimentos [6,7].
La microbiota intestinal se establece, diversifica y madura desde el nacimiento hasta los 2 a 3 primeros años de vida [7,8]. En su formación intervienen componentes genéticos, epigenéticos y ambientales. El establecimiento de la microbiota intestinal comienza por la exposición a
microorganismos a través del canal de parto, y por el contacto con la piel materna y la microbiota del entorno [9]. Los primeros colonizadores consisten en una mezcla de microorganismos cutáneos y entéricos, dominados por Lactobacillus, Enterococcus, Streptococcus y estafilococos coagulasa negativa. A medida que éstos consumen el oxígeno del medio intestinal, son reemplazados por anaerobios obligados tales como Bifidobacterium, Bacteroides, Clostridium y Eubacterium. Existen evidencias de que la microbiota intestinal evoluciona en forma simultánea con el sistema inmunitario del bebé y con la programación metabólica y neurológica [8]. En esta coevolución, las bacterias comensales juegan un papel fundamental en el desarrollo de la inmunidad innata y adaptativa, contribuyen a la integridad y función de la barrera intestinal, inhiben la colonización por patógenos e intervienen en las respuestas linfocitarias de tipo B y T regulatoria [6].
Se han descrito varios factores que modulan el establecimiento de la microbiota intestinal en la vida temprana, y que son determinantes para la salud del individuo durante toda su vida. Entre estos destacan dos factores clave, que son el tipo de parto -vaginal o por cesárea-, y el tipo de lactancia – materna o artificial-. Dado que el establecimiento y la maduración de la microbiota intestinal
ocurre en los llamados “1.000 días”, que van desde la concepción hasta los primeros 2 años de vida del niño, éste período se considera una ventana crítica de oportunidad para realizar intervenciones que contribuyan a la conformación de una microbiota saludable [8] (Figura 1).
El tipo de parto puede producir profundas diferencias en los patrones de colonización intestinal de los bebés. El parto vaginal permite el contacto del bebé con la microbiota vaginal y fecal, lo cual resulta en una colonización neonatal dominada por Lactobacillus y Prevotella [7]. El parto por cesárea se ha asociado con menor abundancia y diversidad de los filos Actinobacteria y Bacteroidetes, y mayor abundancia y diversidad del filo Firmicutes en los primeros 3 meses de vida [4]. A nivel de género, Bifidobacterium y Bacteroides son más abundantes en niños nacidos por parto vaginal, a diferencia de los niños nacidos por cesárea, que
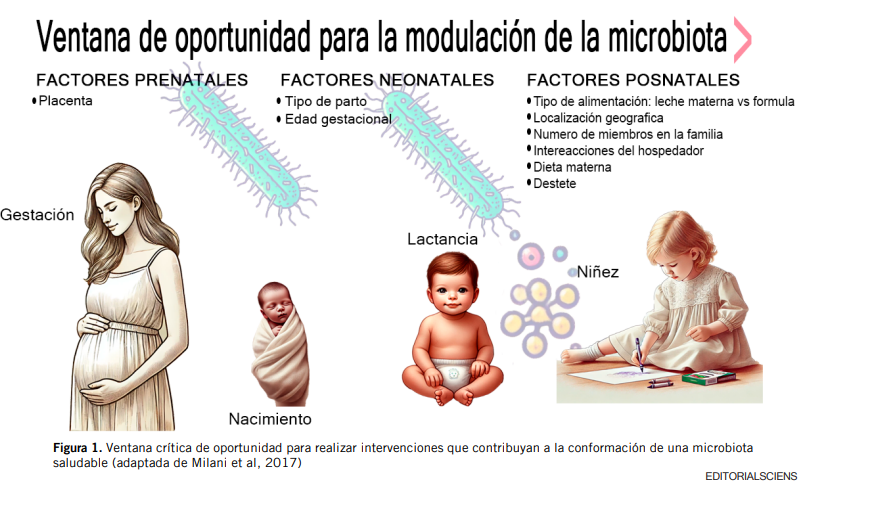
presentan mayor colonización por Clostridium y Lactobacillus hasta los 3 meses de vida. Otros trabajos evidencian menor abundancia de Escherichia coli, Bifidobacterium y Bacteroides en niños nacidos por cesárea, posiblemente por efecto del uso de antibióticos en esta práctica quirúrgica. Estos bebés presentan típicamente una microbiota enriquecida en Staphylococcus y Streptococcus, comparable con la microbiota de la piel materna [5,7]. Asimismo, presentan mayor cantidad de patógenos oportunistas como Enterococcus, Enterobacter y Klebsiella [10].
Con respecto a la lactancia, hay numerosas evidencias que muestran que la leche materna contribuye al desarrollo de un microbioma saludable, ya que aporta no sólo micronutrientes y compuestos prebióticos que estimulan la colonización y el crecimiento de bacterias comensales, sino también factores inmunológicos activos, oligosacáridos y bacterias, los cuales modulan las respuestas inmunes. Hace algunos años se pensaba que la leche materna era estéril. Sin embargo, fueron Jiménez et al quienes demostraron por primera vez, en un experimento en ratones con Enterococcus marcados genéticamente, que las bacterias pueden transferirse a los hijos a través de la leche materna [11], resultados que fueron confirmados en ensayos posteriores en humanos [12].
La microbiota intestinal de lactantes alimentados con leche materna es menos diversa, pero contiene altos niveles de especies del género Bifidobacterium, como B. breve, B. bifidum y B. longum, capaces de metabolizar los oligosacáridos de la leche humana (HMO), así como también menor presencia de patógenos potenciales que los niños alimentados con fórmula [7]. Los HMO son polisacáridos complejos, que alcanzan el colon sin ser digeridos, y estimulan el crecimiento selectivo de ciertas bacterias comensales, como las bifidobacterias, actuando de esta manera como prebióticos. Han sido identificadas más de 200 estructuras de HMO diferentes, que dan cuenta de un tercio de los componentes sólidos de la leche materna, siguiendo en abundancia a la lactosa y los lípidos, y hallándose en mayor concentración (20 g/l) en el calostro humano [9]. La suplementación de fórmulas infantiles con galacto-oligosacáridos (GOS) y fructo- oligosacáridos (FOS) en una proporción 9:1, parece simular en cierto grado el efecto de los HMO sobre la microbiota intestinal, estimulando el desarrollo de bifidobacterias. La cesación de la lactancia materna, más que la introducción de alimentos sólidos, es el principal factor que produce un cambio de la microbiota de los lactantes [8].
Es por estas razones que los niños nacidos por parto vaginal y alimentados con leche materna en forma exclusiva presentan el microbioma más saludable y beneficioso, con altas concentraciones de Bifidobacterium y bajas cantidades de Clostridioides difficile y E. coli [10].
La edad gestacional es otro factor que afecta el establecimiento de la microbiota, ya que los bebés nacidos pretérmino (con menos de 37 semanas de gestación) tienen un sistema inmunitario inmaduro y frecuentemente afrontan largas estancias hospitalarias y alimentación artificial o parenteral, factores que interfieren con el establecimiento de una microbiota
saludable [7].
Otros factores relevantes que modulan la microbiota intestinal en la infancia temprana son: el uso de antibióticos prenatales o durante los primeros meses de la vida del bebé, la vida en ambientes rurales, el tamaño de la familia, el número de hermanos y la presencia de mascotas [7]. Las alteraciones de la microbiota a causa del uso de antibióticos en niños han sido documentadas en varios estudios, observándose incluso hasta 2 años después de su utilización, con disminución de bifidobacterias y aumento de enterobacterias, sumado a una disminución en la diversidad [8]. También se ha reportado que los niños cuyas madres reciben profilaxis intraparto por colonización vaginal por estreptococos del grupo B, ruptura prematura de membranas o bien por cesárea, exhiben alteraciones en la diversidad y riqueza de su microbiota intestinal [13].
Varios estudios han reportado una aparente estabilización de la microbiota intestinal hacia una configuración de adulto dentro de los 3 primeros años de vida. Uno de los mayores estudios realizados incluyó 903 niños de 4 países (Alemania, Finlandia, Suecia y EEUU) seguidos durante 3 años, en el cual se observó que después de los 31 meses los filos dominantes y la diversidad permanecen estables, con predominio del filo Firmicutes [8]. En forma similar, un estudio en 2016 evaluó 367 individuos japoneses sanos entre 0 y 104 años, reportando que la microbiota intestinal cambia con la edad. Firmicutes fue el filo predominante en la población adulta, mientras Actinobacteria fue el más hallado en menores de 1 año. La abundancia relativa de actinobacterias en niños fue disminuyendo después del destete, y la composición de la microbiota intestinal fue acercándose a la de adulto cerca de los 3 años de edad [9].
Relación entre disbiosis y enfermedad
Numerosos estudios y revisiones han remarcado la importancia crucial del desarrollo de esta simbiosis entre microbiota y hospedador para la salud del bebé, y sus consecuencias durante toda la vida [8]. Alteraciones en la composición y abundancia de los miembros de la microbiota intestinal en la vida temprana, denominadas disbiosis, han sido asociadas con desórdenes en la salud en niños y adultos, entre ellos sobrepeso, obesidad, manifestaciones atópicas, asma, síndrome metabólico, diabetes tipo 2, síndrome de intestino irritable, enfermedades crónicas inflamatorias y condiciones relacionadas al neurodesarrollo [14,15,16].
Muchas de estas enfermedades crónicas propias de la “vida moderna”, conocidas como enfermedades crónicas no transmisibles, están asociadas de forma similar con factores de riesgo medioambientales modernos, y se han incrementado en las últimas décadas. En las enfermedades metabólicas, como la diabetes, existe una inflamación crónica de bajo grado, que podría ser inducida y perpetuada por estados de disbiosis intestinal, a través de varios mecanismos. Por ejemplo, el pasaje del lipopolisacárido de bacterias patógenas al torrente sanguíneo causa una endotoxemia metabólica que contribuye al estado proinflamatorio. Las dietas ricas en grasas y bajas en fibra, el sedentarismo y el consumo de azúcares refinados contribuyen a la disbiosis y al aumento de la permeabilidad intestinal que perpetúa este estado inflamatorio [17].
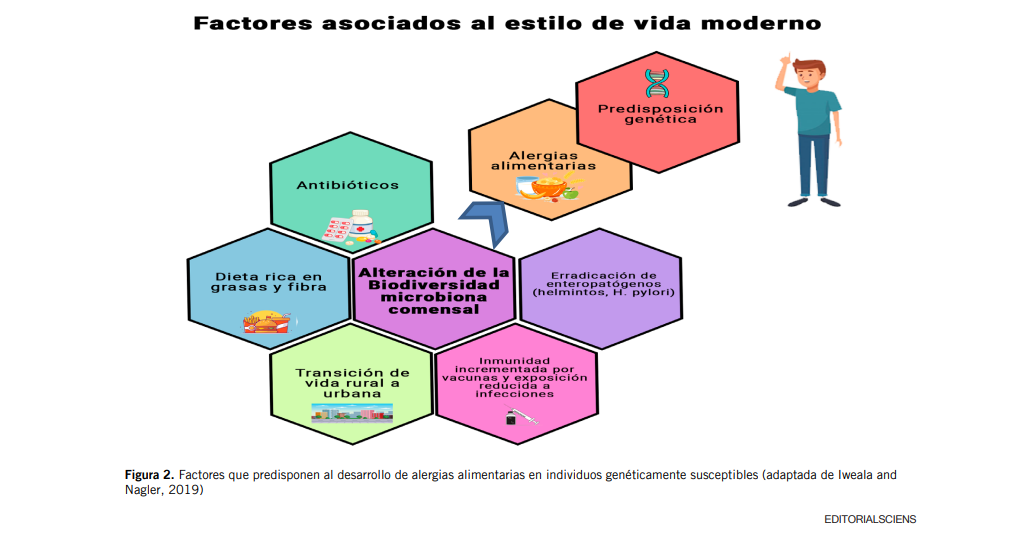
En el caso de las enfermedades alérgicas, aunque factores genéticos pueden afectar la tendencia actual del desarrollo de las mismas, el rápido incremento observado en los últimos 20 años, especialmente en países industrializados, sugiere que deben existir factores ambientales. Algunos de ellos han sido identificados, como el incremento de los partos por cesárea, el uso de antibióticos y un alto consumo de dietas ricas en grasas y bajas en fibra. El hecho de que todos estos factores a su vez modulan la microbiota intestinal, sugiere un papel de la misma en el desarrollo de las alergias, sobre todo por su importante función en la regulación de la respuesta inmune y la tolerancia oral en la vida temprana [16].
Microbiota intestinal y alergias alimentarias
En los últimos años la prevalencia de las alergias alimentarias ha mostrado un marcado crecimiento, principalmente en sociedades industrializadas en todo el mundo. La alergia es la enfermedad crónica no transmisible de inicio más temprano, comenzando a menudo en los primeros meses de vida. Las alergias alimentarias se presentan como parte de un conjunto de manifestaciones alérgicas, conocidas como “marcha atópica”, en la cual aparece en los primeros meses la dermatitis atópica, seguida por alergias a alimentos entre los 2 y 5 años. Asma y rinitis alérgicas suelen manifestarse en la edad escolar [10,14].
Notablemente, la evolución de la epidemia de alergias ha crecido paralelamente con los cambios de estilo de vida en los países industrializados, tales como una progresiva urbanización, programas de sanitización ambiental, uso desmedido de antibióticos, inactividad física y consumo de alimentos altamente procesados. Todos estos cambios han llevado a una reducción de la exposición a microorganismos en la vida temprana y a una pérdida de la diversidad microbiana intestinal [10].
Se han postulado algunas teorías para explicar el gran incremento que han sufrido las enfermedades alérgicas, especialmente en los países occidentalizados. Una de ellas denominada “Teoría de la Higiene”, propuesta por Strachan a fines de los 80, basada en la evidencia epidemiológica de que el contacto temprano con factores ambientales que incrementan una exposición natural microorganismos (como el parto vaginal, la vida en ambientes rurales, familias numerosas, presencia de mascotas y ausencia de antibióticos) protege contra enfermedades alérgicas y autoinmunes, y predispone menos al desarrollo de diabetes, obesidad y enfermedades inflamatorias. Un ambiente extremadamente aséptico aumenta la incidencia de estos trastornos [10,14]. El hecho de que algunos investigadores han sugerido un papel crítico de las señales inmunorregulatorias por parte de las bacterias comensales en la regulación de la hiperreactividad alérgica, ha llevado a la reformulación de la hipótesis de la higiene como la de los “viejos amigos”. Esta hipótesis propone que cambios en el entorno, la dieta y el estilo de vida de los países industrializados, sumados a una alta exposición a antibióticos, un mayor consumo de grasas saturadas y baja cantidad de fibra, han modificado la microbiota intestinal alterando de este modo el natural desarrollo de la tolerancia inmune, lo cual ha conducido al aumento de las enfermedades alérgicas [14].
En la figura 2 se muestra cuáles son los factores que predisponen al desarrollo de alergias alimentarias en individuos genéticamente susceptibles.
En relación al mecanismo inmunológico de la enfermedad alérgica, se sabe que la dominancia de la respuesta tipo Th2 sobre Th1 es clave en el desarrollo de la misma. Los linfocitos Th2 producen interleuquinas (IL) 4, 5 y 13, que están involucradas en el inicio y perpetuación del fenotipo alérgico. La IL-4 promueve la diferenciación de células T vírgenes a Th2 y el cambio de clase a IgE en los linfocitos B. La IL-5 actúa en la diferenciación y activación de los eosinófilos, y la IL-13 actúa también en el cambio de clase a IgE en los linfocitos B. Además, activa mastocitos y promueve la migración de eosinófilos hacia las mucosas. Por
el contrario, una respuesta de tipo Th1 mediada por interferón gamma (IFN-γ), inhibe la respuesta Th2. Como consecuencia, un desbalance inmune entre estas respuestas, dirigido hacia un incremento de la respuesta tipo Th2 aumentaría el riesgo de padecer enfermedades alérgicas. La diferenciación hacia Th1 y Th2, así como hacia otros tipos de respuestas T que son relevantes en la enfermedad alérgica, como T regulatoria, Th17 y Th9, está controlada estrictamente por mecanismos epigenéticos [18].
Nagler y otros autores proponen que la tolerancia a antígenos dietarios, y por tanto la prevención de la alergia alimentaria, requiere de una respuesta inmune regulatoria específica de antígeno, y una respuesta protectora de la barrera intestinal inducida por las bacterias comensales. La interrupción de la comunicación entre el epitelio intestinal y las células inmunes por alteraciones del microbioma, impactan negativamente en la homeostasis inmune, impidiendo el desarrollo de la tolerancia oral [14].
El mecanismo primario de tolerancia oral a antígenos dietarios es la inducción de las células T regulatorias. La respuesta tolerogénica a antígenos luminales depende de la translocación de éstos a través de la barrera epitelial intestinal, en que intervienen las células M presentes en el tejido linfoide asociado al intestino (GALT). Allí son captados por las células presentadoras de antígenos, fundamentalmente las células dendríticas CD103+, las cuales migran hacia los nódulos linfáticos mesentéricos y presentan dichos antígenos a los linfocitos T vírgenes. Esta interacción en presencia de ácido retinoico (metabolito de la vitamina A) y del factor de crecimiento transformante beta (TGF-β), producidos por las células dendríticas CD103+, favorece la conversión a células T regulatorias foxP3+ específicas de antígeno, productoras de IL-10. Algunas T regulatorias migran hacia el torrente sanguíneo promoviendo tolerancia sistémica y vuelven a la lámina propia donde producen TGF-β que promueve el cambio de clase a IgA en los linfocitos B. Si bien el papel de la microbiota en la regulación de la captación y la presentación de antígenos aún no ha sido completamente dilucidado, se sabe que en el intestino delgado, donde se absorben los antígenos alimentarios, los fagocitos mononucleares residentes en la lámina propia (MNPs) expresan el receptor de quimioquinas CX3CR1. La estimulación microbiana de los Toll-like receptors (TLRs) y la señalización mediante la proteína de diferenciación mieloide 88 (MyD88) inducen la generación de extensiones de las células dendríticas en el intestino delgado. Tanto la presentación de antígenos como la producción de IL-10 por los MNPs CX3CR1+, son requeridas para la tolerancia. Se ha observado que, en ratones tratados con antibióticos, los MNPs CX3CR1+ pierden la capacidad de expresar IL-10, sugiriendo un papel crítico de la microbiota en su función [13,14].
Los microorganismos comensales también influyen en el desarrollo de linfocitos T regulatorios en forma directa a través de los ácidos grasos de cadena corta (AGCC), que son los productos finales de la fermentación de la fibra dietética por las bacterias comensales, en especial los Firmicutes. Se ha demostrado una correlación positiva entre el número de T regulatorios y la concentración de AGCC. Uno de los mecanismos por los cuales los AGCC protegen contra enfermedades alérgicas es de tipo epigenético, mediante la inhibición directa de
deacetilasas de histonas, que regulan la expresión de las células linfoides innatas para la protección de la barrera intestinal, a través de la producción de IL-22. Ésta induce la producción de péptidos antimicrobianos por las células de Paneth, y de mucus mediante las células Globet en un intestino con microbiota saludable [13]. En particular el acetato es capaz de incrementar el porcentaje y actividad de las células T regulatorias, causando un aumento en el estado de acetilación del promotor de foxP3+, a través de la inhibición de la deacetilasa de histona HDAC9. El butirato inhibe estas enzimas afectando la activación al menos parcial, del factor de transcripción NF-κB. La acetilación inducida por los AGCC producidos por Clostridium, Anaerostipes y Eubacterium, así como la metilación del ADN inducida por el folato sintetizado a partir de bacterias comensales como Lactobacillus y Bifidobacterium, estimulan el desarrollo y el balance inmune del intestino [18].
Todos estos datos sugieren que las células T regulatorias foxP3+, tanto inducidas en forma específica por los antígenos alimentarios, como por las bacterias comensales, cooperan para prevenir la respuesta alérgica a los alimentos [13].
Alergia a la proteína de leche de vaca
La APLV es la alergia alimentaria más común en niños, presentándose generalmente antes de los 2 años de edad, y es reconocida como un indicador de desregulación de la respuesta inmune en la edad pediátrica [10,19]. De hecho, los niños afectados por APLV en el primer año de vida tienen un riesgo incrementado de desarrollar otras manifestaciones atópicas a lo largo de su vida, así como otros desórdenes crónicos inmunomediados [15]. La incidencia mundial es de 2 a 3 % en el primer año de vida, y en la actualidad el único tratamiento posible es retirar de la dieta todos los alimentos que contengan proteínas de leche de vaca [18,20].
En cuanto a la prevalencia en Argentina, un estudio retrospectivo que analizó casos confirmados de APLV durante 11 años en un hospital universitario, detectó una prevalencia acumulada de 0,8 %, con un incremento porcentual de la misma, desde 0,4 % en 2004 hasta 1,2 % en 2014, lo que representa un incremento de tres veces en la prevalencia de esta alergia [21]. La APLV suele tener una evolución favorable con resolución espontánea hacia los 5 años de vida, ocurriendo dicha resolución en un 90 % de los casos antes de los 2 años de vida [22].
En base a la reacción inmune implicada, se distinguen tres tipos de APLV: mediada por IgE, no mediada por IgE (la mayoría debidas a reacciones de inmunidad celular) y trastornos mixtos [23]. Las primeras se caracterizan por la aparición de forma inmediata (menos de 2 horas desde el contacto) de sintomatología cutánea, como dermatitis atópica; o respiratoria, como rinitis o asma. En estos pacientes es posible determinar la existencia de anticuerpos IgE específicos en sangre o una prueba cutánea positiva (Prick test). La APLV mediada por IgE es la forma responsable de la expresión más extrema de APLV, que es la anafilaxia. Las formas no mediadas por IgE ocasionan una sintomatología predominantemente digestiva de aparición tardía, siendo la forma más común de presentación la
proctocolitis alérgica, y en la mayoría de los casos no es posible confirmar la implicación de un mecanismo inmunológico mediante pruebas complementarias [22]. Otras formas de presentación son la enteropatía o la enterocolitis inducida por proteína de leche de vaca (24).
El diagnóstico de APLV se realiza teniendo en cuenta criterios clínicos y de laboratorio, establecidos en consensos nacionales e internacionales [29].
Para el diagnóstico de la variante mediada por IgE se requiere una historia clínica detallada y compatible, con la aparición de síntomas inmediatos (menos de 2 hs tras la ingesta), manifestaciones cutáneas y/o respiratorias y/o digestivas ligadas a mecanismos IgE: urticaria, angioedema, síndrome de alergia oral, rinoconjuntivitis, sibilancias, hipersensibilidad gastrointestinal inmediata o anafilaxia, más la determinación de sensibilización a proteínas de leche de vaca (mediante test cutáneos o IgE específicas) y mejoría absoluta de los síntomas al suprimir la alimentación a base de proteínas de leche de vaca y derivados.
Pruebas cutáneas (Prick test): Se coloca una gota de alérgeno (α-lactoalbúmina, ß-lactoglobulina, caseína, histamina como control positivo y suero salino como control negativo), en la cara anterior del antebrazo, se pincha con lanceta encima de cada gota para que la solución penetre en la piel y se mide el tamaño de la pápula a los 15 minutos. Se considera positivo un tamaño de pápula superior a 3 mm; una pápula superior a 10 mm se asocia con alergia persistente.
Determinación de IgE específica en suero: Se determina la IgE específica a proteínas de la leche de vaca, con un punto de corte de 0,35 kU/L. Valores superiores a 2,5 tienen un alto valor predictivo positivo.
Prueba de provocación oral: su realización puede omitirse si la probabilidad de APLV es alta, en base a los test cutáneos o las IgE especificas positivas, o si la misma tuviera un riesgo elevado de presentar síntomas severos (p. ej., antecedente de anafilaxia).
El diagnóstico de las variantes no mediadas por IgE requiere una historia clínica detallada y compatible, más la prueba de exclusión-provocación. La historia clínica debe evaluar antecedentes familiares y personales de atopía para establecer el riesgo, la asociación y tiempo transcurrido entre la exposición al alimento y la aparición de los síntomas, características y gravedad de los mismos, edad de comienzo, historia nutricional y dietética completa y factores asociados o desencadenantes.
Prueba de exclusión-provocación: es la prueba “gold standard” para confirmar el diagnóstico de APLV no mediada por IgE. Consiste en excluir la leche de vaca y derivados de la dieta por un periodo de 4 a 6 semanas, comprobar la resolución de los síntomas y posteriormente volver a introducirla de forma controlada, excepto en los casos de enterocolitis inducida por proteínas. Si está alimentado con pecho exclusivo, la madre debe realizar la dieta de exclusión en forma estricta. Si se encuentra recibiendo fórmula artificial, se indica una fórmula extensamente hidrolizada.
Alteraciones de la microbiota intestinal en alergias alimentarias
En humanos, el primer estudio que exploró la hipótesis de que la enfermedad alérgica estaría asociada con una microbiota alterada en niños, fue realizado en Suecia en los años 90, utilizando técnicas dependientes de cultivo. Hallaron que los niños alérgicos estaban menos colonizados con lactobacilos y tenían mayor proporción de bacterias aeróbicas y menos Bacteroidetes que los niños sin alergias [6]. Sin embargo, este tipo de estudios arrojaban resultados parciales, dado que la mayoría de las bacterias intestinales no pueden ser cultivadas. Desafortunadamente, no se han realizado trabajos en esta área utilizando metagenómica total, pero numerosos estudios basados en secuenciación del ARN ribosomal 16S, han demostrado que niños con alergias alimentarias exhiben una microbiota diferente a la de aquellos sin alergias [26].
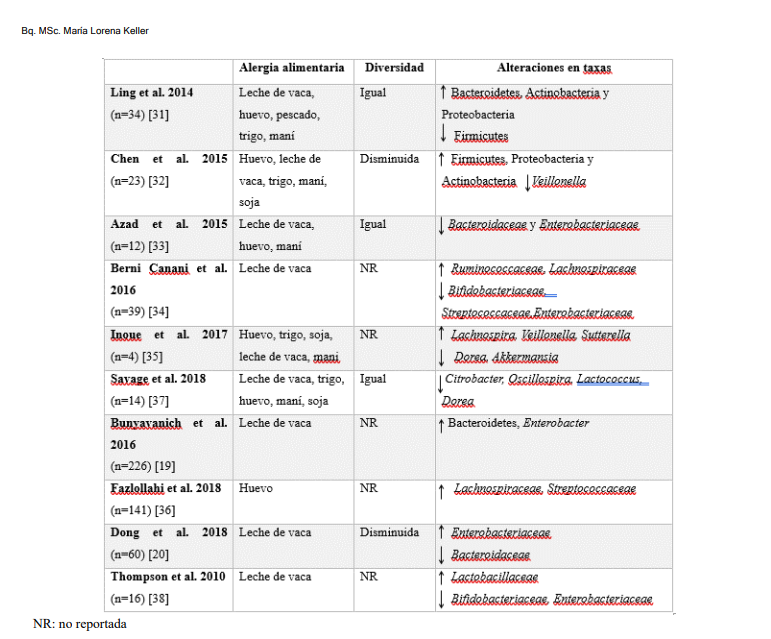
En la tabla I se mencionan los estudios publicados hasta la fecha en alergias alimentarias mediadas por IgE. Los estudios muestran resultados dispares, si bien parecería existir un aumento de Enterobacteriaceae y Bacteroides, y disminución de bifidobacterias en varios de ellos.
Los estudios en alergia alimentaria no mediada por IgE son aún más escasos. Por ejemplo, Berni Canani et al hallaron disbiosis intestinal caracterizada por enriquecimiento de Bacteroides y Alistipes en niños con APLV IgE no mediada, en comparación con el grupo control [15].
Por otra parte, estudios en animales de experimentación revelan evidencias acerca del papel de la microbiota en el desarrollo de alergias. Ratones tratados con antibióticos han mostrado predisposición al desarrollo de enfermedad alérgica. Similarmente, ratones libres de microorganismos o germ-free (GF) no desarrollan tolerancia inmune y mantienen una respuesta Th2 a antígenos administrados oralmente. Este efecto puede revertirse mediante la reconstitución del microbioma a edad temprana, pero no más tarde en la vida [26]. Otra cuestión interesante es que la microbiota intestinal es capaz de transferir susceptibilidad a alergia alimentaria, lo cual fue probado en ratones GF a los cuales se reconstituía la microbiota con aquella proveniente de un modelo de ratones susceptibles a alergia alimentaria [27]. Un estudio del grupo de Cathryn Nagler, demostró que ratones GF estaban protegidos de desarrollar anafilaxia a la leche de vaca si se colonizaban con microbiota de niños sanos, pero no con microbiota proveniente de niños con APLV [28].
Aunque cada vez surgen más evidencias de asociaciones de la microbiota con enfermedades alérgicas, algunos estudios no han hallado diferencias en la microbiota de niños con estos cuadros, o han encontrado asociación con ciertos fenotipos alérgicos pero no con otros [6]. Si bien sabemos que la estructura de la microbiota en los primeros 6 meses de vida es relevante en el desarrollo de alergias, y que la disbiosis intestinal podría influenciar tanto la aparición como el curso de las alergias alimentarias, aún no se han detectado taxones específicos asociados con estas patologías [26]. Esto puede deberse tanto a la heterogeneidad en los diseños experimentales, como al momento de la toma de muestra, los métodos utilizados para la caracterización de la microbiota, o los diferentes tipos de alergia estudiados, lo cual dificulta establecer una clara asociación entre taxones específicos y el desarrollo de alergias. Algunos autores han hallado que una
disminución de la diversidad microbiana precede al desarrollo de eczema, sensibilización atópica, rinitis alérgica y asma, sugiriendo que esta pérdida de diversidad podría ser incluso más importante como factor predictivo, que la presencia o ausencia de determinados taxones microbianos [6].
Discusión y perspectivas futuras
A pesar de los avances tecnológicos en secuenciación y análisis bioinformático, aún no conocemos con exactitud los microorganismos cruciales en el desarrollo de enfermedades alérgicas, siendo las más estudiadas dermatitis atópica, eczema, rinitis alérgica y asma, con resultados controvertidos. Esto obliga a seguir avanzando en el estudio de la microbiota de poblaciones pediátricas, y en el conocimiento de las alteraciones que presentan los niños con APLV, teniendo en cuenta las particularidades etarias y regionales. Por otra parte, es muy importante tener presente que la programación inmune inducida por la microbiota intestinal ocurre en los primeros años de vida, siendo este periodo la ventana en la cual las intervenciones serían efectivas en la prevención de las alergias.
La evidencia acumulada sobre la influencia de la microbiota intestinal y sus metabolitos en el desarrollo de alergias, provee una base científica para la creación de estrategias innovadoras para la prevención y el tratamiento de las mismas, como es el uso de ciertos probióticos. Sin embargo, debido a los factores ya
mencionados que intervienen en la conformación de la microbiota, es muy importante tener en cuenta parámetros etarios, étnicos, geográficos, de estilo de vida y de alimentación para el estudio y caracterización de la microbiota saludable en una determinada población, ya que su conocimiento será crítico para poder predecir alteraciones relacionadas a ciertas enfermedades.
Si bien ensayos clínicos han demostrado que la manipulación de la microbiota intestinal con probióticos o prebióticos podría ser efectiva en la prevención primaria de la dermatitis atópica, aún no hay evidencias suficientes en otras condiciones alérgicas, como las alergias alimentarias.
Por todo lo expuesto, existe un creciente interés en descubrir biomarcadores basados en el microbioma que sean capaces de predecir enfermedades y que puedan ser utilizados a futuro para proponer estrategias terapéuticas y preventivas.
Referencias bibliográficas
- Berg G, Rybakova D, Fisher D, Cernava T, Champonier Verges M, Charles T et al (2020). Microbiome definition revisited: old concepts and new challenges. Microbiome, 8:103
- Allaband C, Mc Donald D, Vázquez-Baeza Y, Minich J, Tripathi A, Brenner D et al (2019). Studying, analyzing and interpreting gut microbiome data for clinicians. Clin Gastroenterol Hepatol, 17(2): 218-230
- Ley R, Peterson D and Gordon J (2006). Ecological and evolutionary forces shaping microbial diversity in the human intestine. Cell, 124: 837-854
- Rutayisire E, Huang K, Liu Y and Tao F (2016). The mode of delivery affects the diversity and colonization pattern of the gut microbiota during the first year of infants´ life: a systematic review. BMC Gastroenterol, 16:86
- Pascal M, Pérez-Gordo M, Caballero T, Escribese M, López Longo MN, Luengo O et al (2018). Microbiome and allergic diseases. Front Immunol, 9: 1584
- Bridgman S, Kozyrskyj A, Scott J, Becker A and Azad M (2016). Gut microbiota and allergic disease in children. Ann Allergy Asthma Immunol, 116: 99-105
- Milani C, Duranti S, Bottacini F, Casey E, Turroni F, Mahony J et al (2017). The first colonizers of the human gut: composition, activities and Health implications of the infant gut microbiota. Microbiol and Biol Molecular Rev; 81: e00036-17
- Derrien M, Álvarez As and de Vos W (2019). The gut microbiota in the first decade of life. Trends in Microbiology, 27(12): 997-1008
- Akagawa S, Akagawa Y, Yamanouchi S, Kimata T, Tsuji S and Kaneko K (2021). Development of the gut microbiota and disbiosis in children. Bioscience of Microbiota, 40(1): 12-18
- Peroni D, Nuzzi G, Trambusti I, Di Cicco ME and Comberiati P (2020). Microbiome composition and its impact on the development of allergic diseases. Front Immunol, 11:700
- Jiménez E, Marín ML, Martín R, Odriozola JM, Olivares M, Xaus J et al (2008). Is meconium form healthy newborns actually sterile? Res Microbiol, 51:270-274
- Martín V, Maldonado-Barragán A, Moles L, Rodríguez- Baños M, Del Campo R, Fernández L et al (2012). Sharing of bacterial strains between breast milk and infant feces. J Human Lactation, 28(1): 36-44
- Shu SA, Yuen A, Woo E, Chu K, Kwan H, Yang G et al (2019). Microbiota and food allergy. Clin Rev Allerg and Immunol, 57(1): 83-97
- Iweala O and Nagler C (2019). The microbiome and food allergy. Annu Rev Immunol, 37: 377-403
- Berni Canani R, De Filippis F, Nocerino R, Paparo L, Di Scala C, Cosenza L et al (2018). Gut microbiome composition and butyrate production in children affected by non-IgE-mediated cow´s milk allergy. Scientific reports, 8:12500
- Sestito S, D´Auria E, Baldasarre ME, Salvatore S, Tallarico V, Stefanelli E et al (2020). The role of prebiotics and probiotics in prevention of allergic diseases in infants. Front Pediatr; 8:583946
- Noce A, Marrone G, Di Daniele F, Ottaviani E, Wilson Jones G, Bernini R et al (2019). Impact of Gut microbiota on onset and progression of chronic non-communicable diseases. Nutrients; 11:1073.
- Acevedo N, Alhamwe BA, Caraballo L, Ding M, Ferrante A, Gran H et al (2021). Perinatal and Early-Life Nutrition, Epigenetics, and Allergy. Nutrients, 13:721.
- Bunyanavich S, Shen N, Grishin A, Wood R, Burks W, Dawson P et al (2016). Early-life gut microbiome and milk allergy resolution. J Allergy Clin Immunol, 138(4): 1122-1130
- Dong P, Feng JJ, Yan DY, Lyu YJ and Xu X (2018). Early- life gut microbiome and cow´s milk allergy- a prospective case-control 6 month follow-up study. Saudi J of Biol Sciences, 25:875-880
- Mehaudy R, Parisi C, Petriz N, Eymann A, Jauregu MB and Orsi M (2018). Prevalencia de alergia a la proteína de leche de vaca en niños en un hospital universitario de la comunidad. Arch Arg Ped, 3:216-233
- Bozzola M, Marchetti P, Cosentino M, Corti M, Petriz N and Parisi C (2015). Alergia a la proteína de la lecha de vaca. Evaluación de su resolución espontánea por medio de desafíos doble ciego placebo controlados. Arch Alerg e Inmunol Clin, 46(2): 44-48
- Díaz M, Guadamuro L, Espinosa-Martos I, Mancabelli L, Jiménez S, Molinos-Norniella C et al (2018). Microbiota and derived parameters in fecal samples of infants with non-IgE cow´s milk protein allergy under a restricted diet. Nutrients, 10:1481
- Meninni M, Fierro V, Di Nardo G, Pecora V and Fiocchi A (2020). Microbiota in non-IgE mediated food allergy. Curr Opin Allergy Clin Immunol, 20:323-328
- Rachid R and Chatila T (2016). The role of the gut microbiota in food allergy. Curr Opin Pediatr, 28: 748- 753
- Di Costanzo M, Carucci L, Berni Canani R and Biasucci G (2020). Gut Microbiome Modulation for Preventing and Treating Pediatric Food Allergies. Int. J. Mol. Sci. 21, 5275.
- Noval Rivas M, Burton O, Wise P, Zhang Y, Hobson S, Garcia Lloret M et al (2013). A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. J Allergy Clin Immunol, 131:201-212.
- Feehley T, Plunkett C, Bao R, Hong SM, Culleen E, Belda- Ferre P et al (2019). Healthy infants harbor intestinal bacteria that protect against food allergy. Nature Medicine, 25: 448-453
- Fiocchi A, Brozek J, Schünemann H, Bahna S, von Berg A, Beyer K et al. (2010) World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) Guidelines. Pediatr Allergy Immunol; 21: 1-125.
- Mitselou N, Hallberg J, Stephansson O, Almqvist C, Melén E, Ludvigsson J el at (2018). Cesarean delivery, preterm birth, and risk of food allergy: Nationwide Swedish Cohort study of more than 1 million children. J Allergy Clin Immunol,142(5): 1510-1516
- Ling Z, Li Z, Cheng Y, Luo Y, Tong X, Yuang L et al (2014). Altered fecal microbiota composition associated with food allergy in infants. Appl Environ Microbiol, 80(8): 2546-54
- Chen CC, Chen KJ, Kong MS, Chang HJ and Huang JL (2016). Alterations in the gut microbiota of children with food sensitization in early life. Pediatr Allergy Immunol, 27:254-262
- Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, Hayglass KT et al (2015). Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy, 45(3): 632-43
- Berni Canani R, Sangwan N, Stefka A, Nocerino R, Paparo L, Aitoro R et al (2016). Lactobacillus rhamnosus
GG-supplemented formulae expands butyrate-producing bacterial strains in food allergic infants. ISME J, 10:742- 750
- Inoue R, Sawai T, Sawai C, Nakatani M, Romero-Pérez G, Ozeki M et al (2017). A preliminary study of gut disbiosis in children with food allergy. Bioscience, Biotechnology and Biochemistry, 81(12): 2396-2399
- Fazlollahi M, Chun Y, Grishin A, Wood RA, Burks AW, Dawson P et al (2018). Early-life gut microbiome and egg allergy. Allergy, 73:1515-24
- Savage et al (2018). A prospective microbiome-wide association study of food sensitization and food allergy in childhood. Allergy, 73:145-152
Thompson-Chagoyan O, Vieites J, Maldonado J, Edwards C and Gil A(2010). Changes in faecal microbiota of infants with cow’s milk protein allergy – a Spanish prospective case–control 6-month follow-up study. Pediatr Allergy Immunol, 21: e394–e400







No comments! Be the first commenter?