Rol del Eje Intestino- Cerebro-Microbiota en la regulación de la ingesta de alimentos y en el desarrollo de obesidad y Síndrome metabólico. Parte 2
Resumen
La conexión existente entre el intestino, su microbioma y el cerebro humano, ha sido recientemente descrita y ampliamente estudiada, principalmente en lo referente a las alteraciones del estado de ánimo, secundarias a disrupciones en dicha conexión. Sin embargo, este eje de doble vía, que afecta tanto al SNC (Sistema Nervioso Central), como
al TGI (Tracto Gastrointestinal) y que esta influenciado a su vez por el sistema neuroendocrino y el sistema inmune, no sólo manifiesta sus alteraciones a nivel del estado de ánimo, sino también en la sensación de saciedad al comer, en la elección de los alimentos, en el acúmulo de grasa visceral y corporal total y en la sensibilidad a la insulina
(entre otras manifestaciones) y por ende en el riesgo de desarrollar sobrepeso, obesidad y síndrome metabólico. El tema de nuestra revisión el día de hoy será entonces, sobre cómo nuestro microbioma intestinal interviene en todas estas funciones y como mediante el uso de ciertos probióticos clásicos, podemos modularlo para que actúe a nuestro favor, controlando nuestro peso y el riesgo de desarrollar síndrome metabólico.
Palabras clave
Microbiota, microbioma, intestino, cerebro, síndrome metabólico, obesidad, sobrepeso, probióticos.
El TGI (Tracto Gastrointestinal) y el cerebro interactúan de forma compleja y bidireccional utilizando la circulación sanguínea y los nervios craneales como canales de comunicación (figura 1). En este proceso, las hormonas liberadas por las células enteroendócrinas (EEC) estimulan el cerebro a través de la vía humoral o neural, y los enterocitos actúan como sensores del contenido luminal, liberando diferentes combinaciones de hormonas intestinales, que actúan sinérgicamente para detener la ingesta de alimentos y producir saciedad a través de la señalización endocrina y nerviosa. Dentro de las hormonasintestinales se incluyen Colecistoquinina (CKK), péptido similar al glucagón 1 (GLP- 1), péptido YY (PYY), oxitomodulina (OXM), y péptidos inmunogénicos del gluten (GIP) los cuales llegan al cerebro (camino aferente) y generan señales centrales (vía aferente) que transmiten impulsos periféricos que causan un efecto (vía eferente) anorexígeno.
A continuación, describiré de manera sucinta, dichas sustancias.
La CCK está implicado en diferentes procesos fisiológicos, como motilidad intestinal, vaciado gástrico, contracción de la vesícula biliar y secreción pancreática, pero también en la regulación de la ingesta de alimentos y homeostasis energética. Esta sustancia tiene un efecto regulador negativo sobre la secreción de grelina, la hormona orexigénica por excelencia junto al neuropéptido Y (NPY). Por otra parte, el GLP-1, es producto de la escisión del gen pre-proglucagón, tiene actividad anorexígena e hipoglucémica (1, 2), inhibe la secreción de glucagón, y estimula la síntesis y liberación de insulina; también inhibe la secreción ácida gástrica inducida por alimentos, promueve la distensión gástrica y retrasa el vaciado gástrico, generando sensación de saciedad (3).
El PYY promueve la absorción de nutrientes retrasando el vaciado gástrico (“freno ileal”) e inhibe la secreción de líquidos y electrolitos en el intestino delgado. El PYY también tiene actividad vasoconstrictora y participa en la denominada natriureis de sobremesa, reduciendo la velocidad de filtración glomerular.
Todas estas sustancias tienen efecto a nivel central por receptores específicos para cadauna de ellas (CCK-2R, GLP- 1R, e Y2), ubicados en la eminencia y el área postrema-medial del hipotálamo (núcleo arcuato), los cuales están altamente vascularizados. El núcleo arcuato (ARC), es el núcleo hipotalámico más relevante en la respuesta de saciedad, contiene dos tipos de neuronas:
La primera población neuronal, expresa receptores para
neuropéptidos tales como la Propio melanocortina (POMC), la
alfa MSH (Hormona Estimulante de los melanocitos) y transcripto-reguladores de cocaína y anfetamina o endocannabinoides (CART), que tienen efectos agonistas sobre los receptores de melanocortina 3 (MC3) y 4 (MC4), induciendo saciedad y modificando la regulación energética por numerosos mecanismos.
La estimulación de los receptores para Melanocortina (MC), producida por la ingesta de alimentos y por la leptina, inhibe la liberación basal de insulina y altera el metabolismo de carbohidratos probablemente a través de la estimulación del sistema nervioso simpático, y aumenta el consumo celular de oxígeno con el consecuente incremento en la producción de energía (4). En el tronco encefálico y en el núcleo del tracto solitario (NTS), también hay poblaciones neuronales de similares características.
La segunda población neuronal del ARC es rica en receptores para NPY y el péptido relacionado con agutíes (AgRP), que producen estimulación de la ingesta de alimentos. Recientemente, el descubrimiento de la completa la morfología de los EECs reveló una interacción más íntima y compleja entre estas y neuronas aferentes vagales, como se sugirió inicialmente a través de una estructura similar a un axón, conocida como neuropodio (5-7).
La presencia de receptores hormonales intestinales en neuronas aferentes vagales, tales como CCK-1R, GLP-1R, y receptor Y2 y MC4-R, también fue demostrada (5-7). La deficiente regulación de la secreción hormonal intestinal está presente no sólo en pacientes obesos y con sobrepeso, sino también en las personas que sufre de Diabetes Mellitus Tipo 2 (T2DM). Por ejemplo, GLP-1 plasmático y PYY son más bajos en esas personas, debido a su secreción reducida en el intestino (8). Recientemente, fue identificada una adipocina con alta producción en el tejido adiposo de personas obesas, que induce un aumento de la hidrólisis de GLP-1 y OXM, reduciendo su vida media y produciendo un menor efecto saciante (9). El nivel plasmático de CCK es más alto en personas obesas, a pesar de que estos pacientes no experimentan sensación de saciedad más evidente, debido a desensibilización de sus receptores en áreas cerebrales implicadas en la saciedad (10).
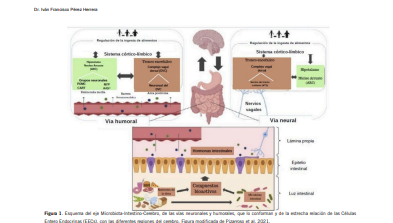
Por otra parte, los ácidos grasos de cadena corta (AGCC) son metabolitos de la microbiota producidos por la fermentación principalmente de carbohidratos complejos, pero también de proteínas no digeribles, provenientes de la dieta. Los más importantes son butirato, propionato, y acetato y están asociados a efectos antiinflamatorios, disminuyendo la acción del LPS y también reducen la ingesta de alimentos mediante la señalización intracelular para la liberación de péptidos anorexígenos. Se ha demostrado además que el butirato y el propionato tienen un papel protector contra obesidad inducida por la dieta y la resistencia a la insulina (11). Receptores para AGCC se encuentran en las neuronas, lo que sugiere una estimulación directa en los nervios aferentes vagales a nivel intestinal (12).
También es importante tener en cuenta la posibilidad de que nuestra microbiota juegue un papel preponderante en la elección de los alimentos por parte de su hospedador. Esta hipótesis ha sido estudiada y sugiere que la microbiota influiría en su hospedador para elegir los alimentos en los que se especializa el metabolismo de esta microbiota. Una Hipótesis alternativa, es que los antojos de alimentos específicos son el resultado de escasez de micronutrientes, y justifica lo contrario de la primera hipótesis: preferencia por alimentos ricos en micronutrientes que habían faltado en la dieta del hospedador (13).
Por otra parte, ciertas proteínas bacterianas se han relacionado con la señalización de la saciedad. Informes recientes
encontraron que la proteasa caseinolítica B (ClpB), una proteína relacionada con la defensa de la bacteria ante el shock por calor y que es producida por algunas Enterobacterias, tiene una conformación estructural que mimetiza al neuropéptido anorexígeno, hormona estimulante de melanocitos o alfa-MSH, estimulando la secreción de PYY entre otras acciones, produciendo un efecto en el aumento de la saciedad y disminución asociada del índice de masa corporal (14).
Probióticos y su papel en el tratamiento de la obesidad, el sobrepeso y el síndrome metabólico
Los probióticos, se definen como microorganismos vivos, que, cuando se administran en concentraciones adecuadas, son capaces de producir efectos benéficos en la salud de la persona que los consume, según la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) y la Organización Mundial de la Salud (OMS) (15).
Estos probióticos han sido empíricamente seleccionados para su uso extensivo en alimentos fermentados durante siglos y por su seguridad histórica. Por el contrario, debido a esta amplia definición, su uso se ha generalizado, haciéndolos menos efectivos contra enfermedades específicas (16). Desde entonces, numerosos estudios se han publicado con el fin de
demostrar los beneficios de los probióticos en una extensa lista
de trastornos y/o enfermedades.
Los probióticos tradicionales correspondientes a cepas o especies en general pertenecen aa los géneros Lactobacillus y Bifidobacterium. Estos probióticos han sido estudiados en trastornos relacionados con la obesidad con resultados clínicos contradictorios, posiblemente por las diferencias en microbiota basal de cada individuo y a la heterogeneidad de las poblaciones ensayadas, las cepas y las dosis utilizadas.
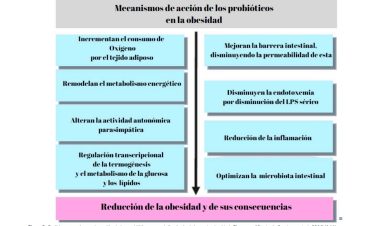
Algunos mecanismos sugeridos mediante los cuales los probióticos mejoran la salud intestinal y reducen los trastornos metabólicos relacionados con la obesidad son los siguientes (figura 2):
- Inmunomodulación a favor de respuestas antinflamatorias o Treg (T reguladora), correlacionado positivamente con la salud intestinal y negativamente con obesidad y diabetes.
- Disminución de la endotoxemia metabólica, a través de la mejora de la función de barrera del intestino.
- Aumento de las señales de saciedad intestinal a través del péptido YY o reducción de Ghrelina.
- Mejora de la acción de la insulina aumentando Secreción de GLP-1.
- Reducción de la adipogénesis, inflamación de bajo grado, sensación de hambre, por síntesis de ácidos grasos de cadena corta (17).
A continuación, describiré los diferentes tipos de probióticos existentes en la actualidad, la evidencia científica que soporta
su uso en pacientes con sobrepeso u obesos, sus posibles mecanismos de acción y sus posibles usos a futuro. En esta entrega haremos referencia exclusivamente a los probióticos clásicos y en la próxima entrega nos referiremos a los probiótico de siguiente generación y a los denominados “Probióticos de precisión”.
Probióticos clásicos
La administración de cepas probióticas específicas tales como como Lacticaseibacillus rhamnosus y Lactobacillus gasseri tienen efectos beneficiosos demostrados sobre la obesidad con disminución del IMC (Índice de Masa Corporal) y grasa visceral ysubcutánea, tanto en sobrepeso como en sujetos obesos (18). Además, cepas de Lactiplantibacillus plantarum y Lacticaseibacillus paracasei se han asociado con delgadez, en comparación con otras, como Limosilactobacillus reuteri que se ha asociado con obesidad. Todo esto confirma que los efectos fisiológicos de los probióticos son altamente dependientes de la especie o cepa (19).
A continuación, se indican algunos estudios clínicos y preclínicos de interés, donde se ensayó el uso de probióticos en sujetos obesos y los resultados obtenidos. Sharafedtinov en 2013, publico un estudio en sujetos con dieta restringida en calorías (1500 kcal por día) suplementado con queso (50 g
por día) que contiene el probiótico L. plantarum TENSIA (8,7×1010 UFC por g) durante tres semanas. Se observó una reducción significativa del IMC en pacientes con obesidad e hipertensión, comparados con el grupo de control (pacientes alimentados con dieta restringida en calorías, complementado con queso sin este probiótico). El estudio sugirió que la suplementación de queso probiótico asociado a una dieta de restricción calórica reduce el IMC y la hipertensión en sujetos de estudio (20).
Jung et al. realizaron un estudio, con adultos con sobrepeso u obesidad, los cuales fueron suplementados con L. gasseri BNR17 (1010 UFC por cápsula; 6 cápsulas por día), una cepa probiótica aislada de la leche materna humana, administrada durante 12 semanas y midieron los cambios en la masa corporal, la grasa corporal, el comportamiento y ciertos parámetros bioquímicos, en cuatro tiempos de muestreo (0, 4, 8 y 12 semanas de intervención). Los resultados sugirieron que la suplementación de BNR17 redujo el peso corporal, la circunferencia de la cadera y la cintura comparado con el grupo placebo y no se observaron efectos adversos. El estudio sugirió que la intervención con esta cepa, redujo el peso corporal en personas obesas (21).
En otro estudio (Halkjaer et al) realizado con mujeres obesas embarazadas de 14 a 20 semanas de edad gestacional, realizó una suplementación con Vivomixx (una mezcla de Bifidobacterium longum DSM 24736, Bifidobacterium breve DSM 2472, Bifidobacterium infantis DSM 24737, Streptococcus thermophilus, DSM 24731, Lactobacillus delbrueckii subsp bulgaricus DSM 24734, Lactobacillus acidophilus DSM 24735, L. paracasei DSM 24733, y L. plantarum DSM 24730; 4,5 × 1010 UFC en total) hasta el momento del parto. La administración de esta mezcla probiótica redujo significativamente el aumento de peso durante el período de embarazo y redujo las complicaciones del embarazo (22). Otros estudios han encontrado que la suplementación con probióticos multicepa mejora los parámetros cardio-metabólicos y permeabilidad intestinal en mujeres posmenopáusicas obesas (23). En otro estudio (Minami et al.) realizado en adultos con sobrepeso, que fueron suplementados con B. breve B-3 (5 × 1010 UFC por día) durante 12 semanas, se midieron varios parámetros en la bioquímica sanguínea y el nivel de adiposidad. Los resultados indicaron que la suplementación con B-3 redujo la masa grasa y también mejoró los parámetros sanguíneos asociados a la función hepática y grado de inflamación en adultos con sobrepeso (24).
La suplementación de Bifidobacterium animalis ssp. lactis
420(B420) (1010 UFC por día) con o sin fibra (Litesse Ultra polidextrosa,12 g por día) durante 6 meses, redujo significativamente la masa grasa en adultos con sobrepeso y obesos. La reducción del nivel de zonulina en sangre se relacionó con los cambios en la masa grasa del tronco. Los resultados del estudio revelaron también que la suplementación de B420 sin adición de fibra, fue suficiente para reducir la grasa corporal en sujetos estudiados (25). La influencia de la suplementación del yogur probiótico (PY) y yogur regular bajo en grasa (LFY) se ha estudiado en mujeres obesas y con sobrepeso (Madjd et al.). El consumo de PY (que contiene B. lactis BB12 y L. acidophilus LA5; 107 UFC por día) durante 12 semanas, junto con la dieta regular no ha influido en la reducción de peso, pero si mejora el perfil lipídico y la sensibilidad a la insulina en las mujeres obesas y con sobrepeso (83). La suplementación de la mezcla de probióticos (L. rhamnosus DSMZ 21690 (2 × 109 UFC), L. acidophilus ATCCB3208 (3 × 109 UFC), Bifidobacterium bífidum ATCC SD6576 (2 × 109 UFC), y B. lactis DSMZ 32269 (6 × 109 UFC) por día, por 12 semanas,mejoró el perfil hepático en niños y adultos obesos con enfermedad de hígado graso no alcohólico. Los niveles de colesterol LDL, triglicéridos (TG) y medida de la circunferencia de la cintura, también se redujeron con un nivel notable, mientras que el peso corporal, el IMC y la masa grasa no cambiaron (26).
Otro estudio (De Lorenzo et al.) con probióticos multicepa de efectos reconocidos en el SNC (psicobióticos), se realizó en mujeres con peso normal, obesidad de peso normal, sobrepeso y obesidad, durante tres semanas. La fórmula probiótica consistió en 1,5 ×1010 UFC de B. bífidum SGB02, B. animalis subsp. lactis SGB06, S. thermophilus SGSt01, S. termófilos,
L. plantarum SGL07, L. delbrueckii spp. bulgaricus DSM 20081, L. reuteri SGL01, L. acidophilus SGL11, y Lactococcus lactis subsp. lactis SGLc01. La suplementación redujo significativamente el IMC, la grasa corporal total, puntuaciones psicopatológicas en diferentes pruebas, sobrecrecimiento bacteriano, mientras mejoraba la masa grasa libre, el meteorismo, y frecuencia de defecación en obesos, pacientes con sobrepeso y de peso normal, en comparación con la línea de base (27).
Un estudio realizado en pacientes con obesidad severa que se sometieron a Anastomosis-Bypass Gástrico o Mini Bypass Gástrico (OAGB-MGB), se complementaron con una preparación probiótica, 4 semanas antes de la cirugía, hasta 12 semanas después de esta.
La fórmula multicepa llamada Familact, contiene L. casei
(3,5×109 UFC), L. rhamnosus (7.5×108 UFC), L. bulgaricus
(108 UFC), L. acidophilus (109 UFC), B. breve (1010 UFC), B. longum (3,5×109 UFC), y S. thermophilus (108 UFC) y fructooligosacárido (38,5 mg). Tras 16 semanas de suplementación, la eficiencia de la pérdida de peso, las medidas antropométricas, el estado de vitamina D, y otros marcadores inflamatorios mejoraron significativamente en el grupo de pacientes OAGB-MGB, sin afectar el folato, vitamina B12 y niveles de homocisteína (28).La influencia de la suplementación B. animalis subespecie lactis CECT 8145 vivos o pasteurizados, sobre el estado de salud de personas obesas, ha sido reportada por el grupo Valls. El estudio reveló que el consumo de 1010 UFC de células vivas al día, del probiótico estudiado, redujo significativamente el IMC, grasa visceral, índice de conicidad, circunferencia de la cintura y relación circunferencia de la cintura/altura y aumentó la población de Akkermansia spp.en el grupo de los adultos obesos (29). La suplementación de Bifidobacterium CECT pseudocatenulatum 7765 (109-1010 UFC por día durante 13 semanas) redujo significativamente el IMC y aumentó el nivel de omentina-1 y Lipoproteínas de Alta Densidad (HDL) en niños obesos. El análisis de la microbiota reveló que la suplementación de CECT 7765 aumentó los Alistipes en el grupo de sujetos estudiados. El estudio afirmó que los efectos positivos de la CECT 7765 se atribuyeron al aumento de los miembros de la familia Rikenellaceae, los cuales se asocian con un fenotipo delgado (30).
El impacto de la suplementación con probióticos en personas obesas se ha asociado a variosfactores como, la naturaleza de la cepa probiótica, la composición de la fórmula probiótica (mono o multicepa) con o sin prebióticos, la duración de la intervención, dosis y otros elementos adicionales como restricciones calóricas /dietéticas y el uso de medicamentos simultáneamente con los probióticos, etc. Un Metaanálisis reciente, informó que la suplementación con probióticos no se asoció con pérdida de peso en personas obesas, lo que puede deberse al bajo número de artículos elegidos para el análisis, en función de los criterios de selección (ensayos controlados aleatorizados); heterogeneidad en cepas y dosis de probiótico; control (placebo o ninguna suplementación con probióticos), entre otros (31). Sin embargo, un informe posterior, basado en un metaanálisis de 25 ensayos clínicos, con 1931 sujetos obesos, reveló que la suplementación con probióticos redujo efectivamente el peso corporal. El estudio también reveló que un mínimo de 8 semanas de intervención probiótica multicepa, redujo el peso corporal en sujetos obesos de manera significativa, comparado con la intervención de cepa única y menos tiempo de duración del tratamiento (32). Una
reciente revisión sistemática y metaanálisis de 15 ensayos clínicos con 957 sujetos, reveló que la intervención de la suplementación con probióticos durante 3 a 12 semanas redujo significativamente el peso corporal y masa grasa en sujetos obesos en comparación con el grupo placebo (33).
La actividad anti obesogénica de la suplementación con probióticos puede estar asociada a la capacidad de remodelar el metabolismo energético, alterar la expresión de genes relacionados con la termogénesis, metabolismo de la glucosa, y genes del metabolismo lipídico, mejorar la barrera intestinal, reducir la liberación de endotoxinas, reducir la inflamación y cambiar la actividad nerviosa parasimpática, entre otros posibles mecanismos de acción (figura 2).
Es de vital importancia al terminar de leer esta revisión, entender de manera clara que el intestino, la microbiota y el cerebro se comunican de manera directa, ya sea por vías anatómicas, metabólicas, hormonales e inmunes, que esta comunicación es bidireccional y que afecta de manera positiva o negativa a los órganos implicados y por ende al huésped, que el microbioma juega un papel determinante en nuestros hábitos alimentarios y en la regulación de nuestro peso y del perfil metabólico y que cuidando este microbioma de
manera correcta, con una adecuada alimentación, hábitos de vida saludables y el empleo de ciertos probióticos que cuenten con un nivel de evidencia sólido, podemos obtener óptimos resultados en salud para la prevención y el tratamiento de la obesidad, el sobrepeso y el síndrome metabólico.
Los invito desde ya a no perderse la última entrega de esta serie, acerca del microbioma, la obesidad y el síndrome metabólico, en donde revisaremos el papel de los probióticos “Next Generation” y de los “Probióticos de Precisión”, en el manejo de estas patologías.
Referencias bibliográficas
- 1. Weltens N, Iven J, Van Oudenhove L, Kano M. The gut–brain axis in health
- neuroscience: Implications for functional gastrointestinal disorders and appetite regulation.
- Ann. N. Y. Acad. Sci. 2018, 1428, 129–150.
- 2. Crespo M, González Matías L, Lozano M, Paz S.F. et al. Gastrointestinal hormones in
- food intake control. Endocrinol. Nutr. 2009, 56, 317–330.
- 3. Spreckley E, Murphy K. The L-Cell in Nutritional Sensing and the Regulation of
- Appetite. Front. Nutr. 2015, 2, 23.
- 4. Calzada R, Altamirano-Bustamante N, Ruiz-Reyes M. Reguladores neuroendocrinos y
- gastrointestinales del apetito y la saciedad. Bol Med Hosp Infant Mex. 2008, 2008, 65(6),
- 468-487.
- 5. Page A, Symonds E, Peiris M, Blackshaw L, Young R. Peripheral neural targets in
- obesity. Br. J. Pharmacol. 2012, 166, 1537–1558.
- 6. Darcel N, Liou A, Tomé D, Raybould H. Activation of Vagal Afferents in the Rat
- Duodenum by Protein Digests Requires PepT1. J. Nutr. 2005, 135, 1491–1495.
- 7. Berthoud H. Vagal and hormonal gut-brain communication: From satiation to
- satisfaction. Neurogastroenterol. Motil. 2008, 20, 64–72.
- 8. Le Roux C, Batterham R, Aylwin S, Patterson M, Borg C. et al. Attenuated peptide YY
- Reléase in obese subjects is associated with reduced satiety. Endocrinology. 2006, 147, 3–8.
- 9. Barja-Fernandez S, Leis R, Casanueva F, Seoane L. Drug development strategies for
- The treatment of obesity: How to ensure efficacy, safety, and sustainable weight loss. Drug
- Des. 30 Devel. Ther. 2014, 8, 2391–2400.
- 10. Baranowska B, Radzikowska M, Wasilewska-Dziubinska E, Roguski K, Borowiec M.
- Disturbed release of gastrointestinal peptides in anorexia nervosa and in obesity. Diabetes
- Obes. Metab. 2000, 2, 99–103.
- 11. Lin H, Frassetto A, Kowalik, E, Nawrocki A, Lu M. et al. Butyrate and propionate
- protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor
- 3- independent mechanisms. PLoS ONE 2012, 7, e35240.
- 12. Portune K.J, Benítez-Páez A, Del Pulgar E, Cerrudo V, Sanz,
Y. Gut microbiota, diet, and obesity-related disorders—The good, the bad, and the future challenges. Mol. Nutr. Food Res. 2017;(61):1600252.
- 13. Zuk, M. (2013). Paleofantasy: What evolution really tells us about sex, diet, and how
- we live.
- 14. Dominique M, Breton J, Guérin C, Bole-Feysot C, Lambert
G. et al. Effects of
- macronutrients on the in vitro production of ClpB, a bacterial mimetic protein of-MSH and
- its possible role in satiety signaling. Nutrients 2019, 11, 2115.
- 15. Food and Agriculture Organization; World Health Organization Expert Consultation.
- Evaluation of Health and Nutritional Properties of Powder Milk and Live Lactic Acid
- Bacteria. Córdoba, Argentina: Food and Agriculture Organization of the United Nations
- and World Health Organization. 2001. Available online:
- ftp://ftp.fao.org/es/esn/food/probio_report_en.pdf (accessed on 8
February 2021).
- 16. Chang C, Lin T, Tsai Y, Wu T, Lai W, et al. Next Generation Probiotics in disease
- amelioration. J. Food Drug Anal. 2019, 27, 615–622.
- 17. Shen W, Gaskins HR, McIntosh MK. Influence of dietary fat on intestinal microbes, inflammation, barrier function and metabolic outcomes. J Nutr Biochem. 2014;(25):270–80.
- 18. Delzenne N, Neyrinck A, Cani P. Modulation of the gut microbiota by nutrients with
- prebiotic properties: consequences for host health in the context of obesity and metabolic
- syndrome. Microb Cell Fact. 2011, 10(Suppl 1):S10.
- 19. Million M, Maraninchi M, Henry M, Armougom F, Richet H, Carrieri P, et al. Obesity-
- associated gut microbiota is enriched in Lactobacillus reuteri and depleted in
- Bifidobacterium animalis and Methanobrevibacter smithii. Int J Obes. 2012, 36, 817–25.
- 20. Sharafedtinov K, Plotnikova O, Alexeeva R, et al. Hypocaloric diet supplemented with
- probiotic cheese improves body mass index and blood pressure indices of obese
- hypertensive patients a randomized double-blind placebocontrolled pilot study. Nutrition
- Journal. 2013, 12, 138.
- 21. Jung S, Lee K, Kang J, et al., “Effect of Lactobacillus gasseri BNR17 on overweight
- and obese adults: a randomized, double-blind clinical trial,” Korean Journal of Family
- Medicine. 2013, 34(2), 80-89.
- 22. Halkjaer S, Nilas L, Carlsen E, et al. Effects of probiotics (Vivomixx) in obese pregnant
- women and their newborn: Study protocol for a randomized controlled trial. Trials, 17, 491.
- 23. Szuli ́nska M, Łoniewski I, vanHemert S, Sobieska M, Bogda
́nski P. Dose-dependent
- effects of multispecies probiotic supplementation on the lipopolysaccharide (LPS) level and
- cardiometabolic profile in obese postmenopausal women: a 12- week randomized clinical
- trial. Nutrients, 2018, 10, 773.
- 24. Minami J, Kondo S, Yanagisawa N, et al., Oral
administration of Bifidobacterium breve
- B-3 modifies metabolic functions in adults with obese tendencies in a randomised
- controlled trial. Journal of Nutritional Science, 2015. 4, e17.
- 25. Stenman L, Lehtinen M, Meland N, et al. Probiotic with or without fiber controls body
- fat mass, associated with serum zonulin, in overweight and obese adults—randomized
- controlled trial. EBioMedicine, 2016,13, 190–200.
- 26. Madjd A, Taylor M, Mousavi N, et al. Comparison of the effect of daily consumption
- of probiotic compared with low fat conventional yogurt on weight loss in healthy obese
- women following an energy-restricted diet: a randomized controlled trial. Am. J. Clin.
- Nutr. 2016, 103(2), 323–329.
- 27. De Lorenzo A, Costacurta M, Merra G, et al. Can psychobiotics intake modulate
- psychological profile and body composition of women affected by normal weight obese
- syndrome and obesity? A double blind randomized clinical trial. Journal of Translational
- Medicine. 2017, 15(1), 135.
- 28. Karbaschian Z, Mokhtari Z, Pazouki A, et al. Probiotic supplementation in morbid
- obese patients undergoing one anastomosis gastric bypass-mini gastric bypass (OAGB-
- MGB) surgery: a randomized, double-blind, placebo-controlled, clinical trial. Obesity
- Surgery. 2018, 28(9), 2874-2885.
- 29. Pedret A, Valls R, Calderon-Perez R, et al. Effects of daily consumption of the
- probiotic Bifidobacterium animalis subsp. lactis CECT 8145 on anthropometric adiposity
- biomarkers in abdominally obese subjects: a randomized controlled trial. Int J Obes, 2019,
- 43, 1863–1868.
- 30. Sanchis-Chordá J, Gómez del Pulgar E, Carrasco-Luna J,
Benıtez-Paez A, Sanz Y, et al.
- “Bifidobacterium pseudocatenulatum CECT 7765 supplementation improves inflammatory
- status in insulin-resistant obese children, European Journal of Nutrition. 2018, 58.
- 31. Park S, Bae J. Probiotics for weight loss: A systematic review and meta-analysis.
- Nutrition Research, 2015, 35(7), 566–575.
- 32. Zhang Q, Wu Y, Fei X. Effect of probiotics on body weight and body-mass index: a
- Systematic review and meta-analysis of randomized, controlled trials. International Journal
- of Food Sciences and Nutrition, 2016, 67(5), 571–580.
- 33. Borgeraas H, Johnson L, Skattebu J, Hertel J, Hjelmesæth
J. Effects of probiotics on
- body weight, body mass index, fat mass and fat percentage in subjects with overweight or
- obesity: a systematic review and meta-analysis of randomized controlled trials. Obesity
- Reviews vol. 2018, 19(2), 219-232.







No comments! Be the first commenter?