Dolor de miembros inferiores en personas viviendo con VIH:aspectos clínicos, fisiopatológicos y utilidad de la pregabalina
Resumen
Existe una alta prevalencia de dolor de miembros inferiores en personas que viven con el VIH (PVVIH), que, a menudo, es resistente a los clásicos antiinflamatorios que pueden generar interacciones farmacológicas con la terapia antirretroviral (TAR- GA) y se presenta de forma conjunta con comorbilidades psiquiátricas. Nuestro objetivo fue evaluar la eficacia clínica de la pregabalina para el dolor en miembros inferiores producido por la polineuropatía sensitiva distal asociada con el VIH y sus co- morbilidades, según el estadio de la enfermedad. Reportamos 72 personas viviendo con VIH en tratamiento con TARGA, carga viral negativa y con dolor en miembros inferiores (24 casos con trastorno del estado del ánimo comórbido), y tratamiento con pregabalina indicado tanto para patologías como para la adicción a opioides y a ansiolíticos. Aplicamos escalas para evaluar la implementación farmacológica, la evaluación del dolor y las actividades de la vida diaria. Encontramos que la pregabalina fue eficaz para el tratamiento del dolor de las extremidades inferiores en PVVIH y de los síntomas comórbidos con una mejor respuesta clínica en las primeras etapas de la enfermedad.
Palabras clave
VIH – Dolor – Polineuropatía – Pregabalina.
MJ Mazzoglio y Nabar, M Muñiz, CA Montivero, M García, G Schrarier. “Dolor de miembros inferiores en personas viviendo con VIH: aspectos clínicos, fisiopatológicos y utilidad de la pregabalina”. Psicofarmacología 2021;126:4-14.
Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El dolor es una vivencia compleja que está determinada por la acción de neuroquímicos sobre neuronas sensoriales
y por el significado subjetivo asignado por el paciente a es- tos estímulos, acorde con su historia, marco sociocultural y aprendizaje asociado con situaciones anteriores. La International Association for the Study of Pain lo define como una “experiencia sensorial y emocional no placentera asociada con daño tisular actual o potencial, o descrita en términos de ese daño” (3).
Existe una alta prevalencia de dolor de miembros inferiores en pacientes VIH+, aunque muy heterogénea según los reportes (desde el 21 % al 60 %). Esta estaría relacionada tanto con el estadio clínico de la enfermedad como con al- gunas drogas antirretrovirales. Las neuropatías periféricas son las complicaciones más frecuentes que presentan las personas que viven con VIH (19). Desde el ingreso de la terapia antirretroviral de gran actividad (TARGA), muchos pacientes negativizados con sus regímenes estables de fármacos tienen una expectativa de vida similar a quienes no están infectados y tienen una alta calidad de vida (con pequeñas adaptaciones); sin embargo, al menos una de cada dos PVVIH pueden desarrollar la polineuropatía sensitiva distal (PSD).
El dolor que conlleva el cuadro es, frecuentemente, resistente a los antiinflamatorios y a los opiáceos, y se acompaña de comorbilidades psiquiátricas como ansiedad y depresión reactivas (6, 24, 42, 43). Su manejo inadecuado y el de sus patologías asociadas conllevan importantes consecuencias fisiológicas, psicológicas, socioeconómicas y administrativas en los servicios de salud (20, 28, 34, 37).
Objetivo
Reportar la eficacia clínica de la pregabalina para el dolor en miembros inferiores de pacientes con VIH+ y sus comor- bilidades, acorde con el estadio de la enfermedad.
Materiales y métodos
Reporte de casos sobre 72 masculinos VIH+, promedio de edad 42,7 años (mín=26; máx=67), tiempo promedio de enfermedad de 14,1 años, en tratamiento antirretroviral (análogos de nucleósidos e inhibidores no nucleosídicos) mayor a 8 años, cargas virales negativizadas (<40 copias/ml) desde hace más de 6,5 años, con diagnóstico de trastorno por dolor en miembros inferiores compatible con polineuropatía sensitiva distal (39 casos con comorbilidad con trastorno del estado del ánimo).
Los pacientes consultaron por derivación de sus infectó- logos y para realizar un tratamiento interdisciplinario y con- junto de su patología dolorosa. Se evaluaron psiquiátrica, clínica e infectológicamente con estudios bioquímicos. Se indicó pregabalina para tratamiento de ambos cuadros y para la deshabituación de opioides (14 casos) y de ansiolíticos (21 casos). Fueron criterios de exclusión las causas del dolor de origen vascular, neuropáticas por compresión o traumatológicas.
Se aplicaron escalas para evaluar lo siguiente: la imple-
mentación farmacológica –HAD (Hospital Anxiety and De- pression Scale) (64), HDRS (Hamilton Depression Rating Scale) (23), MADRS (Montgomery-Asberg Depression Rating Scale) (38)–, el dolor –EVD (Escala Verbal del Dolor), EAV (Analógica Visual), EGD (Gráfica) (28)– y las actividades de la vida diaria –Índice de Barthel (33) y EEAG (Escala de Evaluación de la Actividad Global) (2)–.
Las escalas fueron implementadas al inicio del tratamien- to y a los 7, 15, 30, 45, 60 y 90 días. Se realizó, de esta for- ma, un seguimiento de la implementación de la droga y de su efecto clínico por el término de 90 días (3 meses de uso). Los resultados fueron sometidos a pruebas de estadística descripta e inferencial, y se cumplimentaron con los requisi- tos ético-legales vigentes (consentimiento informado, cum- plimiento de requisitos estipulados por las GCP, Disposición ANMAT 6677/10 y adhesión a principios éticos con origen
en la Declaración de Helsinki).
Resultados
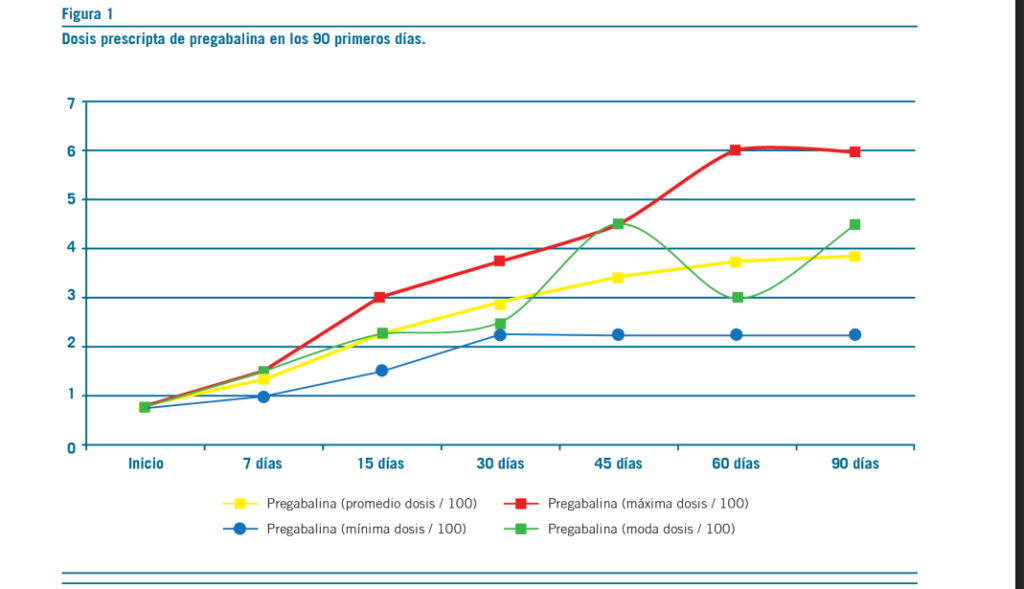
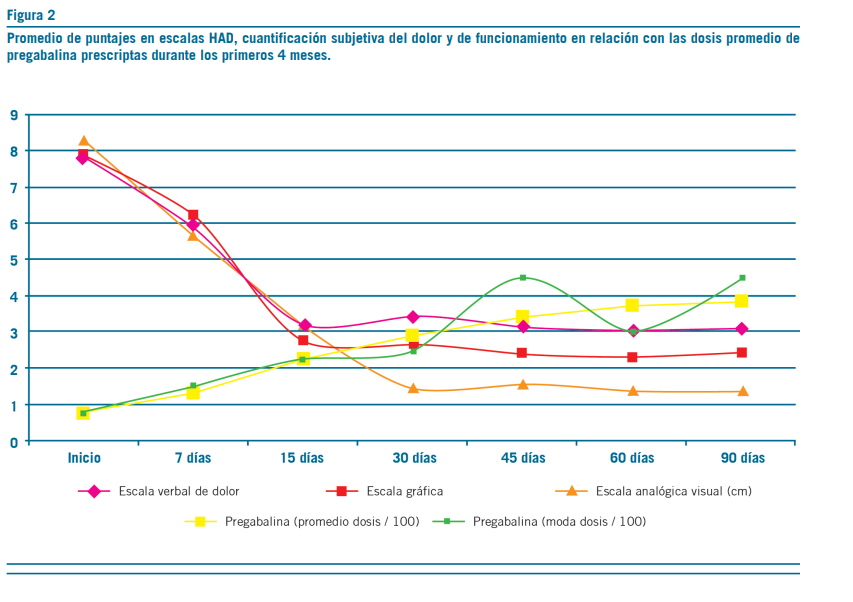
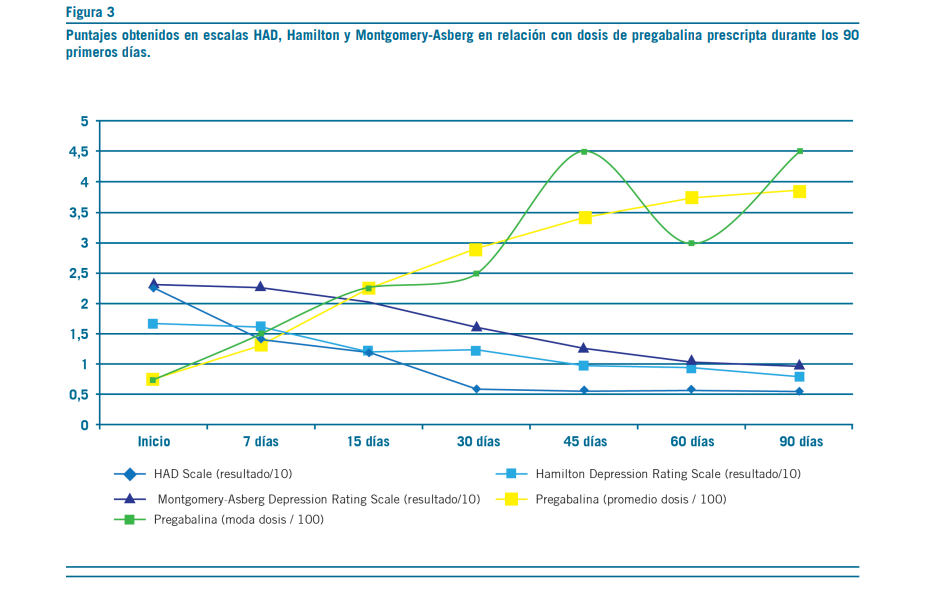
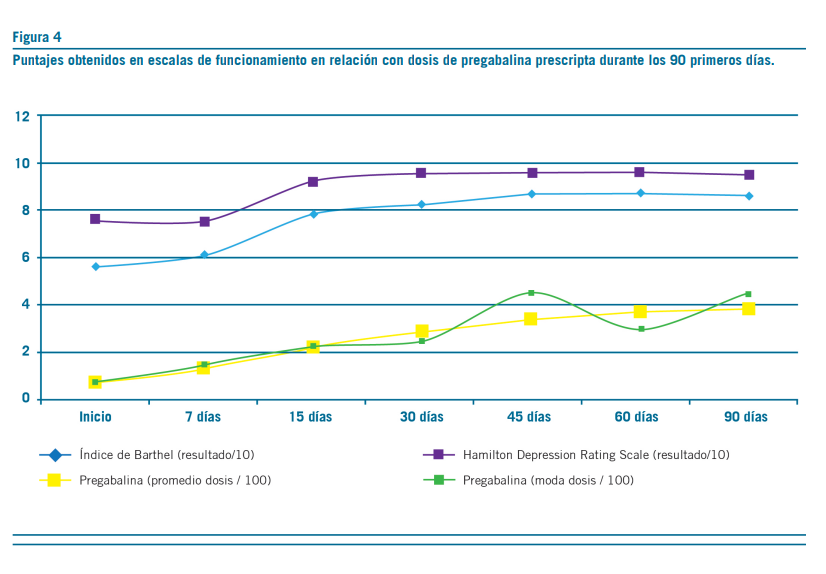
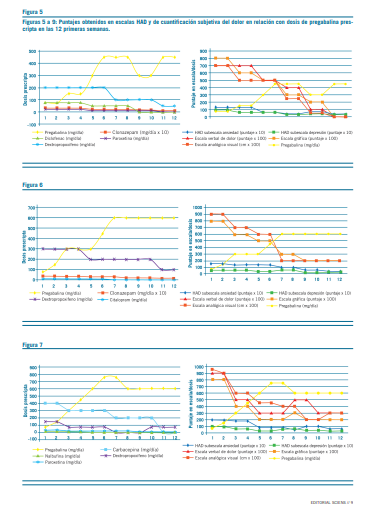
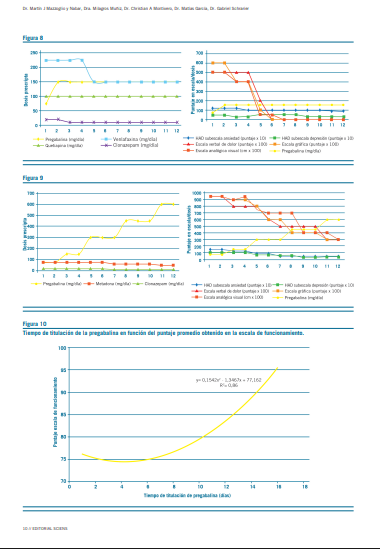
La pregabalina resultó efectiva en la reducción del dolor, aproximadamente, a los 18 días de tratamiento con dosis promedio de 250 mg/d (mín=150 mg/d; máx=450 mg/d) (Figura 1). Secundariamente, esta redujo la sintomatología ansiosa –acorde con escalas subjetivas de dolor y ansiedad
(Figuras 2 y 3)–, permitió discontinuar los antidepresivos ISRS y deshabituar los opioides, sin registrar interacciones con antirretrovirales ni efectos adversos (clínicos o bioquí- micos) (Figuras 5 al 9). La implementación de pregabalina fue proporcional a la mejora en el puntaje de escalas de funcionamiento (Figura 4). El tiempo de titulación de la pre- gabalina fue proporcional a la mejoría en las escalas de fun- cionamiento (r2=0,86) (Figura 10). La efectividad temporal de la pregabalina, la disminución de las escalas de dolor y las tasas de mejoría en las actividades de la vida diaria pre- sentaron asociación con la etapa de la enfermedad, pero no con los años ni con la etapa vital de la infección.
Discusión
Las complicaciones del VIH frecuentemente impactan en el sistema nervioso. Ocurren en todos los estadios de la enfermedad y son poco reconocidas (52). Muchos de esos trastornos aumentaron su prevalencia y difusión con el uso de la TARGA, debido al aumento de la expectativa de vida. Las etiologías de las complicaciones son variables: algunas por la acción del virus per se, otras son enfermedades oportunistas, otras comórbidas y otras se deben a la TARGA o a otras medicaciones. Las enfermedades neurológicas conllevan un significativo dolor y discapacidad que pueden exacer-
bar cuadros psiquiátricos en los que su abordaje terapéutico es muy dificultoso. La detección temprana y su tratamiento adecuado pueden mejorar la calidad de vida.
En relación con el diagnóstico de las complicaciones neu- rológicas del VIH, el médico debe prestar especial atención a los síntomas, que pueden ser aislados (cefalea, zumbidos, claudicación motora, dolor, cambios visuales), y a través de su estudio podrá encontrar el origen y la localización anató- mica. Los estudios complementarios sirven para confirmar la sospecha anatómica y, en este caso, incluyen el estudio del líquido cefalorraquídeo, de la conducción nerviosa, la electromiografía, las neuroimágenes y las biopsias de mús- culo y de nervio.
Los efectos del VIH y sus complicaciones en la médula o en el sistema nervioso periférico se asocian con los siguien- tes síndromes clínicos: polineuropatía sensitiva distal, po- lineuropatía inflamatoria desmielinizante, mononeuropatía múltiple, polirradiculopatía progresiva, neuropatía autonó- mica, miopatía, mielopatía y otras enfermedades neuromus- culares.
Polineuropatía sensitiva distal y VIH
La polineuropatía sensitiva distal (PSD) es la complicación más común de la infección por VIH. En estudios iniciales se describió una prevalencia del 30-40 % (57), pero los datos del Manhattan HIV Brain Bank sugirieron que la prevalencia podría alcanzar el 58 % en PVVIH con estadios avanzados de la infección (39). Es una patología que presenta mayor frecuencia en pacientes con otros factores de riesgo para neuropatías como la diabetes, el uso problemático de alcohol, deficiencia de vitamina B12 y trastornos de etiología nutricional. La coinfección con el virus de la hepatitis C (HCV, por su sigla en inglés) es un riesgo adicional que requiere un análisis especial (8).
La PSD presenta síntomas sensitivos distales simétricos y los pacientes refieren entumecimiento, dolor y sensación de quemazón en los pies y en la pierna (especialmente, en su cara posterior). En muchos casos, la sola cercanía de las sábanas en los pies puede generar dolor. Las disestesias aparecen primero en las plantas de los pies. También se presentan dificultades para caminar debido al dolor y, con el progreso de la enfermedad, los síntomas ascienden proximalmente en las extremidades (56).
Usualmente, no hay compromiso motor, aunque la debilidad de los músculos del pie puede ser un signo de enfermedad avanzada. Se han reportado casos con dolores en las yemas de los dedos y en las manos (distribución en globo) en pacientes con estadios intermedios y avanzados de la enfer-
medad (12). En el examen físico, son típicas la disminución de sensibilidad al dolor, a la temperatura y a la vibración, con preservación de la propiocepción. Los reflejos osteoten- dinosos están reducidos en los tobillos al compararlos con las rodillas (31) y la piel puede parecer brillante o sin pelo en zonas distales. Luego del inicio signo-sintomatológico, los síntomas sensitivos pueden presentar una estabilidad o cesar el progreso, pero permanecen a pesar de los intentos de tratamiento.
Los estudios electrofisiológicos describen anormalida- des en la amplitud y velocidad de conducción del nervio sensitivo, particularmente, en el nervio sural, mientras que la velocidad de conducción del nervio motor esta indemne usualmente (58). La electromiografía puede evidenciar de- nervación en músculos distales relacionada con la perdida axonal.
Como se señaló, en estudios con PVVIH previo al uso de la TARGA (56, 12, 57, 32), el 35 % tenían signos de PSD, aproximadamente. La incidencia de esta patología está aso- ciada con valores menores de 500 células/mm3 de CD4 (4, 58) y con niveles plasmáticos superiores a 30 000 copias/ ml (11). El riesgo asociado con la edad fue demostrado clí- nicamente (52) y es un factor que predispone a caídas en la tercera edad (48), así como el dolor asociado a la PSD se vinculó con una alteración en la adherencia a la TARGA. Con el uso de la TARGA, los estudios señalaron que la relación entre el valor cuantitativo de CD4 y la incidencia de
la PSD no era tan correlativa como se sostenía (49, 39). Un estudio sugirió que la toxicidad de los análogos de didesoxinucleósidos (conocidas como d-drugs) podían aumentar el riesgo de PSD en PVVIH (49). Evaluaron prospectivamente a 272 sujetos 2 veces por año durante 30 meses y el diagnós- tico de la enfermedad decreció o disminuyó a dolores inespecíficos en los tobillos, disminuyó la percepción vibratoria en los dedos de los pies o disminuyó la sensación dolorosa o de temperatura en la zona de distribución. Los sujetos fueron clasificados en PSD asintomáticos si solo tenían sig- nos neurológicos y PSD sintomáticos si además presentaban parestesias o dolor. Schifitto et al. (49) demostraron que el uso de esas drogas no presentaba un factor de riesgo significativo para el desarrollo de la PSD sintomática y señalaron sorprendentemente que la presencia de PSD asintomática no era un factor de riesgo para que el paciente presentase la forma sintomática; es decir, no es un predictor de esta. Cabe destacar que los análogos de didesoxinucleósidos están asociados con neuropatías tóxicas por fenómenos químicos de acumulación (clínicamente indistinguibles de la PSD asociada con el VIH y que serán desarrollados más adelante) y su importancia es muy significativa para el cuadro, aun- que su uso no sea el más prevalente en los regímenes de TARGA. En el 2006, el grupo encabezado por Simpson et al. evaluó, por un periodo de 48 semanas, a 101 PVVIH en estadio avanzado con exámenes neurológicos, estudios de conducción nerviosa, exámenes cuantitativos de la sensibi-
lidad y biopsia de piel para cuantificar la densidad de fibras nerviosas a nivel epidérmico. Hallaron que los factores de riesgo (valor cuantitativo de CD4, carga viral del VIH y uso de didesoxinucleósidos) no eran predictores de la progresión de la PSD, mientras que la biopsia de piel para cuantificar la densidad de fibras nerviosas en la epidermis estaba aso- ciada con la gravedad de la PSD (63).
En la patogénesis de la enfermedad, se describió la injuria axonal de nervios sensitivos en un proceso conocido como muerte distal/retrógrada (44). Si bien el mecanismo no está completamente descripto, se postula que sería multifacto- rial. Por un lado, el virus del VIH per se es un factor que contribuye en la patogenia, aunque la evidencia de acción directa viral sobre los nervios periféricos es aún pequeña. El VIH puede causar neurotoxicidad por medio de la secre- ción de la glicoproteína gp120 o mediante la liberación de citoquinas neurotóxicas o proinflamatorias desde las células gliales infectadas (25, 27). También los antirretrovirales, como la didanosina, la zalcitabina y la estavudina, son neu- rotóxicos y pueden lesionar los nervios por medio de la toxi- cidad mitocondrial que generan (55), lo cual también puede ser generado por otros fármacos utilizados en esta población por las comorbilidades (cloranfenicol, cisplatino, etambutol, isoniazida, metronidazol e interferones).
La pérdida de sensibilidad en la PSD presenta una asocia- ción directa con la pérdida de axones sensitivos. El meca- nismo fisiopatológico por el cual el daño axonal causa dolor se fundamenta en que la injuria axonal genera una vía final de expresión génica que causa un aumento en la percepción del dolor; las fibras tipo C, que responden a las señales de dolor, se tornan más excitables (disminuye el umbral) a través de un up regulation de los canales de sodio voltaje de- pendientes, y las fibras tipo A pueden expresar neuromodu- ladores que normalmente son expresados por las fibras C, lo que genera un efecto fenotípico de cambio en la conducción nerviosa del dolor. Estos input sensitivos anómalos desde los nervios periféricos aumentan la sensibilidad central y pueden incrementar la percepción del dolor (60).
El tratamiento de la PSD se basa en el abordaje de los factores comórbidos para su estabilización. En casos de pacientes en tratamiento con medicaciones neurotóxicas, su discontinuación o reducción de dosis puede mejorar o enlentecer el progreso de la PSD, aunque el profesional a cargo deberá valorar si debe continuar con dicha/s droga/s en caso de que sea requerida para el control virológico (va- loración de costo/beneficio).
Cabe destacar que no existe un tratamiento aprobado por la Administración de Medicamentos y Alimentos (FDA, por su sigla en inglés) para la PSD asociada o debida al VIH. Las estrategias de tratamiento se basan en la experiencia clínica y en resultados de investigaciones análogas, las cuales se derivan de estudios de neuropatías como la diabética o la neuralgia posherpética.
El manejo del dolor en PVVIH presenta cambios debido a la prevalencia del trastorno por consumo de sustancias y de las enfermedades psiquiátricas comórbidas. El tratamiento debe ser interdisciplinario, con la inclusión de neurólogos, psiquiatras, especialistas en dolor, infectólogos y psicólo- gos. Acorde con las normas generales para el manejo del dolor de la Organización Mundial de la Salud, cuanto mayor sea el incremento en la gravedad del dolor, el tratamiento incluirá una analgesia más fuerte, desde los antiinflamato- rios no esteroideo (AINE) hasta el uso de potentes opiáceos. Los agentes adyuvantes en combinación con analgésicos pueden proporcionar beneficios y se agrupan en dos catego- rías: antidepresivos y anticonvulsivantes. Los antidepresivos postulados incluyen la amitriptilina, la nortriptilina y la du- loxetina. Los tricíclicos fueron extensamente estudiados e indicados para el abordaje del dolor. Conllevan una sedación que usualmente es tolerada por los pacientes y la desiprami- na es la molécula que tiene menor toxicidad anticolinérgica y mejor tolerabilidad (29). En el caso de la duloxetina, con acción inhibitoria en la recaptación de serotonina y noradre- nalina, está aprobada para el tratamiento de la neuropatía diabética, pero en PVVIH se debe valorar su interacción me- tabólica con inhibidores de proteasa por medio del P450.
Los antiepilépticos utilizados en la PSD asociada al VIH
son la carbamacepina, la fenitoína, el gabapentin y la la- motrigina. Estudios controlados contra placebo demostraron resultados disímiles en la eficacia de la fenitoína para este cuadro mientras que la carbamacepina demostró eficacia para la neuralgia trigeminal (35). El mecanismo de acción que utilizan es reducir la excitabilidad neuronal por medio de la modificación de canales de sodio. Los antiepilépticos más recientes han sido utilizados de forma extensa y conti- núan en estudio. En investigaciones controladas contra pla- cebo, la gabapentina demostró eficacia para el tratamiento de la PSD y buena tolerabilidad en altas dosis (22). Por su parte, la pregabalina, aprobada para el dolor por la neuropa- tía diabética y la neuralgia postherpética, ha sido estudiada contra placebo de PVVIH con PSD con resultados muy pro- metedores (18, 62).
La lamotrigina demostró eficacia en el tratamiento de esta patología (54, 53) y, si bien tiene buena tolerabilidad, se debe comenzar con dosis pequeñas y titulación muy lenta en PVVIH, con el fin de tomar precauciones por la posibilidad de afecciones serias en la piel. El topiramato y la oxcabace- pina pueden tener un papel importante en el tratamiento de este cuadro (5, 47).
En la práctica clínica, muchos profesionales han diseñado e implementado combinaciones de analgésicos con diferen- tes mecanismos de acción para lograr mayor eficacia en el tratamiento (21).
Los agentes tópicos, parches y geles con lidocaína o la capsaicina tienen como beneficio la reducción de efectos sistémicos. En el caso de esta última, se describió que las altas concentraciones en parches dérmicos tienen resultados prometedores en la PSD de PVVIH. Abrams et al. (1) publicaron un trabajo con 50 PVVIH que presentaban dolor por neuropatía. Estos fueron randomizados entre aquellos que fumaron marihuana 3 veces al día por el término de 5 días y quienes fumaron placebo con el extracto de cannabinoides. El resultado fue que el cannabis era superior al placebo en la disminución del dolor con la limitante de que el tamaño muestral fue muy pequeño y se reportaron efectos adversos. Estudios controlados objetivaron que la acupun- tura es inefectiva (50) y otros métodos no farmacológicos como la hipnosis, el biofeedback o la terapia física no tienen evidencia científica.
Neuropatías tóxicas en PVVIH. Neuropatía asociada a los antirretrovirales
Las neuropatías tóxicas en PVVIH pueden surgir por el uso de fármacos antirretrovirales, así como por las medicaciones de uso concomitante por patologías comórbidas en esta po- blación (41).
La neuropatía asociada a los antirretrovirales es clínica y electrofisiológicamente indistinguible de la PSD asociada al VIH. Sin embargo, tiende a ser más dolorosa, de comienzo abrupto y progresión rápida (40); quizás lo más significativo es que se asocia temporalmente con el uso de los ARV.
Entre los ARV que componen la TARGA de PVVIH, solo las denominadas d-drugs (drogas d) de los inhibidores nucleó- sidos de la transcriptasa reversa se han descripto con carac- terísticas tóxicas (esto incluye a la didanosina, zalcitabina, estavudina) (61, 36, 30, 9). No obstante, muchos otros fac- tores pueden contribuir al agravamiento de la neuropatía, como el uso concomitante de alcohol y de drogas ilegales, el estado nutricional y la diabetes.
Los estudios demostraron que la incidencia de PSD aso- ciada al VIH disminuía con la TARGA, mientras que la inci- dencia de neuropatía asociada a los antirretrovirales (ARV) se incrementaba.
Según datos de la fase I y II de la molécula, la neuropatía por zalcitabina (ddC) presentó una incidencia del 25 % al 66 % (17). La incidencia, gravedad, progresión y reversibilidad de esta neuropatía es dosis dependiente. Yarchoan et al. (61) reportaron que el periodo de inicio del cuadro fue de entre 9 y 13 semanas frente a distintas dosis del fármaco. Durante la cesación de la droga, puede haber una intensificación de los síntomas hasta 3 a 6 semanas posteriores. Existe una correlación inversa entre la cantidad de CD4 y la incidencia de neuropatía asociada con esta molécula.
La neuropatía por didanosina (ddI), en estudios de fase I y II, presentó una incidencia de PSD del 12 % al 34 %. Aquellos pacientes con CD4 bajos presentaban mayor incidencia del cuadro, con un tiempo de inicio de síntomas en las primeras 20 semanas, los cuales se resolvieron dentro de las 3-5 semanas posteriores a la discontinuación de la
droga. En caso de que no se resuelva el cuadro posterior a la discontinuación, se deberían evaluar otras causas para el cuadro. En el caso de combinaciones con zidovudina, la incidencia del cuadro aumenta exponencialmente (52).
En el caso de la neuropatía por estavudina (d4t), los repor- tes señalaron una incidencia de neuropatía por esta droga que va del 6 % al 55 %. Presenta una correlación inversa entre la cantidad de CD4 y la incidencia de la neuropatía periférica, la cual es mayor en casos de intolerancia a la zidovudina.
En relación con el mecanismo de neurotoxicidad por los análogos de nucleósidos, las primeras hipótesis argumen- taban que la zalcitabina (ddC) (que contiene una citosina) interfería en la producción de esfingomielina por medio de la formación del metabolito ddC-difosfocolina (13). Sin em- bargo, similares toxicidades fueron observadas con didano- sina y estavudina, las cuales no tienen una citosina. Estu- dios in vitro llevados a cabo en animales sugirieron como mecanismo de neurotoxicidad la inhibición de la síntesis del ADN mitocondrial, particularmente, la potente inhibición de la gamma polimerasa (46, 10, 15).
Los análogos de nucleósidos, cuando se fosforilan a su forma activa de trifosfato, son incorporados en el ADN viral, lo que genera la inhibición de la transcriptasa reversa. La misma fosforilación sería usada por la gamma polimerasa del ADN mitocondrial y generaría una toxicidad en la orga- nela. En ensayos celulares, los inhibidores de la transcrip- tasa reversa presentan variaciones en el grado de inhibición del ADN mitocondrial (de menor a mayor: zalcitabina, esta- vudina, didanosina, lamivudina, zidovudina, abacavir).
En un modelo in vitro, Keswani et al. (25) demostraron la inhibición dosis dependiente de los ganglios anexos a la raíz dorsal por las d-drugs, principalmente de la zalcitabina. Dicha inhibición se relacionó con la degeneración neuríti- ca distal por la neurotoxicidad debida a la pérdida de mi- tocondrias. Patterson et al. (45) demostraron el desarrollo dosis dependiente de la mielopatía en ratas expuestas a la didanosina sobre su nervio ciático luego de 15 semanas de exposición al fármaco.
A partir de estos hallazgos los investigadores plantearon la posibilidad de un mecanismo sinérgico entre el VIH y el desarrollo de PSD asociado a los ARV (26), similar a los mecanismos planteados para la cardiomiopatía inducida por ARV. Cote y colaboradores reportaron que la acidosis láctica asociada con las d-drugs genera una mayor depleción del ADN mitocondrial con afectación de todas las cadenas quí- micas que de esta organela dependen (14).
Estudios in vivo reportaron la toxicidad mitocondrial de este grupo de fármacos. En las biopsias se objetivaron los daños mitocondriales en pacientes con análogos de nucleó- sidos asociados con neuropatía periférica. Dalakas et al. (16) hallaron tanto alteraciones estructurales mitocondriales en axones como en las células de Schwann con reducción del ADN mitocondrial en sujetos tratados con zalcitabina. Sobre esta base, algunos autores atribuyeron que la tardanza en el inicio de los síntomas de la neuropatía asociada con ARV estaría relacionada con los niveles disminuidos de ADN mitocondrial, aunque otros investigadores sugirieron que la neurotoxicidad de los análogos de nucleósidos se debe a la depleción de la acetil L carnitina, la cual promue- ve la regeneración del nervio periférico luego de injurias. La disminución de carnitina causa alteraciones en el meta- bolismo mitocondrial porque promueve la acumulación de ácidos grasos. El aumento de la dislipemia y de la diabetes promueven la toxicidad a largo plazo de los inhibidores de proteasa, que contribuyen a este cuadro.
Conclusiones
En la cohorte de pacientes estudiados, la pregabalina evidenció eficacia para el tratamiento del dolor de miem- bros inferiores en personas viviendo con VIH en tratamiento infectológico y para la sintomatología comórbida (ansiosa y deshabituación de opioides y ansiolíticos), controlando durante el periodo de mantenimiento la sintomatología por dolor y posibilitando reducir la polimedicación. El perfil de tolerabilidad, titulación y el hecho de no haber registrado interacciones farmacológicas de la molécula fue útil en el contexto de pacientes con tratamiento antirretroviral. La respuesta clínica fue mayor en los estadios iniciales de la enfermedad.
Referencias bibliográficas
- 1. Abrams DI, Jay CA, Shade SB, Vizoso H, Reda H, Press S, Kelly ME, Rowbotham MC, Pe- tersen KL. Cannabis in painful HIV associated sen- sory neuropathy. Neurology. 2007; 68:515-21.
- 2. American Psychiatric Association, APA,1987.
- 3. Australian and New Zealand College of Anaesthetists and Faculty of Pain Medicine. Acute pain management: Scientific Evidence. Second Edition; 2005.
- 4. Bacellar H, Munoz A, Miller EN, Cohen BA, Besley D, Selnes OA, Becker JT, McArthur JC. Temporal trends in the incidence of HIV-1 related neurologic diseases: multicenter AIDS cohort study, 1985-1992. Neurology. 1994;
44:1892-1900.
- 5. Beydoun A, Kobetz SA, Carrazana EJ. Efficacy of oxcarbazepine in the treatment of painful dia- betic neuropathy. Clin J Pain. 2004; 20:174-78.
- 6. Ben-Menachem E. Pregabalin pharmacolo- gy and its relevance to clinical practice. Epilep- sia. 2004; 45:13-18.
- 7. Bradley BP, Gossop M, Phillips GT, Legar- da JJ. The development of an Opiate Withdrawal Scale (COWS). Br J Addict. 1987; 82:1139- 1142.
- 8. Brew BJ. The peripheral nerve complican- tions of human immunodeficiency virus (HIV) infection. Muscle Nerve. 2003; 28:542-52.
- 9. Browne M, Mayer K, Chafee S. Didehy- dro-3´-deoxythymidine (d4T) in patients with AIDS or AIDS-related complex: a phase I trial. J Infect Dis. 1993; 167:21-9.
- 10. Chen CH, Cheng YC. Delayed cytotoxicity and selective loss of mitochondrial DNIA in cells treated with the anti-human immunodeficien- cy virus compound 2´3´-dideoxycytidine. J Biol Chem. 1989; 264:11934-7.
- 11. Childs EA, Lyles RH, Selnes OA, Chen
B, Miller EN, Cohen BA, Becker JT, Mellors J, McArthur JC. Plasma viral load and CD4 lympho- cytes predict HIV-associated peripheral neuropa- thy. Neurology. 1999; 52:607-13.
- 12. Cornblath DR, McArthur JC. Predomi- nantly sensory neuropathy in patients with AIDS and AIDS-related complex. Neurology. 1988; 38:794-96.
- 13. Cooney DA, Dalal M, Mitsuya H, McMahon JB, Nadkarni M, Balzarini J, Broder S, Johns DG. Initial studies on the cellular pharmacology of 2´3´-dideoxycytidine, an inhibitor of HTLV III in- fectivity. Biochem Pharmacol. 1986; 35:2065-68.
- 14. Cote H, Brumme B, Craib K, Math M, Alexander C, Wynhoven B, Ting L, Wong H, Ha- rris M, Harrigan R, O´Shaughnessy M, Montaner
J. Changes in mitochondrial DNA as a marker of nucleoside toxicity in HIV-infected patients. N Engl J Med. 2002; 346:811-20.
- 15. Cui L, Locatelli L, Xie MY, Sommadossi JO. Effect of nucleoside analogs on neurite re- generation and mitochondrial DNA synthesis in PC-12 cells. J Pharmacol Exp Ther. 1997; 280:1228-34.
- 16. Dalakas M, Semino-Mora C, Leon-Mon- zon M. Mitochondrial alterations with mitocon- drial DNA depetion in the nerves of AIDS pa- tients with peripheral neurophaty induced by 2´3´-dideoxycytidine (ddC). Lan Investig. 2001; 81:1537 44.
- 17. Fischl M, Olson R, Follansbee S. Zalcitra- bine compared with zidovudine in patients with advanced HIV-1 infection who received previous zidovudine therapy. Ann Intern Med. 1993; 118:762-9.
- 18. Freynhagen R, Strojek K, Griesing T, Wha- len E, Balkenohl M. Efficacy of pregabalin in neurophatic pain evaluated in a 12-week, rando- mized, double-blind, multicentre, placebo-con- trolles trial of flexible- and fixed-dose regimens.
Pain. 2005; 115:254-63.
- 19. Fuller GN, Jacobs JM, Guiloff RJ. Natu- re and incidence of peripheral nerve syndromes in HIV infection. J Neurol Neurosurg Psychiatr. 1993; 56(4):372–381.
- 20. Gala FJ, et al. Aspectos psicosociales del dolor. C Med Psicosom. 2003; 66:46-55.
- 21. Gilron I, Bailet JM, Tu D, Holden RR, Wea- ver DF, Houlden RL. Morphine, gabapentin, or their combination for neuropathic pain N Engl J Med. 2005; 352:1324-34.
- 22. Hahn K, Arendt G, Braun JS, von Gie- sen HJ, Husstedt IW, Maschke M, Straube ME, Schielke E, for the German NeuroAIDS Working Group. A placebo-controlled trial of gabapentin for painful HIV-associated sensory neuropathies. J Neurol. 2004; 251:1260-66.
- 23. Hamilton M. A rating scale for depression. J Neurol Neurosug Psychiatr. 1960; 23:56 62
- 24. Jones EG, Pons TP. Thalamic and bra- instem contributions to large-scale plasticity of primate somatosensory cortex. Science. 1998; 282:1121-1125.
- 25. Keswani SC, Chander B, Hasan C, Griffin J, McArthur J, Hoke A. FK506 is neuroprotective in a model of antiretroviral toxic neuropathy. Ann Neurol. 2003; 53:57-64.
- 26. Keswani SC, Pardo CA, Cherry CL, Hoke A, McArthur JC. HIV-associated sensory neuro- pathies. AIDS. 2002; 16:2105-17.
- 27. Keswani SC, Polley M, Pardo CA, Griffin JW, McArthur JC, Hoke A. Schwann cell chemo- kine receptors mediate HIV-1 gp120 toxity to sensory neurons. Ann Neurol. 2003; 54:287-96.
- 28. Khosravi Shahi P, del Castillo Rueda A, Pérez Manga G. Manejo del dolor oncológico. An Med Interna. 2007; 24: 554-557.
- 29. Kieburtz K, Simpson D, Yiannoutsos C, Max MB, Hall CD, Ellis RJ, Marra CM, McKenda- ll R, Singer E, Dal Pan GJ, Clifford DB, Tucker T,
Cohen B, and the AIDS Cinical Trials Group 242 Protocol Team. A randomized trial of amitriptyli- ne and mexiletine for painful neuropathy in HIV infection. Neurology. 1998; 51:1682-88.
- 30. Lambert JS, Seidlin M, Reichman RC, Plank CS, Laverty M, Morse GD, Knupp C, McLaren C, Pettinelli C. Dideoxyinosine (ddI) in patients with the acquired immunodeficiency sy- ndrome or AIDS-related complex. N Engl J Med. 1990; 322:1333-40.
- 31. Lange DJ, Britton CB, Younger DS, Hays AP. The neuromuscular manifestations of hu- man immunodeficiency virus infections. Arch Neurol. 1988; 45:1084-88.
- 32. Leger JM, Bouche P, Bolgert F, Chaunu MP, Rosenheim M, Cathala HP, Gentilini M, Hauw JJ, Brunet P. The spectrum of polyneuro- pathies in patients infected with HIV. J Neurol Neurosurg Psychiatry. 1989; 52:1369-74.
- 33. Mahoney FI, Barthel DW. Functional eva- luation: The Barthel Index. Md State Med J. 1965; 14(2):61-65.
- 34. Martinotti G et al. Pregabalin versus nal- trexone in alcohol dependence: a randomised, double blind, comparison trial. J. Psychopharm. 2009; 0: 0269881109102623v1
- 35. McQuay H, Carroll D, Jadad AR, Wiffen P, Moore A. Anticonvulsivant drugs for manage- ment of pain: a systematic review. BMJ. 1995; 311:1047-52.
- 36. Merigan TC, Skowron G, Bozzette SA, Ri- chman D, Uttamchandani R, Fischl M, Schooley R, Hirsch M, Soo W, Pettinelli C. Circulating p24 antigen levels and responses to dideoxy- cytidine in human immunodeficiency virus (HIV) infections. Ann Intern Med. 1989; 110:189-94.
- 37. Moizezowicz J, et al. Psicofarmacología psicodinámica IV: actualización 2007, 1º ed, Buenos Aires; 2007.
- 38. Montgomery SA, Asberg MA. A new de- pression scale designed to be sensitive to chan- ge. Br J Psychiatry. 1979; 134:382-389.
- 39. Morgello S, Estanislao L, Simpson D, Ge- raci A, Di-Rocco A, Gerits P, Ryan E, Yakoushi- na T, Khan S, Mahboob R, Naseer M, Dorfman D, Sharp B, for the Manhattan HIV Brain Bank. HIV-associated distal sensory polyneuropathy in the era of highly active antiretroviral therapy: the Manhattan HIV Brain Bank. Arch Neurol. 2004; 61:546-51.
- 40. Moyle GJ, Sadler M. Peripheral neuropa- thy with nucleoside antiretrovirals: risk factors, incidence and management. Drug Saf. 1998; 19:481-94.
- 41. Oshinaike O, Akinbami A, Ojo O, Ogbera A, Okubadejo N, Ojini F, Danesi M. Influence of age and neurotoxic HAART use on frequency of HIV sensory neuropathy. AIDS Res Treat. 2012; 961510.
- 42. Oteo-Alvaro A, Pérez Caballer A, Gó- mez-Castresana F. Tratamiento farmacológico del síndrome doloroso regional complejo de las extremidades como causa de dolor neuropático. Rev Clin Esp. 2004; 204(9):486-94.
- 43. Pae Chi Un, et al. Pregabalin augmen- tation of antidepressants in patients with ac- cident-related postraumatic stress disorder: an open label pilot study. Int Clin Psychopharma- col. 2009; 24(1):29-33.
- 44. Pardo CA, McArthur JC, Griffin JW HIV neuropathy: insight in the pathology of HIV pe- ripheral nerve disease. J Peripher Nerv Syst. 2001; 6:21-7.
- 45. Patterson T, Schmued L, Sandberg J, Sli- kker JW. Temporal development of 2’3’ dideox- yinosine (ddI)-induced peripheral myelinopathy. Neurotoxicol Teratol. 2000; 22:429-34.
- 46. Pezeshkpour G, Krarup C, Buchthal F, DMauro S, Bresolin N, McBurney J. Peripheral neuropathy in mitochondrial disease. J Neurol Sci. 1987; 77:285-304.
- 47. Raskin P, Donofrio PD, Rosenthal NR, Hewitt DJ, Jordan DM, Xiang J, Vinik AI, fot CAPSS-141 Study Group. Topiramate vs place- bo in painful diabetic neuropathy: analgesis and metabolic effects. Neurology. 2004; 63:865-73.
- 48. Richardson JK, Hurvitz EA. Peripheral neuropathy: a true risk factor for falls. J Geron- tol. 1995; 50:M211-5.
- 49. Schifitto G, McDermott M, McArthur J, Marder K, Sacktor N, Epstein L, Kieburtz K. Incidence of and risk factors for HIV-associated distal sensory polyneuropathy. Neurology. 2002; 58:1764-68.
- 50. Shlay JC, Chaloner K, Max MB, Flaws B, Reichelderfer P, Wentworth D, Hillman S, Brizz B, Cohn DL. Acupuncture and amitriptyline for pain due to HIV-related peripheral neuropathy: a randomized controlled trial. JAMA. 1998; 280:1590-95.
- 51. Simpson DM, Kitch D, Evans SR, McAr- thur JC, Asmuth DM, Cohen B, Goodkin K, Gerschenson M, So Y, Marra CM, Diaz-Arrastia R, Shriver S, Millar L, Clifford DB, and ACTG A5117 Study Group. HIV neuropathy natural history cohort study: assessment measures and risk factors. Neurology. 2006; 66:1679-87.
- 52. Simpson DM, Katzenstein DA, Hughes MD, Hammer SM, Williamson DL, Jian Q, Pi JT. Neuromuscular function in HIV infection: analy- sis of placebo-controlled combination antiretro- viral trial. AIDS Clinical Group 175/801 Study Team. AIDS. 1998; 12:2425-2432.
- 53. Simpson DM, McArthur JC, Olney R, Cli- fford D, So Y, Ross D, Baird BJ, Barret P, Ham- mer AE, and the Lamotrigine HIV Neuropathy Study Team. Lamotrigine for HIV-associated painful sensory neuropathies: a placebo-contro- lled trial. Neurology. 2003; 60:1508-14.
- 54. Simpson DM, Olney R, McArthur JC, Khan A, Godbold J, Ebel-Frommer K. A placebo-contro- lled trial of lamotrigine for painful HIV-associated neuropathy. Neurology. 2000; 54:2115-19.
- 55. Simpson DM, Tagliati M. Nucleoside ana- logue-associated peripheral neuropathy in HIV infection. J Acquir Immune Defic Syndr. 1995; 9:153-161.
- 56. Snider WD, Simpson DM, Nielsen S, Gold
JW, Metroka CE, Posner JB. Neurological com- plications of acquired immunodeficiency syndro- me: analysis of 50 patients. Ann Neurol. 1983; 14:403-18.
- 57. So YT, Holtzman DM, Abrams DI, Olney RK. Peripheral neuropathy associated with ac- quired immunodeficiency syndrome. Prevalence and clinical features from a population-based survey. Arch Neurol. 1988; 45:945-48.
- 58. Tagliati M, Grinnell J, Godbold J, Simpson DM. Peripheral nerve function in HIV infection. Clinical electrophysiologic and laboratory fin- dings. Arch Neurol. 1999; 56:84-89.
- 59. Wallace VC, Blackbeard J, Pheby T, Seger- dahl AR, Davies M, Hasnie F, Hall S, McMahon SB, Rice SC. Pharmacological, behavioural and mechanistic analysis of HIV-1 gp120 induced painful neuropathy. Pain. 2004; 133(1–3):47–63.
- 60. Woolf CJ. Dissecting out mechanisms responsible for peripheral neuropathic pain: im- plications for diagnosis and therapy. Life Sci. 2004; 74:2605-10.
- 61. Yarchoan R, Pluda J, Thomas R. Long term toxicity/activity profile of 2’3’ dideoxyiosine in AIDS or AIDS related complex. Lancet. 1990: 336:526-9.
- 62. Zareba G. Pregabalin: a new agent for the treatment of neuropathic pain. Drugs Today. 2005; 41:509-16.
- 63. Zhou L, Kitch DW, Evans SR, Hauer P, Ra- man S, Ebenezer GJ, Gerschenson M, Marra CM, Valcour V, Diaz-Arrastia R, Goodkin K, Millar L, Shriver S, Asmuth DM, Clifford DB, Simpson DM, McArthur JC. Correlates of epidermal nerve fiber densities in HIV-associeated distal sensory polyneuropathy. Neurology. 2007; 68:2113-19.
- 64. Zigmong AS, Snaith RP. The hospital anxiety and depression scale. Acta Psychiatr Scand. 1983; 67:361-370.







No comments! Be the first commenter?