Estado actual del tratamiento del dolor neuropático
Resumen
El dolor suele ser un motivo de consulta muy frecuente en la consulta médica cotidiana. El dolor neuropático tiene una pre- valencia importante dentro de la población general y su tratamiento es un desafío clínico relevante. La eficacia de los fármacos para el tratamiento del dolor neuropático es un aspecto relevante a tener presente por los médicos tratantes. Recientemente, ha aparecido diversos trabajos científicos que nutrieron a las guías terapéuticas de diversas sociedades científicas. En el presente trabajo se resumen las características de aquellos fármacos considerados actualmente dentro de la terapia estándar del dolor neuropático.
Palabras clave
Dolor neuropático – Tratamiento – Farmacoterapia – Actualización.
Muñoz Santiago Alfredo, Delamano Alexis Mejías, Molina Jonathan, Serra Héctor Alejandro. “Estado actual del tratamiento del dolor neuropático”. Psicofarmacología 2021;125:21-30.
Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El dolor se define, de acuerdo a IASP (International Asso- ciation for the Study of Pain – Asociación Internacional para el Estudio del Dolor), como la experiencia sensorial y emocio- nal desagradable en relación a un daño actual o potencial. Es un síntoma muy frecuente que puede aparecer como un síntoma único o como parte de cuadros clínicos complejos. En ciertas situaciones, el dolor será el síntoma que provoca la consulta del paciente. La mayoría de los casos de dolor (apro- ximadamente el 90%) se puede controlar en forma eficaz.
Dolor neuropático
En el año 1994 la IASP introdujo el término de dolor neu- ropático (DNP) como un espectro de enfermedad neurológica, asumiendo la existencia de 2 categorías muy amplias de dolor de diferente origen: el dolor nociceptivo y el dolor neuropático. El DNP es un dolor iniciado o causado por una lesión primaria o por una disfunción del sistema nervioso. Posteriormente, en el año 2008 el DNP se redefinió como un “dolor que se ori- gina como consecuencia de una lesión directa o enfermedad que afecta al sistema somatosensorial”. Esta definición re- formulada permitió diferenciarlo del dolor nociceptivo (DNC), el cual ocurre cuando existe daño en un tejido que activa los
nociceptores debido a mecanismos inflamatorios mediado por estímulos táctiles, térmicos o químicos y que, de esta mane- ra, transmiten impulsos nerviosos a las áreas superiores de procesamiento del dolor en el sistema nervioso central (SNC). Por lo tanto, poder diferenciar el DNP del DNC es crucial para establecer la estrategia terapéutica y poder mejorar la calidad de vida del paciente. Por último, en el año 2016 se propu- so un tercer término: dolor nociplástico. Este nuevo término permite explicar los cuadros dolorosos como las cefaleas, el síndrome de colon irritable o la fatiga crónica donde la infla- mación neurogénica, es decir aquella iniciada y mantenida por los terminales nerviosas libres periféricas, tienen un rol central y los daños tisulares son escasos o poco demostrables.
Epidemiología
El DNP consiste en un problema medico discapacitamte. Su prevalencia se incrementa con el envejecimiento de la po- blación. El DNP afecta al 7-8% de la población mundial, sien- do las mujeres las más afectadas (60.5% de los pacientes). El DNP aparece frecuentemente entre los 50 y 64 años de vida. En América Latina se estima que el DNP afecta al 2% de la población en donde 15 de cada 100 pacientes que acuden al médico por dolor, dicho dolor es de tipo neuropático. Las causas más comunes de DNP son:
- Dolor lumbar con componente neuropático.
- Neuropatía diabética.
- Neuralgia post herpética.
- Dolor neuropático secuelar a una intervención quirúrgica.
Fisiopatología
Entre los mecanismos más estudiados para poder compren- der la causa del DNP se incluyen:
- Neurodegeneración-apoptosis y neuroplasticidad anómala, lo que causa rewiring o recableado-conectividad neuronal alterado.
- Fagocitosis de terminales inhibitorias por la microglia, lo que genera una perdida del control GABAérgico-opioide.
- Expresión génica alterada con una sobre-expresión de canales de sodio (Na+) y neurotransmisores excitatorios asociado a un patrón de neuroquinas fetales que mantienen la neuroplasticidad anómala.
Todo esto cursa con una hiperactividad neuronal y desensibilización central.
La presencia de dolor espontáneo y paroxístico ante la ausencia de un estímulo externo es causado por la hiperactividad neuronal, también conocida como actividad neuronal
ectópica; que se desencadena luego de una lesión nerviosa y que, al ser persistente, es la clave para mantener de manera crónica los llamados síntomas positivos. La hiperactividad neu- ronal genera un cambio en la modulación de neurotransmiso- res nociceptivos, en donde la fosforilación del NMDA (ácido N-metil-D-aspartato) y AMPA (ácido a-amino-3-hidroxi-5-me- tilo-4-isoxazolpropiónico) y la sobreexpresión de canales de sodio logran disminuir el umbral necesario para la despolari- zación y propagación del impulso nervioso provocando dolor con estímulos que normalmente no serían dolorosos. Por otro lado, la lesión nerviosa existente disminuye el número de neu- ronas GABAérgicas, por lo que la inhibición en estos casos se vuelve deficiente (ya sea mediante vías nerviosas inhibitorias descendentes e interneuronas en el asta posterior de la medu- la espinal) dando origen al fenómeno llamado perdida de los controles inhibitorios.
Clasificación y manifestaciones clínicas
El DNP tiene diversas formas de clasificación, pero dentro las más comunes se encuentran según su anatomía, su etio- logía o su distribución. Anatómicamente el DNP se clasifica como central o periférico; siendo de origen central si la lesión se encuentra a nivel del cerebro o médula espinal y el DNP de origen periférico si la lesión se encuentra en el nervio perifé-
rico, ganglio, plexo o raíz nerviosa. Cabe destacar que el DNP periférico es más frecuente que el DNP central.
Según la etiología del DNP puede ser muy variada en la medida en la que el médico tratante realiza una historia clí- nica exhaustiva tanto con los antecedentes heredofamiliares del paciente como con sus comorbilidades médicas actuales.
- A nivel central, la etiología puede ser:
- Accidentes cerebrovasculares.
- Traumatismos craneales.
- Procesos tumorales .
- Cuadros inflamatorios secundarios a encefalitis o abscesos.
- A nivel periférico, las causas son aún más variadas y se incluyen las siguientes:
- Metabólicas: diabetes mellitus, hipotiroidismo e hipovita- minosis (principalmente del complejo B).
- Infecciosas: HIV, herpes zoster, lepra.
- Neuralgia del Trigémino o neuralgia del nervio glosofaríngeo.
- Traumatismos espinales (principalmente a nivel cervical o lumbar).
- Secundario a una intervención quirúrgica (mastectomía, toracotomía.
- Farmacológica: antibióticos (isoniazida, nitrofurantoína,
metronidazol).
- Tóxica: alcohólica, arsénico, plomo o talio.
- Síntomas paraneoplásicos.
Según su distribución, el DNP se clasifica en localizado o difuso. El DNP localizado se caracteriza por abarcar área(s) consistentes y circunscritas de máximo dolor asociado con signos sensitivos positivos o negativos y/o síntomas espontá- neos característicos de dolor neuropático como por ejemplo, el dolor quemante.
Los síntomas y signos del DNP pueden ser descritos como negativos o positivos y son el resultado del daño nervioso. Entre los síntomas positivos que se observan más frecuente- mente se destacan la hipersensibilidad, las parestesias y la sensación quemante o eléctrica. La hipersensibilidad puede ser de 2 tipos: la alodinia que se describe como la sensación de dolor a estímulos inocuos y la hiperalgesia que se trata de la sensación aumentada de dolor frente a un estímulo dolo- roso. Entre los síntomas negativos se incluyen la ausencia de sensibilidad en el área afectada y puede acompañarse con la alteración de la función motora.
Comorbilidades y consecuencias
El DNP se acompaña de procesos sensoriales anormales y trastornos afectivos. El dolor y los trastornos del estado de ánimo comparten mecanismos patogénicos comunes. Existen datos biológicos y de neuroimágenes que demuestran áreas cerebrales comunes en la modulación de las experiencias do- lorosas y emocionales.
Debemos recordar que es importante tratar un trastorno afectivo que coexiste con dolor. Las alteraciones psiquiátricas asociadas con el dolor incluyen:
- disfunción de la memoria
- deterioro cognitivo
- disminución del apetito
- depresión
- anhedonia
- interrupciones del ciclo del sueño
- roblemas familiares y/o sociales.
Las regiones cerebrales más comúnmente involucradas con el dolor en los trastornos afectivos son: núcleo accumbens, la corteza prefrontal medial y la gris periacueductal.
El DNP se asocia con una importante carga económica. Los pacientes con DNP experimentan una peor calidad de vida relacionada con la salud (QoL) en comparación con la pobla- ción general. El DNP crónico se asocia con peores niveles de calidad de vida, mayor angustia, mayor interferencia con el sueño y mayor cantidad de pérdida de días de trabajo que el dolor crónico sin componente neuropático.
Diagnóstico
El diagnóstico del DNP, a pesar de no contar con signos pa- tognomónicos, se basa en la realización de una historia clínica profunda evaluando antecedentes heredofamiliares, comorbi- lidades y un examen físico del paciente (con la finalidad de efectuar un diagnóstico diferencial de DNP periférico vs DNP central). Existen múltiples cuestionarios validados para de- terminar la presencia o ausencia de dolor de tipo neuropático (LANSS, DN4, Pain DETECT, ID Pain). Estos cuestionarios se basan en el reporte verbal de las características del dolor (por ejemplo, la disminución de la sensibilidad, presencia de sensación quemante y eléctrica). Además, se pueden obtener datos complementarios que aporten al diagnóstico al solicitar estudios de laboratorio para evaluar los niveles de glucemia y electrolitos. También se puede realizar tomografía computada (TC) y resonancia magnética (RMN) con el propósito de eva- luar causas centrales de DNP, estudios de electrofisiología y biopsias de nervios periféricos.
Tratamiento
El tratamiento del DNP es multidisciplinario. El manejo terapéutico del DNP debe constituir un proceso fluido, cuyo objetivo es la reducción del dolor, la mejoría funcional y de la calidad de vida del paciente. El tratamiento debe ser multi- modal, teniendo en cuenta todas las alternativas terapéuticas (farmacológicas y no farmacológicas). Esta estrategia multi- modal incluye la educación de los pacientes, la implemen- tación de medidas de rehabilitación, fisioterapia y actividad física y la terapia psicológica.
Dentro de los grupos terapéuticos destacados en la tera- pia farmacológica del DNP se incluyen principalmente los gabapentinoides (pregabalina, gabapentin), los antidepresivos duales (inhibidores de la recaptación de serotonina y noradre- nalina) y algunos antidepresivos tricíclicos (destacándose la amitriptilina).
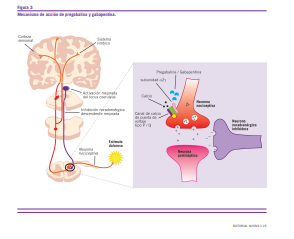
Uno de los grupos terapéuticos con mayor aval científico en diversas guías de tratamiento internacionales son los ga- bapentinoides (pregabalina, gabapentin). La pregabalina, fár- maco antiepiléptico, se destaca por tener una potente acción analgésica, ansiolítica y anticonvulsivante. Posee una estruc- tura química similar al GABA, pero carece de efectos sobre los receptores de dicho neurotransmisor inhibitorio. Asimismo, tampoco parece imitar a nivel fisiológico el rol de GABA en el organismo humano. El mecanismo de acción de pregabalina se basa en la unión a la subunidad a2g del canal de calcio de las neuronas presinápticas. Como consecuencia, hay un menor número de canales expuestos para ser activados por los potenciales de acción. Esto genera una reducción de la entra- da de calcio, una menor liberación de glutamato y sustancia P y una reducción en la excitabilidad celular postsináptica en la vía espinotalámica.
Asimismo, como la subunidad a2g1 per se es un receptor a
trombospondina (una neuroquina fetal responsable de la neu-
roplasticidad anómala) la pregabalina impide el desarrollo de tal neuroplasticidad lo que la posiciona como un fármaco de elección en estas entidad nosológicas.
La pregabalina se caracteriza por tener diversas indicacio- nes terapéuticas:
- Tratamiento de las crisis epilépticas parciales en pacien- tes adultos (en forma coadyuvante)
- Tratamiento del trastorno de ansiedad generalizada (TAG)
- Tratamiento de la fibromialgia
- Tratamiento del dolor central y periférico en la neuropa- tía diabética y post herpética
- Tratamiento del dolor asociado a lesión de la medula espinal.
Desde el aspecto farmacocinético, la pregabalina se destaca por el escaso metabolismo hepático, que no genera inducción ni inhibición del sistema enzimático CYP y prácticamente no tiene unión a proteínas plasmáticas. Por ende, es de esperarse que no ocurran interacciones con otras drogas a nivel hepático ni a nivel de la etapa de distribución.
El gabapentin es un análogo del GABA que fue desarrollado inicialmente para el tratamiento de la espasticidad. Al agregar un anillo ciclohexano a la estructura del GABA se logro que la molécula adquiera una mayor liposolubilidad y sea capaz de atravesar más fácilmente la barrera hematoencefálica (BHE) y llegar al SNC. El gabapentin fue aprobado por primera vez en el año 1993 por parte de FDA (Food and Drug Adminis- tration) para el tratamiento adyuvante de las crisis parciales complejas en pacientes mayores de 12 años, con dosis hasta de 1.800 mg por día.
Al igual que pregabalina, gabapentin carece prácticamente de metabolismo hepático y su vida media corta (5-7 horas) condiciona que su posología conste de 3 tomas diarias. A diferencia de la pregabalina, gabapentin posee indicaciones terapéuticas más acotadas:
- Terapia combinada en las crisis epilépticas parciales, con o sin generalización secundaria en adultos y niños desde los 6 años en adelante.
- Monoterapia en crisis epilépticas parciales, con o sin generalización secundaria en adultos y adolescentes desde los
12 años en adelante.
- Tratamiento del dolor neuropático periférico y la neural- gia post-herpética, en adultos.
Otro de los grupos terapéuticos con demostrada eficacia en el tratamiento del DNP son los inhibidores de la recaptación de serotonina y noradrenalina (IRSN), también denominados antidepresivos duales. Dentro de este grupo se destacan la duloxetina y venlafaxina. Cabe destacar que la duloxetina es el único antidepresivo dual con aprobación regulatoria para
el tratamiento de pacientes adultos con neuropatía diabética periférica. La duloxetina y venlafaxina actúan mediante la inhibición selectiva de la recaptación tipo I de serotonina (5-HT) y noradrenalina (NA). Duloxetina efectúa dicha inhibición a dosis bajas (60 mg por día), mientras que venlafaxina lo rea- liza a partir de los 150 mg/día (a dosis menores prevalece la inhibición de la recaptación de serotonina), especialmente en las terminales medulares de las vías descendentes de control doloroso supraespinal originadas en el núcleo del rafe magno- celular y en el locus coeruleus, respectivamente.
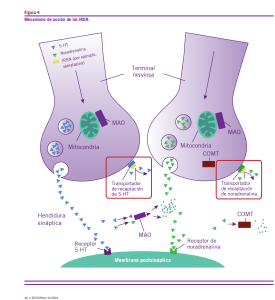
La duloxetina es un antidepresivo dual aprobado en el año 2004 por FDA para el tratamiento del trastorno depresivo ma- yor (TDM). Un mes después logró la aprobación para el trata- miento de la neuropatía diabética por la misma autoridad sa- nitaria. Se caracteriza por tener una vida media de 12 horas, una absorción digestiva saturable y cinética lineal. Aparte de actuar como inhibidor de la recaptación de 5-HT y NA, tam- bién inhibe en forma débil la recaptación de dopamina (DA). Dentro de los efectos terapéuticos de la duloxetina, se destaca su eficacia para tratar los dolores físicos de los pacientes que padecen de depresión.
Las indicaciones terapéuticas de duloxetina son:
- Tratamiento de pacientes con trastorno depresivo mayor (TDM) en adultos.
- Tratamiento de la fibromialgia.
- Tratamiento del trastorno de ansiedad generalizada (TAG).
- Tratamiento de la neuropatía diabética periférica.
- Tratamiento del dolor musculoesquelético crónico.
En Europa, duloxetina además posee indicación terapéutica aprobada para el tratamiento de la incontinencia urinaria por estrés (EMA, European Medicines Agency). Por otro lado, ven- lafaxina tiene un perfil farmacodinámico particular. De acuer- do a la dosis utilizada, se puede observar diferentes efectos terapéuticos (acción inhibitoria de la recaptación de 5-HT a dosis inferiores a 150 mg/día y acción dual sobre 5-HT y NA con dosis superiores a 150 mg/día). Cabe destacar que a la actualidad venlafaxina carece de indicación terapéutica apro- bada para el tratamiento del dolor neuropático.
El tercer grupo terapéutico avalado por diversas guías te- rapéuticas son los antidepresivos tricíclicos (ATC). Dentro de los ATC, se destaca la amitriptilina (también denominada proheptidina). Este antidepresivo con estructura química de amina terciaria fue aprobado en el año 1960. La amitripti- lina es un potente antidepresivo con propiedades sedativas que actúa mediante la inhibición del mecanismo de la bomba responsable de la recaptación de NA y 5-HT en las neuronas adrenérgicas y serotonérgicas, respectivamente. Se encuentra indicada para el tratamiento del TDM, la bulimia nerviosa, enuresis nocturna (cuando se descartó patología orgánica), dolor crónico neuropático y neuralgia post herpética. Es de destacar que la amitriptilina es el antidepresivo más cardio- tóxico, epileptógeno y peligroso en los casos de sobredosis. Genera efectos sedativos que condiciona su administración preferentemente por la noche.
Un fármaco aprobado para el tratamiento de la neuropa- tía periférica diabética dolorosa (NPDD) es la capsaicina en parche 8%. La capsaicina (trans-8-metil-N-valinil-6-nonena- mida) es un componente de los pimientos picantes que activa de forma continua el receptor vaniloide 1 de los canales de potencial receptor transitorio (TRPV1, sus siglas en inglés). Los parches se aplican durante 30 a 60 minutos en el área
dolorosa. Esta preparación de capsaicina en dosis altas produ- ce la sobreestimulación y desensibilización de los terminales nerviosos de la piel, que se tornan incapaces de responder a estímulos nociceptivos. Luego de una hora de la aplicación del parche se obtiene analgesia local hasta por 3 meses, con un efecto máximo después de 1 o 2 semanas.
Otro fármaco aprobado para el tratamiento de la NPDD es la lidocaína en parche al 5%. Esta formulación posee una baja absorción sistémica y presenta una excelente tolerabilidad del anestésico local (efectos adversos locales como reacciones dermatológicas leves). Por este motivo se la tiene en cuenta como primera opción en los pacientes de edad avanzada (es- pecialmente cuando existe preocupación de efectos adversos del SNC con medicaciones orales).
Recomendaciones de guías terapéuticas
Existe una serie de sociedades científicas internacionales que confeccionan guías prácticas de tratamiento del dolor neuropático. Dentro de estas guías se destacan las publicadas por IASP (International Association for Study of Pain), EFNS (European Federation of Neurological Societies), ADA (Ameri- can Diabetes Association), NICE (National Institute for Health and Care Excellence), AAN (American Academy of Neurolo- gy), DGN (Deutsche Gesellschaft für Neurology) de Alemania, NHS (National Health Services) del Reino Unido y FEDELAT (Federación Latinoamericana de IASP).
- Las recomendaciones de las guías internacionales de di- versas especialidades coinciden en que la terapia de primera elección del DNP se basa en la administración de fármacos aprobados por las autoridades sanitarias mundiales (FDA, EMA) tales como duloxetina y pregabalina. Asimismo, se su- giere el uso como primera elección de otros grupos terapéu- ticos con extenso aval científico: gabapentin, antidepresivos tricíclicos (principalmente amitriptilina), capsaicina en crema y analgésicos opioides.

- La mayoría de las guías internacionales (IASP, AAN, EFNS, ADA) coinciden en que la primera línea de tratamiento de la neuropatía diabética se basa en la administración de pre- gabalina, gabapentin, duloxetina y los ATC (preferentemente amitriptilina). Como segunda línea de tratamiento se sugiere
la administración de fármacos opiáceos débiles.
Las dosis de inicio y de mantenimiento de los fármacos sugeridos para el tratamiento del dolor neuropático diabético se resumen en la tabla 1 (Ver Tabla 1).
Asimismo, en la tabla 2 se resumen las líneas de tratamien- to de la neuropatía diabética dolorosa de acuerdo a distintas guías terapéuticas internacionales (Ver Tabla 2).
- Gran parte de las guías internacionales recomiendan como terapia de primera elección de la neuralgia post-herpética la administración de pregabalina, gabapentin, ATC y lidocaína en parche. La segunda y tercera línea de tratamiento incluye
a los fármacos opioides (morfina, oxicodona, metadona) y la capsaicina tópica. En la tabla 3 se resumen los fármacos su- geridos para el tratamiento de la neuralgia post herpética (Ver tabla 3).
- Respecto al manejo de la neuropatía del nervio trigémino, las guías internacionales coinciden en que el tratamiento de primera línea se basa en la administración de carbamazepina.
En la tabla 4 se consignan los fármacos aprobados por au- toridades sanitarias internacionales para el tratamiento de las DNP.
Tabla 1
Dosis de inicio y mantenimiento de los principales grupos terapéuticos en el tratamiento del dolor neuropático diabético.
| Fármaco | Grupo terapéutico | Dosis de inicio | Dosis de mantenimiento |
| Pregabalina | Gabapentinoide | 75 a 150 mg/día | 150 a 300 mg/día, 2 veces al día |
| Gabapentin | 300 mg/día | 300 a 1200 mg/día, 3 veces al día | |
| Duloxetina | IRSN | 60 mg/día | 60 a 120 mg/día |
| Venlafaxina | 37.5 mg/día, aumentando semanalmente 37.5 mg/día | 150 a 225 mg/día | |
| Amitriptilina | ATC | 10 a 25 mg/día | 50 a 150 mg/día |
Tabla 2
Resumen de las líneas de tratamiento de la neuropatía diabética dolorosa de acuerdo a las distintas guías de tratamiento interna- cionales.
| Fármaco | NICE | EFNS | IASP | ADA | FEDELAT |
| Pregabalina | 1 | 1 | 1 | 1 | 2 |
| Gabapentin | 1 | 1 | 1 | 1 | 2 |
| Duloxetina | 1 | 1 | 1 | 1 | 3 |
| Venlafaxina | – | 1 | – | – | 3 |
| Venlafaxina XR | – | – | 1 | – | – |
| Amitriptilina | 1 | 1 | 1 | 2 | 1 |
| Nortriptilina | – | – | 1 | 2 | 1 |
| Imipramina | – | – | 1 | 2 | – |
| Clomipramina | – | – | 1 | 2 | – |
| Desipramina | – | – | 1 | 2 | 1 |
| Tramadol | 2 | 2 | 2 -3 | 3 | 2 |
| Oxicodona | 2 | 3 | 2 -3 | 3 | 2 |
| Morfina | 2 | 3 | 2 -3 | 3 | 2 |
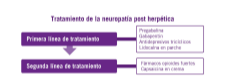
Tabla 3
Posología sugerida y dosis de los fármacos para el tratamiento de la neuralgia post-herpética. Guía IASP (2010).
| Fármaco | Grupo terapéutico | Vía de administración | Dosis de inicio | Dosis máxima |
| Amitriptilina | ATC | Oral | 25 mg/día | 150 mg/día |
| Pregabalina | Gabapentinoide | 150 mg/día | 600 mg/día | |
| Gabapentin | 1.800 mg/día | 3.600 mg/día | ||
| Lidocaína en parche | Anestésico local | Trandérmica | Aplicación de 1 a 4 parches por día, durante 12 horas | |
| Capsaicina en parche | Agonista del receptor TRPV1 | 1 parche aplicado durante 30 a 60 minutos | ||
| Tramadol | Opioide | Oral | 200 mg/día | 400 mg/día |
| Oxicodona | 10 mg/día | 120 mg/día | ||
Modificado de IASP NeuPSIG (Neuropathic Pain Special Interest Group). Pharmacological management of Neuropathic Pain. 2010.
Tabla 4
Indicaciones terapéuticas aprobadas por las principales autoridades sanitarias internacionales.
| Fármaco | Grupo terapéutico | Autoridad sanitaria | Indicación terapéutica |
| Pregabalina | Antiepiléptico | FDA, EMA | Neuropatía periférica diabética dolorosa Neuropatía post-herpética dolorosa Neuropatía post lesión medular |
| Gabapentin | FDA EMA, TGA | Neuropatía post-herpética dolorosa Dolor neuropático | |
| Carbamazepina | FDA, EMA | Neuralgia del nervio trigémino | |
| Duloxetina | IRSN | FDA, EMA | Neuropatía diabética periférica dolorosa |
| Capsaicina en parche 8% | Agonista del receptor TRPV1 | FDA EMA | Neuropatía diabética periférica dolorosa Dolor neuropático periférico |
| Lidocaína en parche 5% | Anestésico local | FDA | Neuropatía diabética periférica dolorosa |
FDA= Food and Drug Administration (EEUU), EMA= European Medicines Agency (Unión Europea), TGA= Australian Therapeu- tic Goods Administration
Referencias bibliográficas
- 1. Part III: Pain Terms, A Current List with Definitions and Notes on Usage” (pp 209-214) Classification of Chronic Pain, Second Edition, IASP Task Force on Taxonomy, edited by H. Merskey and N. Bogduk, IASP Press, Seattle,
©1994.
- 2. Harrison, Kasper, Braunwald, et al. Prin- cipios de Medicina Interna. McGraw Hill-Intera- mericana. Año 2006, 16° edición.
- 3. Finnerup NB, Kuner R and Jensen T. Neu- ropathic pain: from mechanisms to treatment. Physiol Rev. 2021, 101(1): 259-301.
- 4. Kosek E, Cohen M, Baron R, et al. Do we need a third mechanistic descriptor for chronic pain states? Pain. 2016, 157: 1382-86.
- 5. Machelska, Celik MO. Recent advances in understanding neuropathic pain: glia, sex diffe- rences and epigenetics. F1000Research. 2016, 5: 2743.
- 6. Doth AH, Hansson PT, Jensen M, et al. The burden of neuropathic pain: a systematic re- view and meta-analysis of health utilities. Pain. 2010; 149(2):338–44.
- 7. Meyer-Rosberg K, Burckhardt CS, Huizar K, et al. A comparison of the SF-36 and Not- tingham Health Profile in patients with chronic neuropathic pain. Eur J Pain. 2001; 5(4):391– 403.
- 8. Smith BH, Torrance N, Bennett M, et al. Health and quality of life associated with chronic pain of predominantly neuropathic origin in the community. Clin J Pain. 2007; 23(2):143–9.
- 9. Dermanovic D, Hrabac P, Skegro D, et al. The impact of neuropathic pain and other co- morbidities on the quality of life in patients with diabetes. Health Qual Life Outcomes. 2014; 12(1):171.
- 10. Inoue S, Taguchi T, Yamashita T, et al. The prevalence and impact of chronic neuropa- thic pain on daily and social life: A nationwide study in a Japanese population. Eur J Pain. 2017; 21(4): 727–37.
- 11. Aloisi AM, Berlincioni V, Torta R, et al. The role of gender, psycho-social factors and anthropological-cultural dimensions on pain in neurorehabilitation. Evidence and recommenda- tions from the Italian Consensus Conference on Pain in Neurorehabilitation. Eur J Phys Rehabil Med. 2016; 52(5):730–40.
- 12. Galer BS, Gianas A and Jensen MP. Pain- ful diabetic polyneuropathy: epidemiology, pain description, and quality of life. Diabetes Res Clin Pract. 2000, 47, 123-28.
- 13. Finnerup NB, Attal N, Haroutounian S, et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015; 14(2):162–73.
- 14. GerardoCorrea-Illanes. Neuropathic pain, clasification and management for general prac- ticioners. Revista Médica Clínica Las Condes. 2014, 25(2): 189-99.
- 15. Snyder Matthew, Gibbs Lawrence and Lindsay Tammy. Treating painful diabetic peri- pheral neuropathy: an update. Am Fam Physi- cian. 2016, 94: 227-34.
- 16. Szok Délia, Tajti János, Nyári Aliz, et al. Therapeutic approaches for peripheral and cen- tral Neuropathic Pain. Behavioural Neurology. 2019, 1-13.
- 17. Lombardo Leo and Wallace Mark. Assess- ment and treatment of Neuropathic Pain. Practi- cal Pain Management. 13(8):
- 18. Bates D, Schultheis C, Hanes M, et al. A comprehensive algorithm for management of neuropathic pain. Pain Medicine. 2019, 20: S2-S12.
- 19. Attal N. Pharmacological treatments of neuropathic pain: the latest recommendations. Revue Neurologique. 2019, 175: 46-50.
- 20. Liampas Andreas, Rekatsina Martina, Vadalouca Athina, et al. Pharmacological ma- nagement of painful peripheral neuropathies: a systematic review. Pain Ther. 2020.
- 21. Mazzoglio MJ, Mejías Delamano A, Muñoz S, et al. Psicofarmacología en esquema para el equipo interdisciplinario de salud mental. Edito- rial Impresiones Buenos Aires. 2016. Segunda edición.
- 22. Eroglu C, Allen NJ, Susman MW, et al. Gabapentin receptor a2g1 is a neuronal throm- bospondin receptor responsible for excitatory CNS synaptogenesis. Cell. 2009, 139: 380-92.
- 23. Sheena Derry S, Rice A, Cole P, et al. Cap- saicina tópica (alta concentración) para el dolor neuropático crónico en adultos. Cochrane Data- base of Systematic Reviews. 2017.
- 24. Parra Soto CE, Miñana Barrios M, Jimenez Salas B, et al. Tratamiento del dolor neuropático localizado postquirúrgico con parche de capsai- cina al 8%. Ocronos. 2020, Vol. III. Nº 5.
- 25. National Institute for Health and Care Excellence (NICE). Neuropathic pain: the phar- macological management of neuropathic pain in adults in non-specialist settings. 2013.
- 26. Cavalli Eugenio, Mammana Santa, Nico- letti Ferdinando, et al. The neuropathic pain: an overview of the current treatment and future therapeutic approaches. International Journal of Immunopathology and Pharmacology. 2019, 33: 1-10.
- 27. Attal N, Cruccu G, Baron R, et al. EFNS guidelines on the pharmacological treatment of neuropathic pain: 2010 revision. European Jour- nal of Neurology. 2010, 17: 1113-23.
- 28. Schlereth Tanja. Guideline “diagnosis and non interventional therapy of neuropathic pain”
of the German Society of Neurology. Neurologi- cal Research and Practice. 2020, 2: 16.
- 29. Acevedo JC, Amaya A, León Casasola O, et al. Guidelines for the diagnosis and manage- ment of Neuropathic Pain: Consensus of a Group of Latin American Experts. Journal of Pain and Palliative Care Pharmacotherapy. 2009, 23(3):
261-81.
- 30. SED-SEMERGEN-SemFYC-SEMG. Guía de
Práctica Clínica sobre el tratamiento farmacoló- gico del Dolor Neuropático Periférico en Aten- ción Primaria. Masterline División editorial. Año 2016.
- 31. IASP. NeuPSIG (Neuropathic Pain Special Interest Group). Pharmacological management of Neuropathic Pain. 2010, vol XVIII, issue 9.
- 32. American Society of Anesthesiologists Task Force and American Society of Regional Anesthesia and Pain Medicine. Practice Guide- lines for Chronic Pain Management. Anesthesio- logy. 2010, 112: 1-1.
- 33. Management of Neuropathic Pain for Adults in Primary Care. National Health Services (NHS), United Kingdom. 2018
- 34. Pop-Busui Rodica, Boulton Andrew, Fled- man Eva, et al. Diabetic Neuropathy: a position statement by the American Diabetes Associa- tion. Diabetes Care. 2017, 40: 136-154.
- 35. Bril V, England J, Franklin G, et al. Eviden- ce-based guideline: treatment of painful diabe- tic neuropathy. Report of the American Academy of Neurology, the American Association of Neu- romuscular and Electrodiagnostic Medicine and the American Academy of Physical Medicine and Rehabilitation. Neurology.2011, 1758-65.
- 36. Dworkin R, Johnson R, Breuer J, et al. Re- commendations for the management of Herpes Zoster. Clinical Infectious Diseases. 2007, 44: S1-26.
- 37. Kamerman PR, Finnerup NB, De Lima L, Haroutounian S, Raja SN, Rice ASC, Smith BH, Treede RD. Gabapentin for neuropathic pain: An application to the 21st meeting of the WHO Expert Committee on Selection and Use of Es- sential Medicines for the inclusion of gabapentin on the WHO Model List of Essential Medicines. DOI:10.6084/m9.figshare.3814206.v2, 2016.







No comments! Be the first commenter?