Tratamiento médico del Sangrado uterino anormal
Introducción
El sangrado uterino anormal es uno de los motivos de consulta más frecuentes en mujeres en edad reproductiva, con repercusiones físicas, sociales y emocionales en la calidad de vida (1).
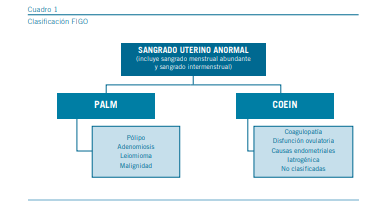
Históricamente, se han utilizado una amplia variedad de definiciones diferentes para describir patrones anormales de sangrado menstrual. La Federación Internacional de Ginecología y Obstetricia (FIGO) ha unificado los criterios en la clasificación del SUA en mujeres no gestantes, en edad re- productiva la cual se basa en las causas del sangrado uterino anormal (incluyendo el sangrado intermenstrual y el sangrado menstrual abundante) que se dividen en causas estructurales y no estructurales y éstas a su vez en nueve categorías básicas que se ordenan de acuerdo con el acrónimo PALM-COEIN.
Los componentes del grupo PALM corresponden a causas estructurales mensurables visualmente por técnicas de imagen o por histopatología, a saber: pólipos, adenomiosis, leio- miomas, e hiperplasias y carcinomas; mientras que el grupo COEIN está relacionado con causas no estructurales, que no se definen por estudios de imágenes o histopatología: coagulopatías, trastornos anovulatorios, trastornos endometriales, causas iatrogénicas y no clasificadas (Cuadro 1) (2). Nuevos estudios sostienen que el SUA de causa endometrial y el iatrogénico estén probablemente están asociados con una angiogénesis endometrial aberrante y una maduración vascular deficiente lo que resulta en vasos más frágiles y permeables (3). De acuerdo con estas nuevas definiciones, el SUA crónico es el sangrado proveniente del cuerpo uterino que es anormal en duración, volumen y/o frecuencia y que ha estado presente
Evaluación
Para calcular la cantidad del sangrado existen diferentes técnicas como la recolección y conteo o peso del material sanitario utilizado, análisis de la sangre contenida (método de la hematina alcalina), uso de pictogramas, o cuestionarios, algunas de ellas más fidedignas que otras pero a veces com- plicadas de utilizar en la práctica diaria.
La información por parte de la mujer sobre el aumento de la cantidad del sangrado es suficiente para iniciar el estudio del problema. FIGO considera como SUA aquel sangrado que la mujer considera abundante y afecta su salud y calidad de vida. Se debe obtener una historia médica exhaustiva y realizar un examen general y pélvico (que incluya un examen con espéculo y un examen bimanual) para identificar cualquier traumatis- mo en el tracto genital o hallazgos vaginales o cervicales que puedan causar sangrado vaginal como un pólipo o carcinoma y también determinar la cantidad y la intensidad del sangrado. Es importante tener en cuenta que hasta el 13% de las mujeres con sangrado menstrual abundante tienen alguna variante de la enfermedad de von Willebrand y hasta el 20% de las mujeres
pueden tener un trastorno de la coagulación subyacente.
En el estudio de un SUA se debería solicitar estudios de laboratorio que incluyan hemograma, prueba de embarazo en mujeres en edad fértil, estudio hormonal ante la sospecha de patologías concretas como el síndrome de ovario poliquístico (SOP), o hiperprolactinemia y estudio de coagulación (si los antecedentes personales o familiares son sugerentes de una coagulopatía).
Las técnicas de imagen ayudan en la investigación del SUA de causa orgánica, permitiendo diagnosticar o descartar las anomalías estructurales. La ecografía transvaginal debe ser considerada de primera línea en el diagnóstico de las anomalías estructurales ya que presenta valores de sensibilidad y de especificidad del 95 y 94% respectivamente (4).
La sonohisterografía se trata de una prueba poco invasiva, bien tolerada y que es capaz de diagnosticar con mayor pre- cisión alteraciones en el contorno de la cavidad uterina, tales como pólipos o miomas submucosos. La ecografía 3D puede contribuir también a un mejor diagnóstico de la patología de la cavidad uterina. Si se sospecha una adenomiosis, la reso- nancia magnética nuclear (RMN) es el estudio preferido, pero dado su elevado costo, puede que no siempre esté disponible. Mediante histeroscopía se puede realizar la visualización directa de la cavidad uterina y estaría indicada ante la firme sospecha de una patología intrauterina susceptible de trata- miento como los pólipos o los miomas submucosos ya que cumpliría un doble rol de diagnóstico y tratamiento. La biop- sia endometrial por aspiración no es útil para el diagnóstico de pólipos endometriales o miomas, ni tampoco en el caso de lesiones focales (5). Los estudios de hemodinamia podrían ser útiles en caso de sospechar malformaciones arteriovenosas (6).
Tratamiento médico del SUA
El objetivo del tratamiento del SUA es básicamente la dis- minución de la cantidad de sangrado menstrual, la corrección de la anemia, la prevención de recurrencias y la mejoría de la calidad de vida (7). El tratamiento debe ser consensuado con la mujer ya que suelen ser tratamientos a largo plazo y es impor- tante involucrarla en la toma de decisiones. Si se presentaran otros síntomas, como dolor abdominal o dolor pélvico podrían requerir un enfoque de tratamiento adicional o específico.
Tratamiento médico no hormonal
Inhibidores de la síntesis de prostaglandinas: AINE (an- tinflamatorios no esteroides)
Los antinflamatorios no esteroides (AINE) más utilizados son el ácido mefenámico, naproxeno, ibuprofeno, flurbipro- feno y diclofenac. Su mecanismo de acción es por inhibición de la enzima ciclooxigenasa con la consiguiente inhibición de la síntesis de las prostaglandinas y el incremento de los nive- les del tromboxano A2. Como consecuencia se produce a una vasoconstricción y un aumento de la agregación plaquetaria.
Algunos estudios han demostrado una alteración de las prostaglandinas en las mujeres con SUA y se logra la dismi- nución del sangrado menstrual, en un 30% con drogas de este tipo, Una revisión de Cochrane concluyó que los AINE son más efectivos que el placebo, pero menos que el ácido
tranexámico o el dispositivo intrauterino con levonorgestrel (DIU-LNG) (8).
De los AINEs el más extensamente estudiado ha sido el ácido mefenámico. La reducción del sangrado varía entre un 20 a 50 % de acuerdo con los distintos estudios (9). También se ha observado que el tratamiento puede continuar siendo efectivo a largo plazo como se demostró en un estudio donde se realizó seguimiento por 12 a 15 meses (10).
En la mayoría de los estudios el tratamiento se comienza el primer día de menstruación/sangrado y se continúa por 5 días o hasta su cese o disminución. El ácido mefenámico y el naproxeno se han estudiado en dosis de 250 a 500 mg 2 a 4 veces por día, el ibuprofeno en dosis de 600 a 1200 mg por día. El perfil de seguridad de los AINEs permite su uso en mujeres jóvenes que busquen embarazo y son un tratamiento adecuado para el dolor.
Los efectos secundarios gastrointestinales pueden estar presentes, pero son menos frecuentes al ser tratamientos más cortos que por ejemplo en personas con osteoartritis. Se de- ben usar con precaución en mujeres con insuficiencia renal o con antecedentes de úlceras digestivas.
Antifibrinolíticos: ácido tranexámico
El endometrio posee un activo sistema fibrinolítico, se ha encontrado un aumento de los niveles de activadores del plas- minógeno, un grupo de enzimas que causa la fibrinólisis, en mujeres con sangrado abundante comparado con mujeres con sangrado normal. Los inhibidores del activador del plasmi- nógeno o agentes antifibrinolíticos son un importante grupo terapéutico para al control de la hemorragia uterina (11). El ácido tranexámico reduce la pérdida sanguínea en un 40 a 50
% y ha resultado ser más efectivo que placebo, progestágenos orales o AINEs, pero menos efectivo que el DIU-LNG (12).
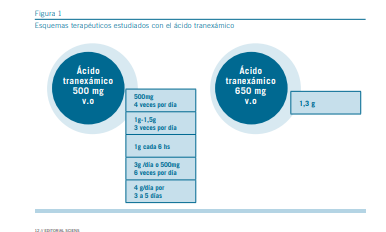
La mayoría de los estudios se han realizado con una dosis de 2 a 4 g por día durante 5 días de tratamiento (13). La dosis endovenosa habitual es de 10 mg/kg cada 8 horas.
Es una droga de elección en la terapéutica inicial del SUA Agudo en pacientes con alteración del estado hemodinámico con una dosis de carga de 1 g en 100 ml de infusión endove- nosa de cloruro de sodio al 0,9% o glucosa al 5% a pasar en 10 minutos, mientras se realizan las maniobras de reanima- ción con coloides o cristaloides y se intenta aclarar la etiología del sangrado.
Está contraindicado en paciente con coagulación intravascular diseminada, tromboembolismo arterial o venoso, o hematuria macroscópica. Los efectos secundarios son poco frecuentes, pero se manifiestan habitualmente como nauseas, mareos, trastornos digestivos, hipotensión y malestar en caso de inyección rápida (> 1 ml/minuto), convulsiones a dosis al- tas, trastornos visuales y reacciones alérgicas. Los estudios a gran escala han demostrado que la incidencia de trombosis en las mujeres tratadas con ácido tranexámico es similar a la incidencia espontánea de trombosis en mujeres no tratadas.
Ninguno de los esquemas terapéuticos ha demostrado ser superior a otro, aunque las dosis más altas de 3 g por día po- drían ser más efectivas en la hemorragia aguda que las dosis más bajas de 2 g por día. La duración del tratamiento se ade- cuará según cada caso.
Etamsilato
El mecanismo de acción propuesto es a través de la dis- minución de la fragilidad capilar, algunos estudios han dado resultados conflictivos, no se recomienda en las guías de UK.
Tratamiento médico hormonal
Se utilizan en distintas rutas de administración y dosis. En forma oral, intermitente en la fase lútea, intramuscular, o en forma continua a través del DIU hormonal.
La administración de acetato de noretisterona 5 mg tres ve- ces por día desde el día 5 al 26 del ciclo ha demostrado ser más efectivo que durante 14 días de la fase lútea. Según una revisión Cochrane la eficacia en reducir el sangrado de este es- quema prolongado es menor que la del ácido tranexámico (14). El acetato de medroxiprogesterona (AMP) también se ha uti- lizado en dosis de 10 mg por 21 días con buena respuesta terapéutica (15). Otro esquema de tratamiento estudiado es 20 mg tres veces por día por 7 días y luego 20 mg por día por
los siguientes 21días (16).
La combinación de la vía oral con la intramuscular puede resultar una opción efectiva para mujeres con sangrado agudo muy abundante y a tal fin se ha estudiado la dosis de una in-
yección intramuscular de AMP 150 mg combinada con 3 días de AMP por vía oral 20 mg cada 8 horas durante 3 días (17). El tiempo promedio para el cese del sangrado fue de 2,6 días. El DIU-LNG consiste en un dispositivo en forma de T de po- lietileno con un reservorio en su tallo que contiene 52 mg de levonorgestrel. Fue aprobado para el tratamiento de SUA por la FDA (Food and Drug Administration/USA) en el año 2009. Un estudio Cochrane comparó la eficacia de múltiples anti- conceptivos hormonales con otras terapias en el tratamiento del sangrado menstrual abundante. Mientras los anticoncepti- vos hormonales combinados fueron efectivos en la reducción del sangrado en el 12 a 77% de las mujeres, el DIU hormonal
probó ser aún más efectivo (18).
El DIU-LNG puede lograr una disminución de la cantidad de sangrado en un 80% luego de 3 meses de uso y al 90% luego de 6 meses de uso. Un metanálisis que incluyó 1170 mujeres demostró que el DIU-LNG fue más eficaz en reducir la pér- dida de sangre que los tratamientos médicos convencionales, las usuarias estuvieron más satisfechas, hubo menos tasas de discontinuación y mejores índices de calidad de vida (19).
Este nivel de eficacia hace que el DIU-LNG aparezca como primera opción de tratamiento en la mayoría de las guías y con- sensos internacionales para las mujeres con SUA que no deseen gestación.
Con respecto a la utilización de estrógenos en el tratamiento de SUA los estudios son limitados y hay un solo tratamiento que está específicamente aprobado por la FDA con ese propósito: estrógenos conjugados equinos endovenosos 25 mg cada 4 a 6
horas por 24 horas. Este esquema de tratamiento está incluido en las guías del Colegio Americano de Obstetricia y Ginecología 2020, pero no está disponible en todos los países (20).
Los anticonceptivos combinados orales (ACOC) en múltiples dosis también son comúnmente utilizados en el tratamiento del SUA y se incluyen en diferentes guías internacionales. En un estudio comparativo se observó que la utilización de un ACOC que contenía 1 mg de noretisterona y 35 mcg de etinilestradiol tres veces por día por una semana para luego disminuir a una vez por día por 3 semanas, detuvo el sangrado en el 88% de las participantes en un promedio de 3 días. Las guías de del Colegio Americano de Obstetricia y Ginecología (ACOG) sostienen que, de forma equivalente, otras formula- ciones y dosis pueden ser igualmente efectivas.
Un consenso europeo sugiere las siguientes dosis de trata- miento: Comenzar con un comprimido de un anticonceptivo con 30 mcg de etinilestradiol y levonorgestrel 3 mg (o cual- quier otro con 30mcg) cada 6 h hasta el cese el sangrado, luego disminuir la dosis cada 8 h durante 2 días, y hasta 7 días, luego cada 12 h por 2 días y hasta 7 días y luego uno por día (21).
Para todas las pacientes se debe considerar las posibles contraindicaciones antes de su administración siguiendo los Criterios de Elegibilidad de la OMS (22).
Con respecto al uso de ACOC en SUA el preparado con va- lerato de estradiol y dienogest (VE2-DNG) multidosificado o cuatrifásico fue evaluado frente a placebo en dos estudios prospectivos aleatorizados (23, 24). Concluyeron que las dis- minuciones de la pérdida menstrual fueron mayores con el anticonceptivo (87-89%) que con el placebo (13-31%).
Esta eficacia marca una diferencia con estudios anteriores de anticonceptivos combinados, ya que sitúa al VE2-DNG como una de las primeras opciones terapéutica en términos de eficacia, apenas por detrás del DIU-LNG, y está aprobado por la FDA para tal fin.
El acetato de ulipristal fue estudiado en el tratamiento de miomas uterinos, con alta eficacia en disminuir el tamaño en un 45%, y en reducir el sangrado en un 90%. Debido a algunos casos que se detectaron de alteraciones en la función hepática, sólo debe utilizarse para el tratamiento intermiten- te de los síntomas, de moderados a graves, de los miomas uterinos, en mujeres que no han alcanzado la menopausia, cuando la embolización de tales miomas y/o las opciones de tratamiento quirúrgico no son adecuadas o han fracasado. Se debe monitorizar la función hepática de las pacientes, antes de empezar el tratamiento, durante el mismo y una vez que éste haya finalizado.
La desmopresina se utiliza para el tratamiento en pacientes con enfermedades de la coagulación especialmente en aque- llas con enfermedad de von Willebrand. Es un análogo sinté-
tico de la arginina vasopresina y actúa también induciendo la liberación de factor de Von Willebrand (FVW) y factor VIII de las células endoteliales. Puede ser administrada por vía endovenosa, subcutánea, o por spray nasal, ésta última vía es recomendada habitualmente como tratamiento profiláctico en dosis de 300 mcg en cada fosa nasal una vez por día en el día 2 o 3 de la menstruación (25).
Antagonista de GNRH
Los antagonistas de GnRH orales están siendo ampliamente estudiados actualmente para el tratamiento del SUA asociado con los miomas uterinos, incluyendo elagolix, relugolix y linza- golix (26). El agregado de estradiol y acetato de noretisterona como terapia add back mejora los efectos secundarios como la pérdida de masa ósea y tuforadas.
Con el tratamiento con relugolix se observa reducción del volumen de pérdida de sangrado menstrual desde el primer ciclo y a lo largo de un año de tratamiento, alcanzando una reducción del 89,9%, ausencia total del sangrado (ameno- rrea) en el más del 70% de las pacientes e incremento de los niveles de hemoglobina en más del 50% de las pacientes con anemia basal. También se evidenció mejoría del dolor y la ca- lidad de vida de las pacientes. El tratamiento con elagolix más terapia complementaria resultó eficaz en aproximadamente el 70% mujeres, mientras que en el grupo de placebo solo el 10% de las mujeres informaron mejoría (P<0.001) (27, 28). En USA está aprobado el Relugolix o elagolix más terapia add back con estradiol y acetato de noretisterona por 24 me- ses para el manejo SUA por miomas uterinos en mujeres pre- menopáusicas. También está aprobado en la Unión Europea con una indicación más amplia: tratamiento de los síntomas moderados a severos de los miomas uterinos en mujeres adul- tas en edad reproductiva y puede ser continuado hasta la me-
nopausia.
Conclusiones
- El tratamiento médico debe ser considerado la primera lí- nea terapéutica para la hemorragia uterina anormal de causa no estructural una vez descartado patología maligna con el fin de evitar que la mujer pase por un procedimiento quirúrgico innecesario que puede tener efectos secundarios
- Se debe tener en cuenta que el tratamiento puede ser a largo plazo y por lo tanto debe ser aceptado por la paciente.
- El objetivo de la terapia es disminuir la pérdida sanguínea, reducir el riesgo de anemia y mejorar la calidad de vida.
- El sangrado uterino representa la causa más común de deficiencia de hierro en los países desarrollados y es probable que se sume la terapia con hierro.
Referencias bibliográficas
- 1. Diagnosis of abnormal uterine bleeding in reproductive-aged women. Practice Bulle- tin N° 128. American College of Obstetrician and Gynecologist. Obstet Gynecol 2012; 120:197.
- 2. Munro MG, Critchley HOD, Fraser IS. The FIGO classification of causes of abnor- mal uterine bleeding in the reproductive years. Fertil Steril 2011; 95: 2204-8.
- 3. Mei-An Middelkoop, Emma E Don, Wou- ter J K Hehenkamp, Nicole J Polman, Arjan W Griffioen, Judith A F Huirne. Angiogene- sis in abnormal uterine bleeding: a narrati- ve review. Hum Reprod Update 2023 Jul 5;29(4):457-485.
- 4. Goyal BK, Gaur I, Sharma S, Saha A, Das NK. Transvaginal sonography versus hys- teroscopy in evaluation of abnormal uterine bleeding. Med J Armed Forces India. 2015; 71:120-5.
- 5. Diponible en https://www.nice.org.uk/ guidance/ng88 . Accedido en abril 2024.
- 6. Rosen A, VenturaChan W, Matelski J, Walsh C, Murj. Medical treatment of uteri- ne arteriovenous malformation:a systematic review and meta-analysis. Fertil Steril 2021 Oct;116(4):1107-1116.
- 7. Disponible en https://www.fasgo.org.ar/ images/CONSENSO_SUA_FASGO_2022.pdf
. Accedido en abril 2024.
- 8. Bofill Rodriguez M, Lethaby A, Farquhar
C. Non-steroidal anti-inflammatory drugs for heavy menstrual bleeding. Cochrane Databa- se Syst Rev. 2019;9(9).
- 9. Bonnar J, Sheppard BL. Treatment of menorrhagia during menstruation: randomi- sed controlled trial of ethamsylate, mefena- mic acid, and tranexamic acid. BMJ 1996; 313: 579 – 82.
- 10. Fraser I, McCarron G, Markham R, Ro- binson M, Smyth E. Long-term treatment of menorrhagia with mefenamic acid. Obstet Gynecol 1983; 61: 109 – 12.
- 11. Gleeson NC, Buggy F, Sheppard BL, Bonnar J . The effect of tranexamic acid on measured menstrual loss and endometrial fibrinolytic enzymes in dysfunctional uterine bleeding. Acta Obstet Gynecol Scand 1994; 73: 274 – 7.
- 12. Bryant-Smith AC, Lethaby A, Farqu- har C, Hickey M. Antifibrinolytics for heavy menstrual bleeding. Cochrane Database of Systematic Reviews 2018, Issue 4. Art. No.: CD000249.
- 13. Lukes A, Moore K, Muse K, Gersten J
Tranexamic acid treatment for heavy mens- trual bleeding: a randomized controlled trial. Obstet Gynecol 2010 Oct;116(4):865-875.
- 4. Bofill Rodriguez M, Lethaby A, Low C, Cameron IT. Cyclical progestogens for heavy menstrual bleeding. Cochrane Database of Systematic Reviews 2019, Issue 8.
- 15. Goshtasebi A, Moukhah S, Gandevani SB. Treatment of heavy menstrual bleeding of endometrial origin: randomized controlled trial of medroxyprogesterone acetate and tra- nexamic acid. Arch of Gynecol and Obstet 2013;288(5):1055-60.
- 16. Munro M, Mainor N, Basu R, Brisin- ger M, Barreda L. Oral medroxyprogesterone acetate and combination oral contracepti- ves for acute uterine bleeding: a randomi- zed controlled trial. Obstet Gynecol. 2006 Oct;108(4):924-9.
- 17. Ammerman SR, Nelson A. A new pro- gestogen-only medical therapy for outpatient management of acute, abnormal uterine ble- eding: a pilot study. Am J Obstet Gynecol. 2013;208(6):499 e1–5.
- 18. Combined hormonal contraceptives for heavy menstrual bleeding Cochrane review 11 Feb 2019.
- 19. Qiu J, Cheng J, Wang Q, Hua J. Levono- gestrel-releasing intrauterine system versus medical therapy for menorrhagia: a systema- tic review and meta-analysis. Medical Scien- ce Monitor 2014; 20:1700-13.
- 20. Management of Acute Abnormal Ute- rine Bleeding in Nonpregnant Reproducti- ve-Aged WomenNumber 557 (Reaffirmed 2020). Disponible en https://www.acog.org/ clinical/clinical-guidance/committee-opinion/ articles/2013/04/management-of-acute-ab- normal-uterine-bleeding-in-nonpregnant-re- productive-aged-women. Accedido en abril 2024.
- 21. James A, Kouides P y col. Evaluation and management of acute menorrhagia in women with and without underlying bleeding disorders: consensus from an international expert panel. Eur J Obstet Gynecol Reprod Biol 2011 Oct;158(2):124-34.
- 22. Organización Mundial de la Salud (2014). Criterios médicos de elegibili- dad para el uso de anticonceptivos, quinta edición 2015: resumen ejecutivo, 5a ed. Organización Mundial de la Salud. Dis- ponible en https://apps.who.int/iris/hand- le/10665/205016. Accedido en mayo 2022.
- 23. Fraser IS, Römer T, Parke S, Zeun S, Mellinger U, Machlitt A et al. Effective treat- ment of heavy and/or prolonged menstrual
bleeding with an oral contraceptive contai- ning estradiol valerate and dienogest: a ran- domized, double-blind Phase III trial. Hum Reprod. 2011; 26: 2698-708.
- 24. Jensen JT, Parke S, Mellinger U, Ma- chlitt A, Fraser IS. Effective treatment of hea- vy menstrual bleeding with estradiol valerate and dienogest: a randomized controlled trial. Obstet Gynecol. 2011; 117: 777-87.
- 25. Kadir RA, Lukes AS, Kouides PA, Fernandez H, Goudemand J, Management of excessive menstrual bleeding in wo- men with hemostatic disorders, Fertil Steril 2005;84:1352, 2005.
- 26. Al-Hendy A, Lukes AS, Poindexter AN III, et al. Treatment of uterine fibroid symp- toms with relugolix combination therapy. N Engl J Med. 2021;384(7):630–42.
- 27. Schlaff WD, et al., Elagolix for Heavy Menstrual Bleeding in Women with Uteri- ne Fibroids. N Engl J Med, 2020; 382(4): 328–340.
- 28. Simon JA, et al., Elagolix Treatment for Up to 12 Months in Women With Heavy Menstrual Bleeding and Uterine Leiomyomas. Obstet Gynecol, 2020; 135(6): 1313–1326.







No comments! Be the first commenter?