Redescubriendo a la metformina:mecanismo de acción y acciones farmacológicas
Resumen
Hace más de 100 años que se estableció el uso de las biguanidas para diversas enfermedades metabólicas. Sin embargo, sólo recientemente se es- tableció a la metformina como principal fármaco del grupo por su mejor perfil de seguridad, y se reconoció el principal mecanismo de acción (activación de la AMP Kinasa) y sitios de acción (no sólo el hepatocito, sino también los enterocitos con efecto incretino-símil, e incluso modificación de la micro- biota). Estos hechos posicionaron a la metformina en la primera línea de recomendación de fármacos para la diabetes tipo 2 así como de diversas enfermedades cardiometabólicas.
Palabras clave
Metformina – Diabetes mellitus tipo 2 – Cardiometabolismo.
Introducción
Las Biguanidas, como la Fenformina y la Metformina se originaron en el año 1920 a partir de la Galega officinalis, hierba utilizada en la Europa medieval para el tratamiento de diversas patologías. La Fenformina fue la primera biguani- da utilizada como antidiabético, pero en la década de 1970 fue retirada del mercado por su riesgo significativo de acido- sis láctica. Posteriormente se descubrió que la Metformina presentaba un perfil de seguridad mucho más favorable, por lo que en la actualidad se ha incorporado como primera lí- nea terapéutica de la diabetes tipo 2 (1) y es utilizada con menor grado de recomendación por sus beneficios en otras patologías metabólicas asociadas (la enfermedad esteatósica asociada al metabolismo (MASLD), síndrome metabólico, so- brepeso-obesidad, síndrome de ovario poliquístico (PCOS)).
A pesar de sus reconocidas acciones metabólicas, el reco-
nocimiento de su mecanismo de acción específico y sus ac- ciones farmacológicas ha avanzado recientemente. Por ello, nuestro objetivo fue realizar una revisión para describir de qué manera la Metformina genera un efecto antihiperglucemiante así como los avances en el conocimiento de otras acciones farmacológicas que podrían tener impacto en diferentes indi- caciones terapéuticas.
Métodos
Se realizó una revisión amplia en la literatura, de bases de datos convencionales desde el inicio hasta mayo 2024, además se realizó búsqueda específica en las directrices de diferentes sociedades científicas y libros acordes. La informa- ción reunida fue evaluada por título y resumen por 3 autores (M.B., J.F.M., M.N.F.) para ser luego desarrollada y revisada por todos los autores. Los autores declaran no tener conflictos de intereses, y no han recibido financiación para el desarrollo de este. En esta publicación médica no se describen datos de pacientes por lo que no se requirió consentimiento para el mismo. Los autores además describen que no se ha utilizado inteligencia artificial generativa en la redacción de este docu- mento o en la confección de tablas-gráficos.
Desarrollo
De acuerdo con lo establecido clásicamente, el principal mecanismo de acción de la Metformina tiene lugar en los he- patocitos. Este fármaco actúa a nivel mitocondrial inhibiendo el primer complejo de la cadena de transporte de electrones (2), lo que genera una disminución en la producción de ATP y como consecuencia una activación de la vía de la AMPK. Como resultado se produce una disminución de la gluconeo- génesis hepática, lo que podría explicar el efecto antihiperglu- cemiante de la Metformina.
A partir de un minucioso análisis del mecanismo de acción de la Metformina y no solo de sus efectos terapéuticos, sino también adversos, nos preguntamos si el efecto antihiper- glucemiante puede explicarse únicamente por la reducción de la gluconeogénesis hepática. Lo que se observó es que la disminución de la producción endógena de glucosa explica parcialmente el efecto (3), sugiriendo que el efecto antihiper- glucemiante depende de otros mecanismos.
A partir de la realización de estudios PET se demostró que la metformina por vía oral se concentra en el intestino, riñón, hígado y vejiga (4), lo que propone que las células intestinales tienen acciones directas sobre el metabolismo glucídico y que la alteración de la composición de la microbiota tiene a su vez implicancia en el efecto antihiperglucemiante.
Estudios PET realizados en pacientes con diabetes tipo 2 que recibían Metformina por vía oral demostraron que este fármaco aumenta la utilización de glucosa en el intestino. ¿Cómo se explica esto? Se les administró a los participantes fluorodesoxi- glucosa (derivado no metabolizable de la glucosa) por vía endo- venosa, la cual tras ingresar al enterocito a través de los GLUT 2 presentes en la membrana basolateral se acumuló en dichas células, paralelamente a una activación de AMPK (5, 6).
Lo que se plantea es que el intestino capta glucosa desde la luz gastrointestinal en su porción proximal, y desde la cir- culación sistémica en su porción distal. Al bloquear la cadena de transporte de electrones a nivel de los enterocitos, la met- formina obliga a estos últimos a producir energía a través del metabolismo anaeróbico de la glucosa (7). En las regiones más proximales del intestino delgado, esta glucosa es captada desde la luz intestinal para su consumo inmediato (disminu- yendo así la absorción intestinal de glucosa), mientras que, en las regiones más distales del intestino delgado y en el colon, al haber una menor disponibilidad de glucosa luminal los en- terocitos tenderán a captar la glucosa desde la sangre (lo que se condice con una captación de fluorodesoxiglucosa y una activación de la AMPK más significativas en los enterocitos del colon (8).
Esto sugiere que la glucosa utilizada por los enterocitos pro- cede no sólo de la luz intestinal, sino también de la circula- ción sistémica, lo que genera una disminución de la glucosa en sangre y un aumento de glucosa en el enterocito, contri- buyendo al efecto antihiperglucemiante. Básicamente en pre- sencia de Metformina, el intestino actúa como un sumidero de glucosa (9), la cual capta no sólo desde la luz intestinal, sino también desde la circulación sistémica para su consumo a nivel del enterocito.
Una vez que la glucosa ingresa al enterocito, se metaboliza de manera anaeróbica produciendo lactato y acetato, los cua- les son luego liberados a la circulación portal. Este aumento
Tabla 1
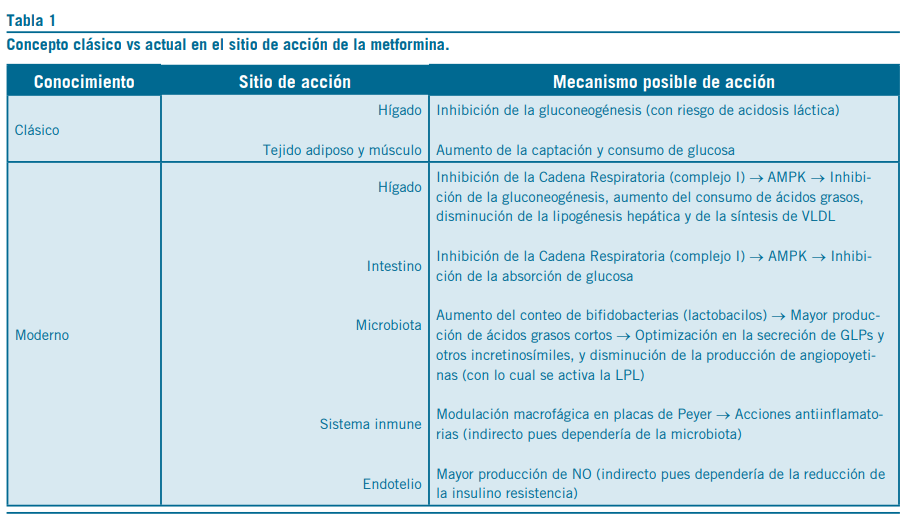
en las concentraciones de lactato y acetato establece una vía común de acción entre el hígado y el intestino (10) para ate- nuar la producción hepática de glucosa.
Esto probablemente se deba por un lado a la disminución de la actividad de la enzima piruvato carboxilasa, por una dis- minución del pH en la vena porta tras el incremento de lac- tato, y por otro lado por la acetilación de los transportadores de piruvato mitocondriales 1 y 2 secundaria al incremento de acetato. De esta manera disminuye la gluconeogénesis hepáti- ca debido a una disminución del oxalacetato disponible y una menor oferta de piruvato dentro de la mitocondria.
Relación entre Metformina, microbiota, y los efectos incretino-símiles
El intestino no es el único que tiene un rol protagónico en el mecanismo de acción de la Metformina, la microbiota también: La Metformina ocasiona, a través de un mecanismo AMPK dependiente (11), una alteración de la composición de la microbiota intestinal (12), lo cual genera una modifica- ción en la expresión de genes relacionados con la absorción intestinal de glucosa y ácidos grasos. Como consecuencia disminuye la presencia de Bacteroides fragilis y su actividad hidrolasa sobre los ácidos biliares, obteniendo como resultado un aumento del ácido glico-ursodesoxicólico, el cual inhibe la señalización del receptor farnesoide X intestinal (13). Esto último genera como consecuencia un aumento en la secreción y por ende los niveles plasmáticos del péptido símil glucagón de tipo 1 (GLP-1).
De esta manera, la Metformina regula indirectamente a partir del incremento de GLP-1 los niveles de glucemia tras estimular la secreción de insulina, inhibir la secreción de glu- cagón, contribuir a la disminución del apetito (efecto anorexí- geno) y enlentecer el vaciado gástrico.
La Metformina independientemente de su formulación es capaz de incrementar la secreción de GLP-1 (15). Cuando esta se administra por vía oral, se acumula en los enterocitos (30-300 veces más que en el plasma) (16) promoviendo la li- beración de GLP-1 por un mecanismo dependiente de AMPK. Además, estudios realizados en modelos murinos pudieron demostrar que han podido aumentar la respuesta al GLP-1 mediante un aumento de sus receptores en los islotes pan- creáticos (17).
Otra teoría que deja de lado la vía de la AMP Kinasa estable- ce que el GLP 1 es secretado por células enteroendocrinas de tipo L en respuesta a la presencia de nutrientes a nivel intesti- nal (14). Esta teoría refiere a que la Metformina disminuye la absorción de glucosa a nivel proximal del intestino delgado, lo que genera un incremento de las concentraciones de glucosa a nivel distal. Ello estimula la secreción de GLP 1 por parte de las células enteroendocrinas L del íleon. No es la metformina directamente, sino que este efecto se da por la disminución en la reabsorción proximal de glucosa, que permite una me- nor llegada de la misma a nivel distal (18). Debemos aclarar que esta teoría presenta algunos conceptos diferentes a los planteados por la mayoría de las publicaciones previamente mencionadas.
Relación entre Metformina y el sistema inmunitario
El sistema inmunitario desempeña un papel central en el inicio y la progresión de muchas patologías. En el caso de las enfermedades cardiometabólicas, está ampliamente do- cumentada la contribución de la inflamación crónica de bajo grado a la disfunción metabólica y al desarrollo de la ateros- clerosis. La obesidad induce diversos grados de inflamación en el tejido adiposo, los islotes pancreáticos y el hígado, lo que contribuye a la esteatosis hepática, la resistencia sisté- mica a la insulina y la progresión hacia la diabetes tipo 2, la enfermedad esteatósica asociada al metabolismo (MASLD) y las enfermedades cardiovasculares.
La interacción entre las células inmunitarias parenquimato- sas y residentes en los tejidos dentro de nichos locales en ór- ganos metabólicos es central en estos procesos inflamatorios. Llamativamente, la Metformina ha demostrado tener efectos antiinflamatorios a través de mecanismos tanto dependientes como independientes de AMP Kinasa en estudios transversa- les en pacientes con diabetes tipo 2, varios estudios de inter- vención en modelos de roedores con obesidad y diabetes tipo 2, y en experimentos in vitro y ex vivo en varios tipos celulares inmunitarios.
Un estudio demostró que el tratamiento con Metformina en pacientes con diabetes tipo 2 mejora la función mitocondrial de las células mononucleares de sangre periférica (PBMc) a través de una disminución en la producción de especies reac- tivas del oxígeno (ROS), a causa de un aumento en la expre- sión de los complejos de la cadena de transporte de electro- nes, que se comparan a los de pacientes sanos. Además, se pudo apreciar un aumento en la AMP Kinasa total y fosforila- da en las PBMc, un aumento en la mitofagia mitocondrial, y a una disminucion en suero de las citoquinas proinflamatorias TNFa e IL-6 (19).
Por otro lado, en un ensayo controlado con placebo en pa- cientes con prediabetes, el tratamiento con Metformina re- dujo las concentraciones de los componentes de las trampas extracelulares de neutrófilos (NET), como elastasa, proteinasa 3, histonas y ADN de doble cadena, independientemente de su efecto en normalizar los niveles de glucosa. Este hallazgo sugiere que la metformina puede reducir la NETosis en neu- trófilos activados, lo cual es importante para la defensa del huésped contra patógenos y está implicado en el daño tisu- lar mediado por la inflamación y la trombosis. La metformina también induce una inhibición dependiente de la dosis de la NETosis inducida por acetato de 12-miristoil 13-acetato de forbol e ionomicina in vitro a concentraciones dentro del rango terapéutico (20).
Los cambios en el metabolismo de los macrofagos, resul- tado de las alteraciones en los microambientes dentro de los órganos metabólicos, se cree que pueden alterar su función y promover un estado proinflamatorio asociado a la obesidad. Más aún, la metformina podría aliviar la inflamación supri- miendo la síntesis intracelular de ácidos grasos en macrófa- gos. Profundizando a niveles moleculares, la metformina re- duce la síntesis de ácidos grasos mediada por la sintasa de ácidos grasos (FASN) y la supresión de FASN causada por la metformina contribuye a reducir la palmitoilación de Akt, lo que a su vez interfiere en su reclutamiento a la membrana y su activación (fosforilación), asociado a una disminución en la fosforilación de p65 e IkB en macrófagos, lo que contribu- ye a una menor activación de NF-kB y a una reducción en la expresión de citocinas inflamatorias (21).
A su vez, los niveles de proteínas asociadas a la inflama- ción, como iNOS, COX 2, p-p65 y p-IkB, también siguieron una tendencia a la baja cuando los macrófagos fueron expues- tos a la metformina (22).
La NETosis ha sido reconocida como una nueva característica de la inmuno-inflamación asociada con la diabetes (23). Un estudio que fue realizado en pacientes con prediabetes, se descubrió que la metformina atenúa la NETosis de manera dependiente de la dosis in vitro, lo cual es consistente con un efecto directo del medicamento sobre la maquinaria de NE- Tosis, independientemente de sus efectos metabólicos (24).
Conclusiones
Se ha revisado el mecanismo de acción y las acciones farmacológicas de la metformina. Podemos concluir que existe consenso en que, además del conocido efecto en los hepatocitos, la modulación de la captación de glucosa en los enterocitos, los efectos incretino-símiles, y los efectos en la microbiota, explicarían los beneficios metabólicos de la metformina (así como los potenciales efectos adversos). Si bien el potencial efecto en las patologías metabólicas más allá de la diabetes es evidente, el beneficio sería marginal, limitado por su propio mecanismo de acción y potenciales efectos adversos.
Referencias bibliográficas
- 1. American Diabetes Association Professional Practice Committee. 9. Pharmacologic Approaches to Glycemic Treatment: Standards of Care in Diabetes-2024. Diabetes Care. 2024 Jan 1;47(Suppl 1):S158-S178. doi: 10.2337/dc24-S009. Erratum in: Diabetes Care. 2024 Jul 1;47(7):1238. doi: 10.2337/dc24-er07a. PMID: 38078590; PMCID: PMC10725810.
- 2. Owen MR, Doran E, Halestrap AP. Evidence that metformin exerts its anti-diabetic effects through inhibition of complex 1 of the mitochondrial respiratory chain. Biochem J. 2000 Jun 15;348 Pt 3(Pt 3):607-14. PMID: 10839993; PMCID: PMC1221104.
- 3. Natali A, Ferrannini E. Effects of metformin and thiazolidinediones on suppression of hepatic glucose production and stimulation of glucose uptake in type 2 diabetes: a systematic review. Diabetologia. 2006 Mar;49(3):434-41. doi: 10.1007/s00125-006-0141-7. Epub 2006 Feb 14. PMID: 16477438.
- 4. Gormsen LC, Sundelin EI, Jensen JB, Vendelbo MH, Jakobsen S, Munk OL, Hougaard Christensen MM, Brøsen K, Frøkiær J, Jessen N. In Vivo Imaging of Human 11C-Metformin in Peripheral Organs: Dosimetry, Biodistribution, and Kinetic Analyses. J Nucl Med. 2016 Dec;57(12):1920-1926. doi: 10.2967/jnumed.116.177774. Epub 2016 Jul 28. PMID: 27469359.
- 5. Yasuko Morita, Munenobu Nogami, Kazuhiko Sakaguchi, Yuko Okada, Yushi Hirota, Kenji Sugawara, Yoshikazu Tamori, Feibi Zeng, Takamichi Murakami, Wataru Ogawa; Enhanced Release of Glucose Into the Intraluminal Space of the Intestine Associated With Metformin Treatment as Revealed by [18F]Fluorodeoxyglucose PET-MRI. Diabetes Care 1 August 2020; 43 (8): 1796–1802. https://doi.org/10.2337/dc20-0093
- 6. Ait-Omar A, Monteiro-Sepulveda M, Poitou C, Le Gall M, Cotillard A, Gilet J, Garbin K, Houllier A, Château D, Lacombe A, Veyrie N, Hugol D, Tordjman J, Magnan C, Serradas P, Clément K, Leturque A, Brot-Laroche E. GLUT2 accumulation in enterocyte apical and intracellular membranes: a study in morbidly obese human subjects and ob/ob and high fat-fed mice. Diabetes. 2011 Oct;60(10):2598-607. doi: 10.2337/db10-1740. Epub 2011 Aug 18. PMID: 21852673; PMCID: PMC3178286.
- 7. Rittig, N., Aagaard, N. K., Sundelin, E., Villadsen, G. E., Sandahl, T. D., Holst, J. J., Hartmann, B., Brøsen, K., Grønbæk, H., & Jessen, N. (2021). Metformin Stimu- lates Intestinal Glycolysis and Lactate Release: A single-Dose Study of Metformin in Patients With Intrahepatic Portosystemic Stent. Clinical Pharmacology & Therapeutics, 110(5), 1329-1336. https://doi.org/10.1002/cpt.2382
- 8. Massollo M, Marini C, Brignone M, Emionite L, Salani B, Riondato M, Capitanio S, Fiz F, Democrito A, Amaro A, Morbelli S, Piana M, Maggi D, Cilli M, Pfeffer U, Sambuceti G. Metformin temporal and localized effects on gut glucose metabolism assessed using 18F-FDG PET in mice. J Nucl Med. 2013 Feb;54(2):259-66. doi: 10.2967/jnumed.112.106666. Epub 2013 Jan 3. PMID: 23287574.
- 9. Foretz, M., Guigas, B., & Viollet, B. (2023). Metformin: update on mechanisms of action and repurposing potential. Nature Reviews Endocrinology, 19(8), 460-476. https://doi.org/10.1038/s41574-023-00833-4.
- 10. Tobar N, Rocha GZ, Santos A, Guadagnini D, Assalin HB, Camargo JA, Gonçalves AESS, Pallis FR, Oliveira AG, Rocco SA, Neto RM, de Sousa IL, Alborghetti MR, Sforça ML, Rodrigues PB, Ludwig RG, Vanzela EC, Brunetto SQ, Boer PA, Gontijo JAR, Geloneze B, Carvalho CRO, Prada PO, Folli F, Curi R, Mori MA, Vinolo MAR, Ramos CD, Franchini KG, Tormena CF, Saad MJA. Metformin acts in the gut and induces gut-liver crosstalk. Proc Natl Acad Sci U S A. 2023 Jan 24;120(4):e2211933120. doi: 10.1073/pnas.2211933120. Epub 2023 Jan 19. PMID: 36656866; PMCID: PMC9942892.
- 11. Zhang, E., Jin, L., Wang, Y., Tu, J., Zheng, R., Ding, L., Fang, Z., Fan, M., Al-Abdullah, I., Natarajan, R., Ma, K., Wang, Z., Riggs, A. D., Shuck, S. C., Yang, L., & Huang, W. (2022). Intestinal AMPK modulation of microbiota mediates crosstalk with brown fat to control thermogenesis. Nature Communications, 13(1). https://doi. org/10.1038/s41467-022-28743-5.
- 12. Wu H, Esteve E, Tremaroli V, Khan MT, Caesar R, Mannerås-Holm L, Ståhlman M, Olsson LM, Serino M, Planas-Fèlix M, Xifra G, Mercader JM, Torrents D, Burcelin R, Ricart W, Perkins R, Fernàndez-Real JM, Bäckhed F. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the the- rapeutic effects of the drug. Nat Med. 2017 Jul;23(7):850-858. doi: 10.1038/nm.4345. Epub 2017 May 22. PMID: 28530702.
- 13. Sun L, Xie C, Wang G, Wu Y, Wu Q, Wang X, Liu J, Deng Y, Xia J, Chen B, Zhang S, Yun C, Lian G, Zhang X, Zhang H, Bisson WH, Shi J, Gao X, Ge P, Liu C, Krausz KW, Nichols RG, Cai J, Rimal B, Patterson AD, Wang X, Gonzalez FJ, Jiang C. Gut microbiota and intestinal FXR mediate the clinical benefits of metformin. Nat Med. 2018 Dec;24(12):1919-1929. doi: 10.1038/s41591-018-0222-4. Epub 2018 Nov 5. PMID: 30397356; PMCID: PMC6479226.
- 14. Borg MJ, Bound M, Grivell J, Sun Z, Jones KL, Horowitz M, Rayner CK, Wu T. Comparative effects of proximal and distal small intestinal administration of metformin on plasma glucose and glucagon-like peptide-1, and gastric emptying after oral glucose, in type 2 diabetes. Diabetes Obes Metab. 2019 Mar;21(3):640-647. doi: 10.1111/ dom.13567. Epub 2018 Nov 21. PMID: 30370686.
- 15. DeFronzo RA, Buse JB, Kim T, Burns C, Skare S, Baron A, Fineman M. Once-daily delayed-release metformin lowers plasma glucose and enhances fasting and postprandial GLP-1 and PYY: results from two randomised trials. Diabetologia. 2016 Aug;59(8):1645-54. doi: 10.1007/s00125-016-3992-6. Epub 2016 May 23. PMID: 27216492; PMCID: PMC4930485.
- 16. Wilcock C, Bailey CJ. Accumulation of metformin by tissues of the normal and diabetic mouse. Xenobiotica. 1994 Jan;24(1):49-57. doi: 10.3109/00498259409043220. PMID: 8165821.
- 17. Maida A, Lamont BJ, Cao X, Drucker DJ. Metformin regulates the incretin receptor axis via a pathway dependent on peroxisome proliferator-activated receptor-a in mice. Diabetologia. 2011 Feb;54(2):339-49. doi: 10.1007/s00125-010-1937-z. Epub 2010 Oct 23. PMID: 20972533.
- 18. Wu T, Xie C, Wu H, Jones KL, Horowitz M, Rayner CK. Metformin reduces the rate of small intestinal glucose absorption in type 2 diabetes. Diabetes Obes Metab. 2017 Feb;19(2):290-293. doi: 10.1111/dom.12812. Epub 2016 Nov 21. PMID: 27761984.
- 19. De Marañón AM, Díaz-Pozo P, Canet F, Díaz-Morales N, Abad-Jiménez Z, López-Domènech S, Vezza T, Apostolova N, Morillas C, Rocha M, Víctor VM. Metformin modulates mitochondrial function and mitophagy in peripheral blood mononuclear cells from type 2 diabetic patients. Redox Biol. 2022 Jul;53:102342. doi: 10.1016/j. redox.2022.102342. Epub 2022 May 17. PMID: 35605453; PMCID: PMC9124713.
- 20. Menegazzo L, Scattolini V, Cappellari R, Bonora BM, Albiero M, Bortolozzi M, Romanato F, Ceolotto G, Vigili de Kreutzeberg S, Avogaro A, Fadini GP. The antidiabetic drug metformin blunts NETosis in vitro and reduces circulating NETosis biomarkers in vivo. Acta Diabetol. 2018 Jun;55(6):593-601. doi: 10.1007/s00592-018-1129-8. Epub 2018 Mar 15. PMID: 29546579.
- 21. Xiong W, Sun KY, Zhu Y, Zhang X, Zhou YH, Zou X. Metformin alleviates inflammation through suppressing FASN-dependent palmitoylation of Akt. Cell Death Dis. 2021 Oct 12;12(10):934. doi: 10.1038/s41419-021-04235-0. PMID: 34642298; PMCID: PMC8511025.
- 22. Xiong W, Sun KY, Zhu Y, Zhang X, Zhou YH, Zou X. Metformin alleviates inflammation through suppressing FASN-dependent palmitoylation of Akt. Cell Death Dis. 2021 Oct 12;12(10):934. doi: 10.1038/s41419-021-04235-0. PMID: 34642298; PMCID: PMC8511025.
- 23. Xiong W, Sun KY, Zhu Y, Zhang X, Zhou YH, Zou X. Metformin alleviates inflammation through suppressing FASN-dependent palmitoylation of Akt. Cell Death Dis. 2021 Oct 12;12(10):934. doi: 10.1038/s41419-021-04235-0. PMID: 34642298; PMCID: PMC8511025.
- 24. Menegazzo L, Scattolini V, Cappellari R, Bonora BM, Albiero M, Bortolozzi M, Romanato F, Ceolotto G, Vigili de Kreutzeberg S, Avogaro A, Fadini GP. The antidiabetic drug metformin blunts NETosis in vitro and reduces circulating NETosis biomarkers in vivo. Acta Diabetol. 2018 Jun;55(6):593-601. doi: 10.1007/s00592-018-1129-8. Epub 2018 Mar 15. PMID: 29546579.







No comments! Be the first commenter?