La microbiota intestinal es una comunidad compleja de microorganismos que coloniza el intestino, y que ejerce numerosas funciones, como la metabolización de alimentos, la protección contra patógenos, la síntesis de metabolitos esenciales, el mantenimiento de la integridad de la mucosa intestinal y la modulación de la respuesta inmune. La disbiosis microbiana, es decir las alteraciones en su composición y/o función, ha sido implicada en numerosas enfermedades intestinales, metabólicas, alérgicas, autoinmunes y dermatológicas, así como también en desórdenes psiquiátricos y condiciones del neurodesarrollo. El eje “intestino-cerebro” comprende una compleja comunicación bidireccional entre el intestino y el cerebro que está finamente regulada por los sistemas endócrino, inmune y nervioso (autónomo y entérico). Investigaciones recientes han demostrado que la microbiota intestinal y los metabolitos que produce cumplirían un papel fundamental en este eje. Actualmente existe numerosa evidencia sobre la implicancia de la microbiota en trastornos depresivos, de ansiedad y en el comportamiento, si bien aún no se conocen exactamente los mecanismos de esta interacción. Esta revisión pretende ahondar en el análisis de las vías de seña- lización implicadas en el eje microbiota-intestino-cerebro, y en las alteraciones de la microbiota intestinal observadas en dos de las patologías mentales más estudiadas en relación al tema, los desórdenes depresivos y el trastorno del espectro autista.
Palabras clave
Microbiota intestinal – Desórdenes depresivos – Trastorno del espectro autista – Eje microbiota-intestino-cerebro – Probióticos.
Keller ML. “Papel de la microbiota en el eje intestino-cerebro: Su implicancia en desórdenes psiquiátricos y del neurodesarrollo”. Psicofarmacología 2023;135:11-17. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
En el término más amplio, la microbiota es una comunidad compleja de microorganismos que puebla un hábitat. La mi- crobiota autóctona es aquella que coloniza el cuerpo humano, y está constituida principalmente por bacterias, aunque tam- bién incluye virus, hongos (sobre todo levaduras), protozoos y arqueas. Se define como microbioma a todo el hábitat, inclu- yendo los microorganismos, sus genomas y las condiciones ambientales circundantes (metabolitos, elementos genéticos
móviles, estructuras microbianas, moléculas de señalización, etcétera) (1, 2).
La microbiota intestinal, especialmente la localizada en el colon, llega a alcanzar densidades de 1011-1012 células/ml. (3, 4). Está compuesta principalmente por dos filos bacteria- nos, Firmicutes y Bacteroidetes (que suponen el 90% de la microbiota intestinal) y, en menor medida, los filos Actinobacteria, Proteobacteria y Verrucomicrobia (4, 5). El filo Firmicu- tes incluye un gran número de géneros, siendo algunos de los
más importantes Lactobacillus, Clostridium y Ruminococcus. El filo Bacteroidetes incluye bacterias pertenecientes a los géneros Bacteroides y Prevotella. El principal género del filo Actinobacteria es Bifidobacterium. Las proteobacterias están representadas fundamentalmente por miembros de la fami- lia Enterobacteriaceae, mientras que el filo Verrucomicrobia tiene un único integrante, Akkermansia muciniphila. Recien- temente se ha realizado una revisión taxonómica, que ha mo- dificado los nombres del filo Firmicutes por Bacillota, Bacte- roidetes por Bacteroidota, Actinobacteria por Actinomycetota y Proteobacteria por Pseudomonadota, además de cambiar la nomenclatura de algunos géneros y especies (6).
Las bacterias de la microbiota intestinal ejercen numerosas funciones, tales como la metabolización de alimentos que el organismo no puede procesar, como fibra dietética y carbohi- dratos complejos; la protección contra patógenos mediante ex- clusión competitiva y producción de bacteriocinas; la síntesis de metabolitos esenciales, como algunas vitaminas y neuro- transmisores; el mantenimiento de la integridad de la mucosa intestinal y la modulación de la respuesta inmune, incluyendo la tolerancia oral a los alimentos. La biodiversidad microbia- na y su actividad generan un equilibrio homeostático entre la microbiota y el hospedador. La disbiosis, una ruptura de este equilibrio causada por varios factores, ha sido implicada en nu- merosas enfermedades y condiciones, tales como enfermedad inflamatoria intestinal, cáncer de colon, obesidad, alergias, asma y desórdenes psiquiátricos y del neurodesarrollo (7).
El eje “microbiota-intestino-cerebro” está compuesto por el sistema nervioso central (SNC), los sistemas neuroendócrino y neuroinmune, el sistema nervioso autónomo (simpático y parasimpático), el sistema nervioso entérico (SNE) y la mi- crobiota intestinal. Actualmente existe numerosa evidencia sobre el papel de ésta en desórdenes depresivos, trastornos de ansiedad y en el comportamiento, si bien aún no se cono- cen exactamente los mecanismos de la interacción entre la microbiota y el SNC (7).
Vías de comunicación del eje microbiota-in- testino-cerebro
La compleja comunicación bidireccional entre el intestino y el cerebro está finamente orquestada por los sistemas en- dócrino, inmune y nervioso. Existen crecientes evidencias de que los denominados péptidos intestinales jugarían un papel muy importante en las vías de señalización de este eje. Estos péptidos secretados en el intestino, alcanzan la circulación sanguínea y tienen receptores en células inmunes y en ter- minaciones del nervio vago, permitiendo de esta manera una comunicación entre el intestino y el cerebro. La concentración
de dichas moléculas no sólo está modulada por señales de la microbiota intestinal, sino que también varía de acuerdo a su composición (5, 7).
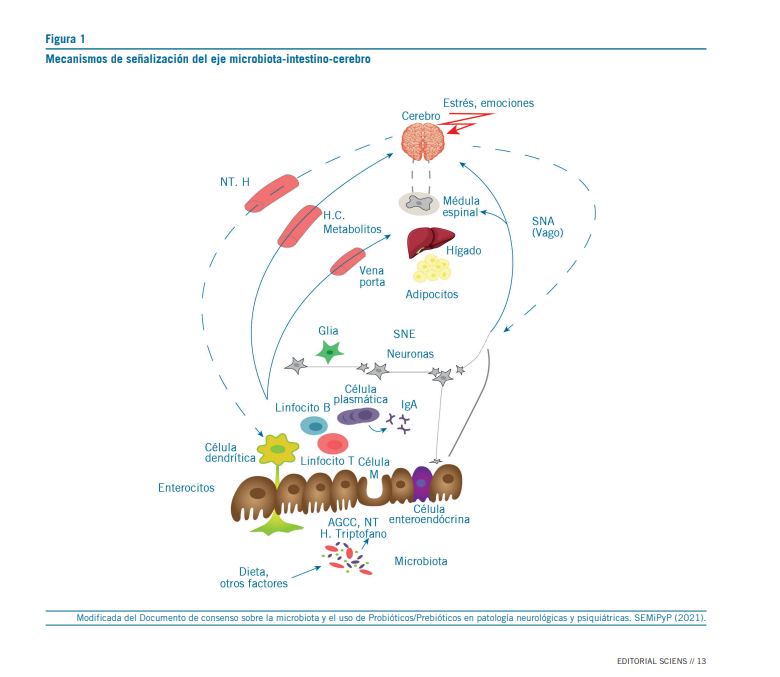
En la figura 1 se esquematizan las principales vías de seña- lización del eje microbiota-intestino-cerebro. Existen nume- rosos mecanismos a través de los cuales la microbiota puede enviar señales al cerebro para controlar procesos fisiológicos. Uno de ellos es la liberación de péptidos por las células en- teroendócrinas (CEE). Algunos de esos péptidos como el neu- ropéptido Y (NPY) pueden ser liberados también a través de la estimulación inmune mediada por citoquinas (7). Varios de los péptidos liberados en el intestino y sus receptores también se hallan en el cerebro, donde cumplen funciones bien esta- blecidas en la neurobiología de la ansiedad y la depresión, y además juegan un papel en la regulación central del apetito y la ingesta de alimentos, en particular vía el núcleo hipotalá- mico. Llamativamente, la obesidad y los desórdenes psiquiá- tricos comúnmente están asociados (5, 8).
Los distintos péptidos son secretados por CEE específicas en diferentes localizaciones del intestino. Así, la grelina es secretada por células X/A-like, y está asociada con el timing de la comida, es decir el momento óptimo de ingesta de ali- mentos. En el intestino delgado proximal las células I secre- tan colecistoquinina (CCK), que participa en la regulación del vaciado gástrico y del control del apetito.
En el intestino delgado distal, las células L producen gluca- gón like-peptide (GLP) 1 y 2, y péptido YY (PYY). Siguiendo a su secreción, estas moléculas difunden a través de la lámina propia, alcanzan el torrente sanguíneo y estimulan neuronas sensoras y al nervio vago. La barrera hematoencefálica facilita selectivamente su transporte en la dirección sangre-cerebro, sugiriendo una vía directa de algunos péptidos intestinales que no son degradados luego de su liberación. Dada su ubi- cación en el tracto gastrointestinal, es posible que estos pép- tidos puedan ser influenciados por cambios en la microbiota intestinal y de esta manera modular, directa o indirectamente, señales hacia el cerebro (5, 7).
Por otra parte, dependiendo de la composición dietaria, la microbiota y sus productos de fermentación, como ácidos grasos de cadena corta (AGCC) y ácido gamma-aminobutírico (GABA), pueden influenciar la comunicación del eje micro- biota-intestino-cerebro. La dopamina y la 5-hidroxitriptamina o serotonina (5-HT) también son secretadas a nivel intestinal. Más del 50 % de la dopamina proviene del intestino, producida por bacterias como Escherichia coli, Bacillus cereus, Proteus vulgaris y Staphylococcus aureus. Este neurotransmisor es cen- tral en los comportamientos de búsqueda y recompensa. La
serotonina está involucrada en el miedo, y más del 90 % de esta molécula es sintetizada en el intestino. Algunas bacterias utilizan el triptófano de la dieta para convertirlo en triptamina, y así alteran la disponibilidad de triptófano en el hospedador, reduciendo la producción de serotonina en el cerebro (5, 7, 9).
Papel de la microbiota en los desórdenes depresivos
Los desórdenes depresivos (DD) representan un importan- te problema de salud, que afecta no sólo al individuo sino a su entorno familiar, social y laboral. Se trata de un desorden complejo en cuya etiología intervienen factores genéticos y ambientales. La prevalencia en el mundo es de 10 a 25 % en mujeres y 5 a 12 % en hombres, y un tercio de las consultas a psiquiatras son a causa de la depresión. El DD se define por episodios de decaimiento en el humor, con incapacidad para
experimentar placer, y cambios físicos o en ciertas funciones psicológicas. Este cuadro se asocia además con un riesgo au- mentado de desarrollar aterosclerosis, enfermedad cardíaca, hipertensión, accidente cerebrovascular, declinación cogniti- va y demencia, además de desórdenes inmunológicos y me- tabólicos incluyendo diabetes tipo 2. Por otra parte, los DD son altamente recurrentes, comenzando muchas veces en la adolescencia (8).
La relación entre función intestinal y salud mental ha sido establecida y descripta. La depresión y la ansiedad con fre- cuencia son acompañadas por cambios en la motilidad coló- nica, la cual altera a su vez la composición y estabilidad de la microbiota intestinal, así como la fisiología del colon. Los desórdenes relacionados al estrés pueden alterar la barrera intestinal, produciendo un “intestino permeable” (leaky gut), que genera una respuesta inflamatoria donde interviene la
microbiota, a través de la translocación de ciertos productos bacterianos como el lipopolisacárido (LPS) (5).
Los pacientes con DD muestran cambios en la composi- ción y abundancia de su microbiota comparados con sujetos sanos. Firmicutes, Actinobacteria y Bacteroidetes son los fi- los más afectados, especialmente se observa un aumento de la relación B/F (Bacteroidetes/Firmicutes), caracterizado por aumento del género Bacteroides, y disminución de Blautia, Faecalibacterium y Coprococcus (9). Un estudio de Naseriba- froeu y col. en 2014, reportó aumento del orden Bacteroidales y disminución de la familia Lachnospiraceae en comparación con individuos normales. En otro estudio publicado en 2015, Jiang y col. detectaron mayores niveles de Bacteroidetes, Pro- teobacteria y Actinobacteria y al mismo tiempo, menor canti- dad de Firmicutes en pacientes con DD. A su vez, se observó una correlación negativa entre Faecalibacterium prausnitzii –importante productor de butirato–, y la severidad de los sín- tomas depresivos (5, 8).
Estudios en ratones bajo estrés crónico han mostrado re- ducciones en el género Bacteroides, y también mayores ni- veles del género Clostridium, que comúnmente se encuentra alterado como resultado de cambios modulados por metaboli- tos intestinales, como fenilalanina, triptófano y tirosina. Estas moléculas son parte del metabolismo de neurotransmisores claves como la serotonina, con implicancias en las funciones del SNC y SNE. Un estudio de Kelly y col. en 2016 demostró que ratas trasplantadas con heces obtenidas de pacientes con DD, desarrollaban signos de comportamiento y fisiológicos ca- racterísticos de esta entidad, indicando una asociación cau- sal. Más aún, en varios estudios, la administración de probió- ticos, antibióticos y bacterias patógenas, que influencian la composición de la microbiota, también mostraron cambios en los patrones de comportamiento. Es importante destacar que en 2004, Sudo y col. demostraron una relación directa entre microbiota y respuesta al estrés mediada por el eje hipotála- mo-hipófiso-adrenal, obteniendo mayores niveles de hormona adrenocorticotrópica (ACTH) y corticosterona en plasma de ra- tones libres de gérmenes (germ free) sometidos a estrés, con respecto a los controles normales. Esta respuesta al estrés se recuperaba normalmente después de la inyección de Bifido- bacterium infantis (5).
Es importante remarcar que los cambios en la composición de la microbiota intestinal se acompañan de alteraciones en el metaboloma, es decir los metabolitos que dichas bacterias producen, los cuales tienen implicancias en los DD. Algunas alteraciones observadas en estos pacientes son la depleción de la concentración de AGCC –especialmente butirato–, neu- rotransmisores y ácidos biliares secundarios. En relación
a éstos, un estudio inclusive halló una correlación negativa entre su concentración y la severidad de los DD, sugiriendo un papel protector de los ácidos biliares secundarios en esta enfermedad (9).
Alteraciones de la microbiota en el Trastor- no del Espectro Autista
El trastorno del espectro autista (TEA) incluye una familia de desórdenes del neurodesarrollo, que comprende alteraciones en el comportamiento, problemas en la comunicación y socia- bilización, anormalidades sensoriales, comportamientos res- tringidos y reiterativos, y en algunos casos, daño autoinfligido. Algunas comorbilidades son alimentación restrictiva, síntomas gastrointestinales y trastornos convulsivos. Se ha identificado TEA en 1 de cada 36 niños de 8 años (2.8 %), según el últi- mo análisis publicado en el Informe Semanal de Morbilidad y Mortalidad (MMWR) de los Centros para el Control y Prevención de Enfermedades (CDC). Las cifras de los nuevos hallazgos son más altas que en la estimación anterior, del 2018, que infor- mó una prevalencia de 1 de cada 44 niños (2.3 %). Los datos provienen de 11 comunidades de la Red de Vigilancia de Au- tismo y Discapacidades del Desarrollo (ADDM, por sus siglas en inglés) en USA. Esta condición es más prevalente en varones que en mujeres (4:1), y ha tenido un rápido aumento de su incidencia en los últimos años (10, 11, 12).
Recientes estudios sugieren que el TEA no es un trastorno primario cerebral, sino un desorden generalizado, con muchas anormalidades en las funciones metabólica e inmune. Cada vez existen más evidencias de que interacciones complejas entre factores genéticos, epigenéticos y ambientales contribu- yen a la patogénesis de este desorden. Los factores genéticos hallados hasta ahora, que incluyen mutaciones raras, polimor- fismos de nucleótidos simples en genes comunes, variantes en el número de copias genómicas, etcétera, pueden dar cuenta de sólo un tercio de los casos de autismo. Esto, sumado a la evidencia de la discordancia para esta condición en gemelos monocigóticos, sugieren un rol importante de factores epige- néticos y ambientales en el desarrollo del TEA (11).
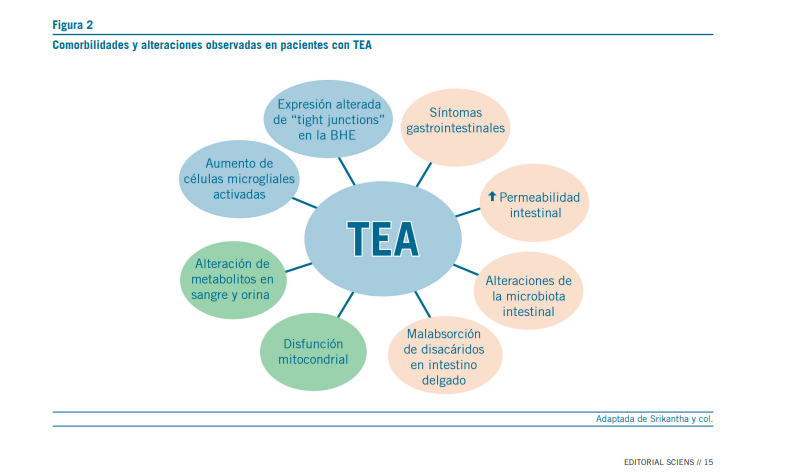
En la figura 2 se muestran las comorbilidades que han sido reportadas en pacientes con autismo. Una de las más frecuen- tes son los síntomas gastrointestinales, como dolor abdominal, diarrea o estreñimiento, y se ha observado que los pacientes con estos síntomas demuestran más problemas de ansiedad, menos interacción social y en algunos casos comportamientos agresivos y alteraciones del sueño, comparados con los que no presentan esta sintomatología. Un incremento de la per- meabilidad intestinal es observado en pacientes con autismo midiendo lactulosa en sangre después de la administración
oral, probablemente como resultado de una expresión dismi- nuida de proteínas de oclusión de las uniones estrechas (tight junctions) de la barrera intestinal. Como resultado, metaboli- tos bacterianos como el LPS, pueden atravesar esta barrera y generar inflamación afectando el cerebro a través de cambios en el nivel de citoquinas. Las alteraciones cerebrales observa- das en biopsias post mortem de pacientes con TEA tienen que ver con la expresión alterada de ciertas proteínas en la barrera hematoencefálica de la corteza y cerebelo, como las claudinas (CLDN). CLDN-5 es una proteína presente en las uniones es- trechas, importante para la adhesión de las células endotelia- les cerebrales. También se ha observado activación de las cé- lulas de la microglia, sugiriendo que en el TEA se produce una estimulación inmune en el cerebro. Otra alteración observada en niños autistas es la disfunción mitocondrial, ya que existe una menor actividad del ETC complex IV (complejo IV de la cadena transportadora de electrones) y de la citrato sintetasa en mucosa intestinal. Las disfunciones mitocondriales alteran el funcionamiento normal de los enterocitos y causan dismo- tilidad intestinal y mayor sensibilidad al estrés oxidativo. Al- gunos metabolitos bacterianos, como butirato, también son utilizados por la mitocondria para la producción de energía, y su alteración puede influenciar la función mitocondrial (10).
Entre los factores involucrados en la patogénesis del TEA se describen genes candidatos asociados a mayor riesgo de padecer esta condición, así como mecanismos epigenéticos,
incluyendo metilación del ADN, remodelación de la cromati- na por modificaciones de histonas (metilación, acetilación y fosforilación) o regulación post transcripcional por ARNs no codificantes como micro ARNs, que pueden impactar en la cantidad y calidad de productos génicos a diferentes nive- les. Por otra parte, se han hallado factores del entorno que contribuyen a la patogénesis del TEA, como la alteración del sistema inmune y la microbiota intestinal (13).
Las proteínas inmunes juegan un rol crucial en el desarro- llo cerebral. El complejo mayor de histocompatibilidad tipo I (MHC-I), clave en la inmunidad adaptativa, está enriquecido en las fracciones sinápticas y su deficiencia puede regular nega- tivamente dichas sinapsis durante la formación de conexiones corticales mediante vías de señalización que requieren MEF2, un gen candidato en TEA. Otros estudios tanto en humanos como en animales de experimentación han revelado que la activación inmune materna durante el primer o segundo tri- mestre podrían ser factores de riesgo para autismo (13). Con respecto al eje microbiota-intestino-cerebro, se postula que la alteración en la microbiota intestinal podría alterar la activi- dad cerebral a través de mecanismos endócrinos, metabólicos e inmunes, contribuyendo a la patogénesis del TEA. Los pri- meros colonizadores del intestino de recién nacidos sanos son enterobacterias, estafilococos y estreptococos, que son anae- robios facultativos. Estas bacterias consumen rápidamente el oxígeno creando un entorno anaeróbico, el cual pueden colo-
nizar anaerobios estrictos, como Bacteroides, Bifidobacterium y Clostridium. La composición de la microbiota se estabiliza entre los 2 y 3 años. Llamativamente el cerebro de los bebés crece hasta un 90 % del volumen adulto en los primeros 2 años de vida, de manera que la formación de las sinapsis cerebrales también alcanza su pico en este período de tiem- po. Así, la ventana crítica del establecimiento de una micro- biota saludable coincide con el mismo período de desarrollo del cerebro. Dado que éste es sensible a muchos cambios ambientales, se ha postulado que el estrés prenatal materno, infecciones o la dieta pueden jugar un rol en los desórdenes del neurodesarrollo (10).
Numerosos estudios demuestran alteraciones en la mi- crobiota intestinal de niños con autismo. Con frecuencia se observa una relación disminuida entre los filos Bacteroide- tes y Firmicutes. Algunas de las bacterias significativamen- te elevadas son la familia Enterobacteriaceae, y los géneros Clostridium, Dorea, Faecalibacterium, Roseburia y Desulfovi- brio, mientras que presentan concentración disminuida Bi- fidobacterium, Fusobacterium, Oscillospira, Enterococcus, Lactobacillus y Staphylococcus (10, 13). En un estudio se han asociado niveles incrementados de Clostridium spp con mayor severidad de TEA, utilizando el score Childhood Autism Rating (CAR), y se ha postulado que algunas toxinas como beta-2 podrían atravesar la barrera intestinal y afectar el ce- rebro, causando daños compatibles con los del autismo. En una revisión reciente se ha postulado el rol del glifosato, un pesticida ambiental, en la patogénesis del TEA, ya que pro- duciría un incremento de clostridios productores de toxinas. Más aún, C. perfringens y C. botulinum son muy resistentes al glifosato, a diferencia de bacterias beneficiosas como bi- fidobacterias o lactobacilos. Las cantidades de Desulfovibrio se han correlacionado con la severidad de los síntomas de comportamiento e interacción social, según un estudio de Tomova y col. Sutterella, que regula el metabolismo de la mucosa y la integridad del epitelio intestinal, presenta nive- les elevados en niños autistas, de acuerdo a Williams y col. En relación al incremento de enterobacterias, se ha obser- vado en niños con TEA y síntomas regresivos a los 2 años, que los niveles del filo Proteobacteria eran más altos que en los niños que no mostraron regresión (12). Finalmente, la levadura Candida albicans parece tener un papel en ni- ños autistas, encontrándose elevada en sus heces, actuando como oportunista en el entorno de disbiosis observado. Su proliferación puede producir amonio y toxinas, que podrían afectar el comportamiento (10, 12).
Los AGCC son los principales metabolitos producidos por bacterias fermentadoras de carbohidratos en el intestino. Los
más abundantes son: ácido acético (AA), ácido butírico (BA) y ácido propiónico (PPA). La cantidad total de AGCCs en niños autistas está disminuida, pero las concentraciones de AA y PPA están aumentadas, sugiriendo una importante disminu- ción en la producción de BA. Estos metabolitos afectan en for- ma directa el tracto digestivo del hospedador, a través de su acción sobre las células epiteliales colónicas y actuando como fuente de energía. Pueden actuar como supresores tumorales, en la apoptosis celular, como moduladores del sistema neu- roendocrino y en la regulación de procesos antiinflamatorios. Niveles aumentados de PPA han sido observados en heces de pacientes autistas. Dado que PPA es un metabolito producido principalmente por bacterias asociadas a TEA (Clostridium, Bacteroides, Desulfovibrio) y modula muchos procesos bioquí- micos, se ha propuesto que los AGCCs podrían estar ligados a autismo e inducir efectos en intestino, cerebro, funciones inmune y metabólica, y en el comportamiento. Además, los AGCCs pueden producir efectos epigenéticos en pacientes con TEA, por su acción moduladora de la expresión génica del inhi- bidor de la histona deacetilasa, de la tiroxina hidroxilasa (invo- lucrada en la síntesis de catecolaminas), y de CREB, un factor clave en el neurodesarrollo, el aprendizaje y la memoria (11).
Uso de probióticos en el manejo de desór- denes mentales
Según la Organización Mundial de la Salud, los probióticos son microorganismos vivos que, administrados en cantida- des adecuadas, confieren un beneficio en la salud. Dado que como analizamos, las patologías psiquiátricas y los trastornos del neurodesarrollo cursan con disbiosis intestinal, la admi- nistración de estos suplementos alimentarios podría ser una estrategia terapéutica útil. En la actualidad, existen nume- rosas publicaciones científicas que apoyan su uso en enfer- medades crónicas, ya que además de ser seguros y tolerarse bien, protegen la barrera intestinal a través de la producción de mucina y fortaleciendo las uniones estrechas, aumentan la producción de enzimas digestivas y antioxidantes, y modulan la respuesta inmune (12).
Si bien los resultados de intervenciones con probióticos en pacientes con DD y TEA son promisorios, por el momento existe una falta de ensayos clínicos controlados y con mayor número de individuos. Entre los retos futuros, se necesitan protocolos estandarizados en cuanto al tipo de cepas probió- ticas, la dosis administrada y la duración de los tratamientos, con el fin de aumentar la reproducibilidad de los resultados y permitir la obtención de conclusiones definitivas sobre la aplicación de los probióticos en tales patologías (7).
Conclusiones
El eje microbiota-intestino-cerebro es un ejemplo claro del papel de la microbiota en la salud, que permite explicar la implicancia de la misma en la conducta, las emociones y el control del estrés. Esta comunicación bidireccional resulta de la interacción entre los microorganismos intestinales y los sis- temas homeostáticos (nervioso, endócrino e inmune). Los me- diadores generados por la microbiota intestinal (AGCC, hor- monas, neurotransmisores y citoquinas) no sólo intervienen en la homeostasis local, sino que alcanzan a otros órganos, en especial al sistema nervioso central, incidiendo en su desarro- llo, metabolismo y funcionamiento.
Existen evidencias de una asociación entre la alteración en la composición y/o funciones de la microbiota intestinal con el desarrollo y progresión de enfermedades psiquiátricas como ansiedad y depresión, así como en condiciones del neurodesa- rrollo como el autismo.
El gran desafío actual es comprender acabadamente las vías de señalización involucradas, y de qué manera éstas son afectadas por los cambios en la microbiota intestinal, para dirigir investigaciones que apunten a la utilización de probió- ticos específicos que brinden beneficios en la salud de pa- cientes con desórdenes mentales. Esto contribuirá a optimizar una atención personalizada, integral, efectiva y segura para dichos pacientes.
Referencias bibliográficas
- 1. Berg G, Rybakova D, Fisher D, Cernava T, Champonier Verges M, Charles T et al. Mi- crobiome definition revisited: old concepts and new challenges. Microbiome 2020, 8:103.
- 2. Allaband C, Mc Donald D, Vázquez-Bae- za Y, Minich J, Tripathi A, Brenner D et al. Studying, analyzing and interpreting gut mi- crobiome data for clinicians. Clin Gastroen- terol Hepatol 2019, 17(2): 218-230.
- 3. Ley R, Peterson D and Gordon J. Eco- logical and evolutionary forces shaping mi- crobial diversity in the human intestine. Cell 2006, 124: 837-854.
- 4. Rutayisire E, Huang K, Liu Y and Tao
F. The mode of delivery affects the diversity and colonization pattern of the gut micro- biota during the first year of infants´ life: a systematic review. BMC Gastroenterol 2016, 16:86.
- 5. Lach G, Schellekens H, Dinan T and Cryan J. Anxiety, depression and the micro- biome: A role for Gut peptides. Neurothera- peutics 2018, 15: 36-59. DOI: 10.1007/ s13311-017-0585-0.
- 6. Oren A., G.M. Garrity. Valid publication of the names of forty-two phyla of prokaryo- tes. Int. J. Syst. Evol. Microbiol. 2021, 71: 005056. DOI 10.1099/ ijsem.0.005056.
- 7. Documento de consenso sobre la micro- biota y el uso de Probióticos/Prebióticos en patologías neurológicas y psiquiátricas. So- ciedad Española de Microbiota, Probióticos y Prebióticos (2021).
- 8. Zalar et al. The role of microbiota in depression- a Brief review. Psychiatria Danu- bina 2018; Vol 30, nro 2: 136-141. DOI: 10.24869/psyd.2018.136.
- 9. Liu L, Huang H, Chen X, Zhang Y, Zhang H and Xie P. Gut microbiota and its metabolites in depression: from pathogene- sis to treatment. eBioMedicine 2023;90: 104527.
- 10. Srikantha and Mohajeri. The pos- sible role of the microbiota-gut-brain axis in Autism Spectrum Disorder. Int J Mo- lec Sci 2019; 20, 2115; doi: 10.3390/
ijms20092115.
- 11. Derrick MacFabe. Enteric short-chain fatty acids: microbial messengers of metabo- lism, mithocondria and mind: implications in Autism Spectrum Disorders. Microbial
Ecology in Health and disease 2015; 26: 28177. http: //dx.doi.org/10.3402/mehd. v26.28177.
- 12. Abdellatif B, Mc Veigh C, Bendriss G and Chaari A. The promising role of Probio- tics in managing the altered gut in Autism Spectrum Disorder. Int. J. Mol. Sci. 2020, 21, 4159.
- 13. Yu Li, Yiming and Bai-Lin. Genetic architecture, epigenetics influence and en- vironment exposure in the pathogenesis of Autism. Sci China Life Sci 2015; 58: 958-
967, doi: 10.1007/s11427-015-4941-1.







No comments! Be the first commenter?