Resumen
Introducción: El síndrome de fatiga crónica/encefalomielitis miálgica (EM/SFC) es una entidad compleja y multisistémica que afecta significativamente la funcionalidad de los pacientes. Su prevalencia ha aumentado en el contexto post-COVID-19, desafiando el abordaje tradicional del dolor crónico.
Objetivo: Describir la fisiopatología, sintomatología, diagnós- tico y abordaje clínico del EM/SFC con enfoque integral, inter- disciplinario y basado en evidencia.
Metodología: Revisión narrativa actualizada y análisis de la experiencia clínica en el tratamiento de pacientes con EM/SFC. Resultados: Se identifican avances en biomarcadores, neuro- inflamación, disfunción mitocondrial y desregulación inmunológica. Se presentan herramientas clínicas como el pacing, esca- las funcionales, opciones farmacológicas (aripiprazol, naltrexona baja dosis) y el rol central del acompañamiento psicoterapéutico. Conclusiones: El EM/SFC requiere un abordaje integral, sen- sible y personalizado, con fuerte énfasis en la empatía clínica, la validación del padecimiento y la co-construcción del trata-
miento con el paciente.
Palabras clave
Síndrome de fatiga crónica – Encefalomielitis miálgica – Dolor per- sistente – Post-COVID – Neuroinflamación – Pacing – Aripiprazol.
Introducción
En los últimos años, las enfermedades complejas como la fibromialgia han representado un reto clínico significativo. Sin embargo, el síndrome de fatiga crónica o encefalomielitis miálgica (SFC/EM), especialmente en su forma postviral, ha emergido como un desafío aún mayor para los profesionales de la salud. Pacientes y clínicos coinciden en que la fatiga persistente resulta, en muchos casos, más discapacitante que el dolor crónico, afectando severamente la funcionalidad y la calidad de vida.
El incremento en la prevalencia de casos tras la pandemia de COVID-19, sumado a la dificultad diagnóstica y la ausencia de marcadores biológicos específicos, ha generado una mayor demanda de abordajes clínicos integrales. Muchos pacientes llegan a la consulta tras recorrer múltiples especialidades sin obtener respuestas claras, lo que enfatiza la necesidad de un enfoque médico actualizado y multidisciplinario.
Este artículo tiene como objetivo revisar la fisiopatología, clínica y estrategias terapéuticas disponibles para el mane- jo del SFC/EM, incluyendo tanto las guías clínicas vigentes como opciones terapéuticas off-label con respaldo científico.
Borenstein J. “Síndrome de fatiga crónica/encefalomielitis miálgica. Implicancias clínicas y abordaje integral del dolor persistente”. Analgesia y manejo del Dolor 2025;2:14-22. Puede consultar otros artículos publicados por los autores en la revista Analgesia y manejo del Dolor en sciens.com.ar
Asimismo, se resalta la importancia de la psicoeducación y la comunicación clara para evitar interpretaciones erróneas y fomentar un pronóstico funcional.
La historia clínica de pacientes con SFC/EM puede ser heterogénea y de evolución variable, lo que subraya la necesidad de un abordaje biopsicosocial e interdisciplinario que incluya medicina interna, neurología, psiquiatría, fisioterapia, nutrición y psicoterapia. La integración de estas áreas es clave para mejorar los resultados terapéuticos en esta patología compleja y aún poco comprendida.
Definición, epidemiología y factores de riesgo
La encefalomielitis miálgica/síndrome de fatiga crónica (EM/ SFC) es una enfermedad neuroinmunológica, a menudo des- encadenada por una infección viral (1). La Organización Mundial de la Salud la reconoce como patología neurológica desde 1969, clasificada en la CIE-11 bajo el código 8E49 (5, 8).
Aunque su etiología exacta permanece incierta, la evidencia indica disfunción multisistémica, incluyendo alteraciones en los sistemas neurológico, inmunológico, endocrinológico, cardiovascular y metabólico (1, 2).
Afecta a personas de todas las edades, géneros y contextos socioculturales, con una mayor prevalencia en mujeres. La in- cidencia global previa a la pandemia de COVID-19 se estima-
ba entre el 0,3% y 0,5% (2). Estudios epidemiológicos des- criben una distribución bimodal en la aparición de síntomas: entre los 10 a 19 años y los 30 a 39 años. En algunos casos, los síntomas se inician en la infancia, remiten y reaparecen en la adultez (3).
Los factores de riesgo más comúnmente asociados inclu- yen sexo femenino, infecciones virales previas y antecedentes personales o familiares de enfermedades autoinmunes, neuro- lógicas o trastornos multisistémicos crónicos complejos (1,3). El interés por la EM/SFC ha resurgido con fuerza debido a su estrecha relación clínica con el síndrome post-COVID (tam- bién denominado COVID prolongado o secuelas post-agudas de COVID-19). Diversos estudios sugieren que hasta el 50% de los pacientes con síndrome post-COVID cumplen criterios
diagnósticos de EM/SFC (4).
Cabe destacar que los pacientes con EM/SFC presentan, en promedio, una calidad de vida inferior a la observada en enfermedades crónicas graves como la esclerosis múltiple, la insuficiencia renal crónica o la insuficiencia cardíaca conges- tiva (1, 3, 7).
Fisiopatogenia
Hasta el 80 % de los casos de encefalomielitis miálgica/sín- drome de fatiga crónica (EM/SFC) presentan antecedentes de una infección viral como desencadenante inicial (1). Se han documentado brotes epidémicos de EM/SFC tras infecciones
por virus de Epstein-Barr, citomegalovirus, enterovirus, coro- navirus (incluido el SARS-CoV-2) y otros herpesvirus humanos (HHV-6, HHV-7) (1, 5, 6).
En la práctica clínica, es frecuente hallar serología IgG po- sitiva para el virus de Epstein-Barr, aunque este hallazgo no se considera actualmente como criterio diagnóstico formal. Esta exclusión ha sido objeto de debate entre investigadores, quienes proponen reconsiderar su incorporación en las futuras guías diagnósticas (6).
El inicio clínico puede responder a un modelo multifacto- rial, en el que múltiples eventos estresores –como infecciones previas menores, cirugía, traumatismos o alteraciones inmu- nológicas– actúan como precipitantes antes de un desenca- denante final que marca el inicio de la sintomatología mani- fiesta, similar al patrón observado en la fibromialgia (1, 10).
A nivel inmunológico, se han identificado disfunciones es- pecíficas:
Sobreexpresión de linfocitos T reguladores, lo cual suprime la respuesta inmunitaria.
Disfunción de células NK (natural killer), que muestran una capacidad reducida para controlar infecciones virales, lo cual puede afectar negativamente la función mitocondrial (1, 6, 21). Estas alteraciones inmunológicas, junto con la disfunción mitocondrial y la neuroinflamación central, se consideran me- canismos clave en la fisiopatología de la fatiga persistente
observada en EM/SFC (1, 21, 22).
Sintomatología
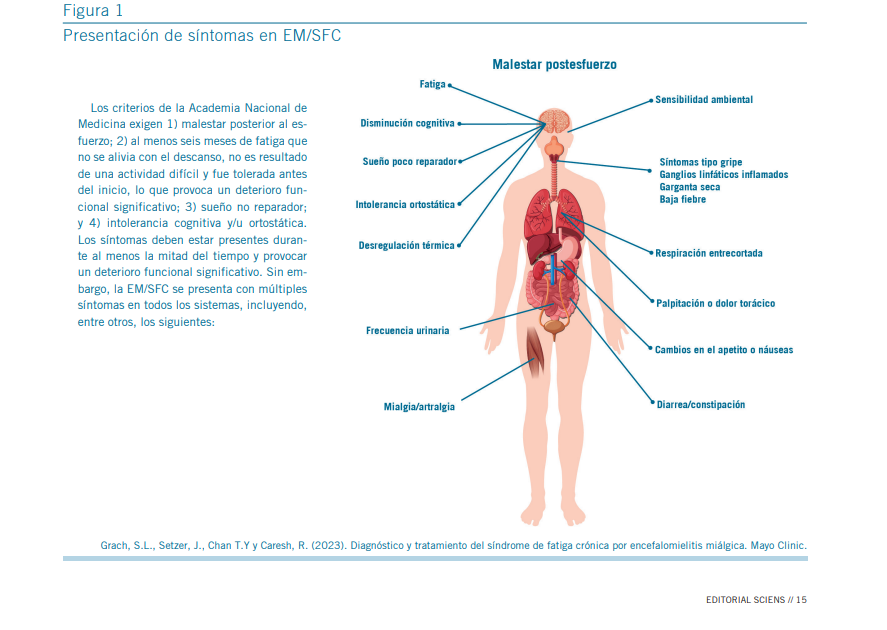
La presentación clínica del síndrome de fatiga crónica/en- cefalomielitis miálgica (EM/SFC) puede dividirse en dos gru- pos: síntomas generales y el síntoma cardinal conocido como malestar post-esfuerzo (PEM, por sus siglas en inglés).
Sintomatología general
Incluye fatiga persistente, disfunción cognitiva, sueño no reparador, intolerancia ortostática, disautonomía (incluyendo termorregulación alterada y aumento de la frecuencia urina- ria), mialgias, artralgias, hiperreactividad sensorial, linfade- nopatías dolorosas, febrícula, disnea, palpitaciones o dolor torácico, así como síntomas gastrointestinales como náuseas, diarrea o constipación (1, 5).
Malestar post-esfuerzo (PEM)
El PEM se considera un síntoma patognomónico de EM/SFC. Consiste en una exacerbación de los síntomas habituales –o aparición de nuevos síntomas– tras una actividad física, cognitiva o sensorial. Esta respuesta suele presentarse con un retraso característico de entre 12 y 48 horas y puede durar días, semanas o incluso meses hasta la recuperación funcional (1, 5, 8).
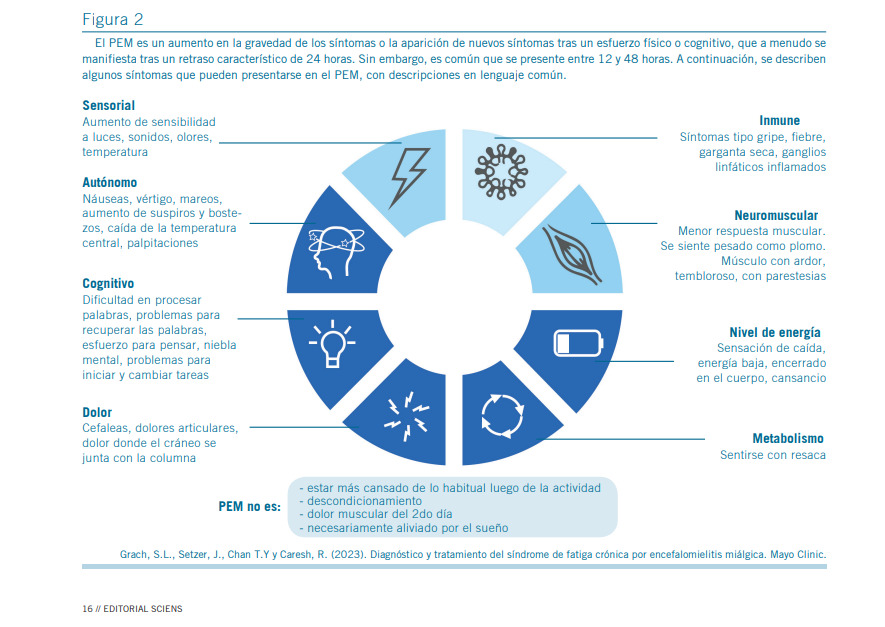
Naturaleza de la fatiga
La guía NICE (8) describe la fatiga asociada a EM/SFC como una combinación de:
- Sensación similar a una gripe persistente, sobre todo al inicio del cuadro.
- Estado de “hiperactivación” o inquietud coexistente con agotamiento físico.
- Incapacidad física para iniciar o completar actividades cotidianas.
- Fatiga cognitiva que agrava las dificultades neurocogniti- vas existentes.
- Rápida pérdida de fuerza o resistencia tras iniciar una actividad, con debilidad súbita, torpeza motora o incapacidad de repetir esfuerzos.
Evaluación clínica
Una herramienta útil para la valoración del impacto de la fatiga es la Fatigue Severity Scale (FSS). Este cuestionario au- toaplicado consta de nueve ítems que evalúan la interferencia de la fatiga durante la última semana. Cada ítem se puntúa del 1 al 7, siendo ≥36 puntos indicativo de fatiga severa que justifica evaluación médica (9).
Clasificación diagnóstica y criterios in- ternacionales
La guía NICE (8) propone una clasificación funcional del síndrome de fatiga crónica/encefalomielitis miálgica (EM/ SFC) en cuatro grados de severidad, basados en el impacto de los síntomas sobre la autonomía, la actividad física, la cogni- ción y la funcionalidad general:
EM/SFC leve
Las personas con EM/SFC leve conservan capacidad para el autocuidado y algunas tareas domésticas básicas, aunque pueden requerir asistencia ocasional. La mayoría continúa con actividad laboral o académica, pero a menudo a costa de reducir significativamente su participación en actividades sociales o de ocio. Suelen necesitar días de descanso adi- cionales y emplear los fines de semana para recuperarse del esfuerzo semanal. Se estima que esta categoría representa aproximadamente el 25 % de los casos.
EM/SFC moderado
Los pacientes presentan una reducción significativa de la movilidad y de la capacidad para realizar actividades de la vida diaria. Generalmente han cesado sus actividades labo- rales o educativas y requieren períodos diarios de descanso prolongado, incluyendo siestas vespertinas. El sueño nocturno suele estar alterado en calidad y cantidad. Esta forma repre- senta cerca del 50 % de los casos diagnosticados.
EM/SFC grave
En esta categoría, los pacientes presentan dependencia parcial o total para las actividades cotidianas. Suelen tener alteraciones cognitivas severas y movilidad muy limitada, a
menudo requiriendo el uso de silla de ruedas. Pueden estar confinados al hogar y sufrir consecuencias sintomáticas im- portantes tras cualquier actividad fuera de su rutina habitual.
EM/SFC muy grave
Los pacientes permanecen en cama durante todo el día y dependen completamente del cuidado de terceros. Pueden requerir asistencia para la alimentación y la higiene, y pre- sentan extrema hipersensibilidad a estímulos sensoriales. En algunos casos, existe necesidad de soporte nutricional por sonda debido a la imposibilidad para tragar.
Criterios diagnósticos internacionales
Uno de los principales desafíos en el diagnóstico del sín- drome de fatiga crónica/encefalomielitis miálgica (EM/SFC) es la falta de consenso internacional en cuanto a los criterios clínicos. Diversas guías proponen definiciones diagnósticas distintas, lo que contribuye a la heterogeneidad en la práctica clínica.
Entre los principales marcos diagnósticos utilizados se en- cuentran:
- Criterios de Fukuda (1994): ampliamente utilizados, aun- que limitados por su antigüedad y falta de especificidad.
- Criterios Canadienses (2003): más detallados, incluyen síntomas neuroinmunológicos y disautonómicos.
- Criterios del Instituto de Medicina de los Estados Unidos (IOM, 2015): recomendados por los Centros para el Control y Prevención de Enfermedades (CDC), por su enfoque en criterios positivos y centrados en el impacto funcional (1, 2, 5, 10).
El diagnóstico actual de EM/SFC se basa en la identifi- cación de síntomas positivos persistentes (como la fatiga post-esfuerzo, disfunción cognitiva y sueño no reparador), y no debe considerarse únicamente como un diagnóstico de ex- clusión, al igual que ocurre con la fibromialgia (1).
Estudios estiman que hasta el 90 % de los casos permane- cen sin diagnosticar, y que cerca del 29 % de los pacientes reciben un diagnóstico preciso tras una latencia mayor a cinco años (2). Este retraso supera incluso al observado en la fibro- mialgia (promedio de dos años) y se atribuye a:
- Ausencia de biomarcadores específicos.
- Presentaciones clínicas variadas que pueden simular otras patologías.
- Conocimiento limitado por parte de profesionales de la salud (1, 2, 10).
El proceso diagnóstico también implica una dimensión co- municacional relevante. La forma, el momento y el conteni- do de la información brindada al paciente deben adecuarse al contexto clínico, emocional y personal. En algunos casos, puede ser útil utilizar explicaciones funcionales como “disfun- ción mitocondrial” o “neuroinflamación del sistema nervioso central”, conceptos que ayudan a comprender los síntomas sin etiquetar de forma rígida. En otros pacientes, un diagnós- tico claro puede aportar validación y alivio frente a temores de enfermedades graves como tumores o esclerosis múltiple. Se destaca la importancia de que este proceso sea realiza- do por equipos de salud capacitados en el abordaje integral del EM/SFC, considerando tanto los aspectos fisiopatológicos
como psicoeducativos y comunicacionales.
Examen físico, estudios clínicos y diag- nósticos diferenciales
Examen físico
No se han identificado hallazgos físicos patognomónicos del síndrome de fatiga crónica/encefalomielitis miálgica (EM/ SFC). No obstante, se pueden detectar ciertos signos clínicos sugerentes que apoyan el diagnóstico (1, 5):
- Ganglios linfáticos dolorosos y puntos gatillo musculares similares a los observados en fibromialgia.
- Dolor abdominal inespecífico, sin signos de irritación peri- toneal, especialmente en casos con comorbilidad con síndro- me de intestino irritable (SII).
- Hipermovilidad articular, con posible dolor en articulacio- nes facetarias cervicales (especialmente a nivel occipital). En presencia de sinovitis activa debe considerarse un diagnóstico reumatológico alternativo o coexistente.
- Alteraciones cognitivas leves (dificultad para encontrar palabras, lapsos de memoria, enlentecimiento de respuestas) pueden observarse durante la entrevista clínica.
- Prueba de inclinación de la NASA (NASA Lean Test) puede revelar intolerancia ortostática con o sin hipotensión. Esta pue- de realizarse en consultorio como herramienta complementaria.
Es importante notar que muchos pacientes se presentan en consulta en fases de mejoría funcional, por lo que el examen físico puede ser relativamente normal al momento de la eva- luación (1).
Estudios clínicos
No existe una prueba de laboratorio específica para diag- nosticar EM/SFC. Sin embargo, se recomienda un enfoque personalizado, orientado por un médico internista o reumató- logo, según hallazgos clínicos y síntomas predominantes (10).
En general, los estudios iniciales sugeridos incluyen:
- Hemograma completo con fórmula leucocitaria.
- Perfil metabólico: glucemia, electrolitos, función hepática y renal.
- Ferritina, vitamina D, vitamina B12 y folato.
- Pruebas tiroideas: TSH, T4 libre.
- Velocidad de sedimentación globular (VSG) y proteína C reactiva (PCR).
- Cortisol y sulfato de dehidroepiandrosterona (DHEA-S).
- Fósforo.
- Anticuerpos antinucleares (ANA) y factor reumatoide (FR).
- Prueba de transglutaminasa tisular (para descartar enfer- medad celíaca).
- Análisis de orina completo.
- Oximetría nocturna (para descartar trastornos respiratorios del sueño).
La solicitud de estudios adicionales y derivaciones a otras especialidades debe realizarse en función del cuadro clínico individual y de manera progresiva, priorizando la carga que supone para el paciente.
Diagnósticos diferenciales
Se estima que entre el 75 % y 80 % de los pacientes con síndrome de fatiga crónica/encefalomielitis miálgica (EM/ SFC) presentan al menos una comorbilidad clínica relevante (11, 12). Las enfermedades crónicas complejas más común- mente asociadas incluyen:
- Síndrome de Ehlers-Danlos tipo hipermóvil (hEDS).
- Trastornos autonómicos, como el síndrome de taquicardia ortostática postural (POTS).
- Síndrome de activación mastocitaria (MCAS) (11–13).
En los casos graves de EM/SFC, la carga comórbida suele ser mayor, lo que puede complicar aún más el diagnóstico y el manejo clínico.
Si bien muchos síntomas observados en EM/SFC son carac- terísticos, no son exclusivos de la enfermedad. Por tanto, es fundamental realizar una evaluación diagnóstica diferencial exhaustiva que considere otras condiciones médicas con sin- tomatología superpuesta. Los síntomas que requieren especial atención incluyen:
- Intolerancia ortostática y disautonomía: se manifiestan por mareos, palpitaciones, síncope, náuseas al pasar de la posición decúbito a sentado o de pie.
- Hipersensibilidad térmica: sudoración profusa, escalo- fríos, sofocos o sensación persistente de frío.
- Síntomas neuromusculares: espasmos, fasciculaciones o movimientos mioclónicos.
- Síntomas pseudogripales: dolor de garganta, linfadenopa- tías sensibles, escalofríos, náuseas y mialgias difusas.
- Intolerancia alimentaria, al alcohol o a productos químicos.
- Hipersensibilidad sensorial generalizada: sensibilidad exagerada a luz, sonido, tacto, sabores u olores.
Dolor persistente: mialgias, cefaleas, dolor ocular, abdomi- nal o articular sin signos inflamatorios clásicos (enrojecimien- to, edema, derrame).
El abordaje diagnóstico requiere descartar patologías infec- ciosas, autoinmunes, neurológicas o endocrinas que puedan explicar el cuadro. Asimismo, es fundamental diferenciar EM/ SFC de condiciones como fibromialgia, depresión mayor, hi- potiroidismo, trastornos del sueño o enfermedades neuromus- culares, entre otras.
Salud mental
El impacto del síndrome de fatiga crónica/encefalomielitis miálgica (EM/SFC) sobre la salud mental es significativo, tan- to por la cronicidad y severidad de los síntomas como por las limitaciones funcionales que impone. Es común observar comorbilidad con trastornos del ánimo y de ansiedad, muchas veces como consecuencia del deterioro en la calidad de vida, la incertidumbre diagnóstica y la falta de tratamientos efectivos.
Un estudio piloto reciente realizado en Suiza exploró la carga psicosocial y los mecanismos de afrontamiento en personas con EM/SFC (14). El trabajo incluyó a 169 pacientes mediante una encuesta autoadministrada y reveló hallazgos relevantes:
- El 90,5 % reportó una falta de comprensión social sobre su enfermedad, lo que llevó a muchos a evitar hablar sobre su
diagnóstico por temor a la incredulidad o trivialización.
- El 68,5 % manifestó sentirse estigmatizado.
- El 88,2 % afirmó que la enfermedad tuvo un impacto nega- tivo en su salud mental; los síntomas más frecuentes fueron tris- teza (71 %), desesperanza (66,9 %) y pensamientos suicidas (39,3 %). La depresión secundaria fue reportada en el 14,8 %. Los hombres mostraron una prevalencia especialmente ele-
vada de ideación suicida.
Los factores más comúnmente asociados a pensamientos suicidas fueron:
- Ser desestimados con el argumento de que la enfermedad es “solo psicosomática” (89,5 %).
- Sentirse al límite físico y emocional (80,7 %).
- No sentirse comprendidos (80,7 %).
Estos hallazgos coinciden con estudios previos que relacio- nan el estigma médico, la pérdida de vínculos laborales y socia- les, la incertidumbre diagnóstica y el aislamiento como factores de riesgo psicosocial elevados en esta población (15–18). En contextos como el suizo, algunos pacientes incluso optaron por registrarse en asociaciones para suicidio asistido, lo que resalta la gravedad del impacto emocional en casos severos.
Frente a este panorama, la atención de la salud mental re- sulta fundamental. Un abordaje integral debe incluir interven- ciones farmacológicas, psicoterapéuticas y de rehabilitación cognitiva y emocional, adaptadas al nivel funcional del pa- ciente. Asimismo, la validación clínica, la psicoeducación y la comunicación empática son herramientas clave para reducir el sufrimiento subjetivo y mejorar el pronóstico global.
Abordaje general del tratamiento
El tratamiento del síndrome de fatiga crónica/encefalomieli- tis miálgica (EM/SFC) se basa en estrategias de manejo sinto- mático, educación del paciente y abordaje interdisciplinario. No existe una terapia curativa actualmente aprobada, por lo que la intervención debe centrarse en mejorar la calidad de vida y reducir las exacerbaciones.
Una de las herramientas fundamentales es la estrategia de “pacing” o gestión energética contingente a síntomas. Esta técnica promueve que los pacientes realicen actividades físi- cas o cognitivas solo dentro de los límites tolerados por su or- ganismo, planificando períodos de descanso antes y después de esfuerzos, para evitar la aparición o empeoramiento del malestar post-esfuerzo (PEM) (1).
El pacing no busca una progresión gradual de la actividad como en los programas de ejercicio tradicionales, sino que se centra en la autorregulación de los niveles de esfuerzo. Se ha demostrado que su aplicación consistente puede reducir la frecuencia e intensidad de las crisis, y favorecer la estabilidad funcional a largo plazo.
Para su implementación, se recomienda:
- Uso de diarios de actividad y registro de síntomas para iden- tificar patrones y anticipar momentos de mayor vulnerabilidad.
- Monitoreo del tiempo en posición vertical (incluyendo es- tar sentado con los pies en el suelo), dado que es un indicador indirecto de tolerancia ortostática.
- Tecnología portátil (como relojes inteligentes o apps) que permita evaluar gasto energético y regular el ritmo de vida del paciente.
- El pacing es particularmente efectivo cuando se combina con intervenciones psicoeducativas, apoyo psicológico y coor- dinación médica continua.
Manejo orientado a síntomas
El tratamiento del EM/SFC requiere un enfoque sintomá- tico personalizado, con intervenciones farmacológicas y no farmacológicas ajustadas a cada paciente. A continuación, se detallan las estrategias recomendadas para los principales síntomas asociados:
Malestar post-esfuerzo (PEM): se recomienda la implemen- tación de la estrategia de pacing, reducción de estímulos sen- soriales, uso de dispositivos de seguimiento (smartwatches, apps) o diarios de síntomas.
Fatiga: se ha propuesto el uso de naltrexona en dosis bajas, aripiprazol a bajas dosis, suplementos vitamínicos en caso de deficiencias, dieta antiinflamatoria, y estimulación progresiva dentro de los límites funcionales.
Trastornos del sueño: tratamiento con melatonina, trazo- dona, antidepresivos tricíclicos, pregabalina o gabapentina, según perfil del paciente.
Disfunción cognitiva (“niebla mental”): uso de ayudas ex- ternas (diarios, alarmas), intervención de terapia ocupacional, y en algunos casos aripiprazol o naltrexona en bajas dosis. El uso de estimulantes debe evaluarse cuidadosamente.
Intolerancia ortostática: manejo con hidratación adecuada, electrolitos, prendas de compresión, y en casos moderados a severos medicación específica como fludrocortisona, mido- drina, propranolol, piridostigmina o guanfacina, guiado por el subtipo de disautonomía.
Mareos frecuentes: considerar el diagnóstico de mareo pos- tural-perceptivo persistente. Puede tratarse con terapia vesti- bular y, en ciertos casos, inhibidores selectivos de recaptación de serotonina (ISRS) o duales (ISRSN) a dosis bajas.
Dolor musculoesquelético o articular: tratamiento con du- loxetina, pregabalina, gabapentina, antidepresivos tricíclicos o naltrexona en dosis bajas.
Neuropatía: se pueden utilizar pregabalina, gabapentina, antidepresivos tricíclicos y dispositivos de soporte (corsés o medias de compresión).
Hipersensibilidad sensorial: se recomienda el uso de au- riculares con cancelación de ruido, gafas con filtro tintado, evitación de multitudes, y tratamiento con aripiprazol en dosis bajas en casos indicados.
Síntomas gastrointestinales: se sugiere una dieta antiinfla- matoria, ingesta fraccionada, probióticos y simbióticos, anti- diarreicos o antihistamínicos según síntomas, y fibra o agen- tes procinéticos para el estreñimiento.
Tratamientos farmacológicos y suple- mentarios en EM/SFC
Aripiprazol en EM/SFC
El uso fuera de indicación del aripiprazol ha demostrado
resultados prometedores en el tratamiento del EM/SFC. Un estudio retrospectivo realizado en el Centro de EM/SFC de la Universidad de Stanford evaluó a 101 pacientes tratados con dosis bajas de aripiprazol (hasta 2 mg/día) (20). Los re- sultados mostraron que el 74 % de los pacientes experimentó mejoría en al menos una de las siguientes categorías: fatiga, disfunción cognitiva (“niebla mental”), sueño no reparador y frecuencia de episodios de malestar post-esfuerzo (PEM). Solo el 14 % interrumpió el tratamiento por efectos adversos o empeoramiento de los síntomas.
Los efectos beneficiosos del aripiprazol podrían estar rela- cionados con su acción como agonista parcial dopaminérgico y modulador de la neuroinflamación, incluyendo inhibición de la microglía y reducción de la apoptosis neuronal. Estos me- canismos se alinean con hipótesis actuales sobre la fisiopato- genia neuroinflamatoria del EM/SFC.
Naltrexona en dosis bajas
La naltrexona en dosis bajas (4–6 mg/día) ha sido estudiada principalmente en fibromialgia, con resultados variables. Al- gunos ensayos sugieren mejoría en síntomas cognitivos, pero no ha demostrado superioridad frente a placebo en el con- trol del dolor (25–27). Aunque su uso es objeto de creciente interés, aún no se recomienda su indicación sistemática en EM/SFC hasta que existan más datos robustos. La experiencia clínica sobre su eficacia aún es limitada.
Suplementación y disfunción mitocondrial
Muchos pacientes con EM/SFC presentan intolerancia a fár- macos o prefieren enfoques complementarios, lo que ha in- centivado el uso de suplementos. La literatura sugiere que la disfunción mitocondrial es un mecanismo común en EM/ SFC, fibromialgia y COVID prolongado (28–30). Alteraciones en la producción de ATP, aumento del estrés oxidativo, y daño mitocondrial han sido documentados en diversos tejidos, in- cluyendo músculo esquelético, cerebro e intestino.
Entre los suplementos más utilizados se destacan:
- Coenzima Q10 (CoQ10): Suplementación con dosis altas (300–500 mg/día) ha demostrado en estudios piloto mejorar la producción de energía mitocondrial, reducir la fatiga y el dolor, así como mejorar marcadores de inflamación y ansiedad
(30). No se han reportado efectos adversos significativos.
- Vitaminas del grupo B (B1, B6, B12): contribuyen al meta- bolismo energético celular.
- Omega-3 (EPA/DHA) con certificación IFOS: con propiedades antiinflamatorias y efectos neuroprotectores.
- Lactoferrina, quercetina, curcumina: por su acción antioxi- dante e inmunomoduladora.
El abordaje integrador de estos tratamientos debe ser indi- vidualizado, respetando la tolerancia del paciente y su evolu- ción sintomática.
Abordaje psicoterapéutico
La psicoterapia ocupa un rol fundamental en el tratamiento de pacientes con síndrome de fatiga crónica/encefalomieli- tis miálgica (EM/SFC). Más allá de sus beneficios en salud
mental, cumple una función clave en el acompañamiento del paciente en el proceso de gestión del pacing, facilitando la adaptación a las limitaciones funcionales y el desarrollo de estrategias de afrontamiento.
Entre las modalidades disponibles, la Terapia Cogniti- vo-Conductual (TCC) ha sido ampliamente estudiada. Si bien no se propone como una cura para la enfermedad, la TCC ha demostrado ser eficaz para mejorar el funcionamiento gene- ral, disminuir la angustia emocional y optimizar el manejo de síntomas crónicos (8).
La guía NICE (2021) aclara que la TCC no debe presentar- se como un tratamiento curativo, sino como una herramienta psicoterapéutica que ayuda a los pacientes a:
Comprender mejor su enfermedad.
Identificar y modificar pensamientos disfuncionales relacio- nados con los síntomas.
Desarrollar habilidades para manejar el estrés y la frustra- ción derivados de la limitación física.
Fomentar una comunicación más efectiva con su entorno familiar, laboral y clínico.
El abordaje psicoterapéutico debe adaptarse al nivel fun- cional del paciente, priorizando siempre la validación del su- frimiento y la individualización del tratamiento. Idealmente, debe integrarse en un equipo interdisciplinario que aborde tanto los aspectos físicos como emocionales del EM/SFC.
Actividad física en EM/SFC: recomen- daciones y consideraciones clínicas
La incorporación de actividad física en personas con sín- drome de fatiga crónica/encefalomielitis miálgica (EM/SFC) es un tema que genera controversias, dada la heterogeneidad clínica de los pacientes y la posibilidad de exacerbación de síntomas como el malestar post-esfuerzo (PEM).
Según la Guía NICE (2021), no se debe recomendar el ejercicio físico como una intervención generalizada ni como tratamiento curativo para EM/SFC (8). La indicación debe ser personalizada, cuidadosamente supervisada y opcional, de- pendiendo del estado clínico del paciente y su disposición a intentar una progresión funcional.
Recomendaciones clave:
No aconsejar actividades físicas no supervisadas, como asistir al gimnasio o aumentar el nivel de ejercicio por cuenta propia. Estas prácticas pueden inducir recaídas significativas.
Considerar un programa de actividad física individualizado solo en pacientes que:
Se encuentren estables y deseen aumentar su capacidad funcional.
Comprendan los riesgos y beneficios asociados a la activi- dad física en EM/SFC.
El programa debe incluir:
Evaluación de la línea base funcional, determinada por el nivel de actividad que el paciente puede realizar sin desenca- denar síntomas.
Iniciar con un nivel inferior al de su línea base, sostenido de forma estable antes de cualquier intento de incremento.
Permitir ajustes flexibles, según tolerancia individual.
Educar al paciente en la identificación temprana de exacer- baciones y cómo actuar ante un brote de síntomas.
Estrategias a evitar:
No ofrecer terapias basadas en ejercicio como cura.
No utilizar programas de ejercicio desarrollados para otras patologías o personas sanas.
Evitar esquemas con incrementos fijos predeterminados, conocidos como terapia de ejercicio gradual (GET, por sus siglas en inglés), que han demostrado inducir recaídas en nu- merosos pacientes.
Esta postura refleja una evolución en el manejo del EM/ SFC, que pone el foco en la seguridad del paciente y en respe- tar los límites de su energía disponible. ¿Querés que prepare una infografía o cuadro que contraste las recomendaciones versus las prácticas contraindicadas para incluir como figura en el artículo? También podemos avanzar con las conclusio- nes si estás lista.
Nutrición, microbiota y EM/SFC
La intervención nutricional y el estudio de la microbiota in- testinal están emergiendo como componentes relevantes en el abordaje del síndrome de fatiga crónica/encefalomielitis miálgica (EM/SFC). Diversas investigaciones sugieren que la disbiosis intestinal podría estar implicada en la fisiopatología del EM/SFC, lo que abre nuevas posibilidades tanto diagnós- ticas como terapéuticas (31–32).
Una proporción significativa de pacientes con EM/SFC pre- senta trastornos gastrointestinales: entre un 38 % y un 42 % cumple criterios de síndrome de intestino irritable (SII), y más del 70 % refiere síntomas digestivos variados (33). Esta alta comorbilidad sugiere una asociación estrecha entre el estado del microbioma intestinal y la expresión clínica del EM/SFC.
Hallazgos recientes:
Una revisión sistemática que analizó 11 estudios previos (n=553 pacientes con EM/SFC, n=480 controles sanos) halló una reducción significativa en la diversidad alfa del microbio- ma intestinal en pacientes con EM/SFC, así como alteracio- nes en la diversidad beta (estructura general del ecosistema microbiano) (34).
Esta menor diversidad microbiana intestinal también se ha observado en otras condiciones crónicas como obesidad, dia- betes tipo 2, enfermedades inflamatorias intestinales (EII) y algunos trastornos de salud mental.
Estos hallazgos respaldan la hipótesis de que la disbiosis in- testinal contribuye a síntomas clave del EM/SFC, como la fati- ga, los trastornos cognitivos y los síntomas neuropsiquiátricos.
Estrategias de intervención:
Se promueve un plan de alimentación antiinflamatorio, per- sonalizado y sostenido, como estrategia de primera línea. Esta dieta, bien explicada, suele tener buena aceptación y respues- ta clínica en pacientes con EM/SFC.
La manipulación terapéutica de la microbiota, a través de probióticos, simbióticos o incluso el trasplante de microbio- ta fecal (FMT), ha sido propuesta como opción terapéutica prometedora. Aunque aún experimental, esta estrategia ha
despertado interés creciente en el contexto del EM/SFC (35).
Consideraciones finales:
Si bien los resultados actuales son prometedores, es nece- saria más investigación para establecer la causalidad y espe- cificidad del vínculo entre microbiota y EM/SFC. Esto podría contribuir al desarrollo de biomarcadores, estrategias de pre- vención y tratamientos más personalizados.
Consideraciones prácticas en el abordaje del EM/SFC
El manejo del síndrome de fatiga crónica/encefalomielitis miálgica (EM/SFC) plantea múltiples desafíos diagnósticos y terapéuticos. Frente a su complejidad, se recomienda adoptar un enfoque integral, empático y personalizado. A continua- ción, se destacan algunas recomendaciones clínicas basadas en la experiencia profesional y la evidencia:
Evaluación en múltiples consultas: Dado que los síntomas suelen ser fluctuantes y diversos, se sugiere realizar una eva- luación escalonada, incluyendo aspectos médicos, psicológi- cos, sociales y económicos. La historia de vida, los antece- dentes familiares y la salud mental deben formar parte del relevamiento inicial.
Incluir a familiares: La participación de personas del entor- no cercano puede aportar información complementaria rele- vante para el diagnóstico y la planificación terapéutica.
Perfil infectológico: La evaluación del antecedente infec- cioso y los estudios serológicos pueden ser útiles como orien- tación diagnóstica, especialmente en casos post-virales o con sospecha de inmunodisregulación.
Uso crítico de redes sociales: Limitar la exposición a foros no profesionales y promover el acceso a información validada. La sobreinformación o el contenido no filtrado puede inducir ansiedad o falsas expectativas.
Etiqueta diagnóstica flexible: En muchos casos, puede ser más útil y contenedor hablar de un “sistema nervioso hiper- sensible” o de disfunción neuroinmunológica, en lugar de centrarse en una etiqueta rígida como EM/SFC.
Sospecha clínica ampliada: Frente a cuadros atípicos o no concordantes, se debe considerar la derivación a centros es- pecializados en enfermedades poco frecuentes (EPOF) o a ge- netistas. Diagnósticos diferenciales como enfermedad de Fa- bry, Lyme, ataxias genéticas o trastornos psiquiátricos deben incluirse en la evaluación diferencial.
Individualización del tratamiento: No existe un enfoque único. Es clave adaptar la estrategia terapéutica a las necesidades, preferencias y nivel funcional del paciente.
Actitud empática y esperanzadora: Explicar que, si bien el proceso puede ser complejo, siempre hay herramientas disponibles. El abordaje colaborativo profesional-paciente es cen- tral para mejorar la calidad de vida y acompañar la evolución.
Conclusiones
El síndrome de fatiga crónica/encefalomielitis miálgica
(EM/SFC) representa una condición clínica desafiante, con manifestaciones multisistémicas, diagnóstico complejo y aún sin un tratamiento curativo. La evidencia creciente sobre su fisiopatología, incluyendo la disfunción mitocondrial, la neu- roinflamación y la alteración del sistema inmune y del micro- bioma intestinal, ha permitido avanzar en su comprensión, aunque persisten importantes vacíos de conocimiento.
El abordaje clínico debe ser multidimensional, integrando herramientas diagnósticas adaptadas, estrategias terapéu- ticas individualizadas, acompañamiento psicoterapéutico y psicoeducación tanto para el paciente como para su entorno.
La estrategia del pacing, el uso prudente de fármacos como aripiprazol o suplementos como la coenzima Q10, y la consi- deración de factores nutricionales y emocionales conforman un enfoque integral que respeta la complejidad del cuadro.
Es fundamental que los profesionales de la salud manten- gamos una actitud empática, abierta y basada en la evidencia, validando el sufrimiento de quienes viven con esta enferme- dad y acompañando con claridad, prudencia y esperanza. El trabajo interdisciplinario y la escucha activa siguen siendo herramientas insustituibles.
Referencias bibliográfícas
- 1. Grach S, et al. Diagnosis and management of myalgic encephalomyelitis/chronic fatigue sy- ndrome. En Mayo Clinic Proceedings. Elsevier, 2023. p. 1544-1551.
- 2. Clayton EW. Beyond myalgic encepha- lomyelitis/chronic fatigue syndrome: an IOM report on redefining an illness. JAMA. 2015;313(11):1101-1102.
- 3. Bakken IJ, Tveito K, Gunnes N, et al. Two age peaks in the incidence of chronic fatigue syndrome/myalgic encephalomyelitis: a popu- lation-based registry study from Norway 2008- 2012. BMC Med. 2014; 12:167.
- 4. Davis HE, McCorkell L, et al. Long COVID: major findings, mechanisms and recommenda- tions. Nat Rev Microbiol. 2023;21(3):133-146. Published correction appears in Nat Rev Micro- biol. 2023;21(6):408.
- 5. Centers for Disease Control and Prevention. Myalgic encephalomyelitis/chronic fatigue syn- drome (ME/CFS). Accessed, 2023, https://www. cdc.gov/me-cfs/index.html.
- 6. Shikova E, Reshkova V, Kumanova A, et al. European Network on ME/CFS (EUROMENE). Cytomegalovirus, Epstein-Barr virus, and human herpesvirus-6 infections in patients with myalgic encephalomyelitis/chronic fatigue syndrome. J Med Virol. 2020;92(12):3682-3688.
- 7. Kingdon CC, Bowman EW, Curran H. Func- tional status and well-being in people with myalgic encephalomyelitis/ chronic fatigue sy- ndrome compared with people with multiple sclerosis and healthy controls. Pharmacoecon Open.2018;2(4):381-392.
- 8. Encefalomielitis miálgica (o encefalopatía)
/ síndrome de fatiga crónica: diagnóstico y trata- miento Pauta NICE Publicado: 29 de octubre de 2021 www.nice.org.uk/guidance/ng206.
- 9). Krupp, L, La Rocca, N, Muir J, Steinberg,
A. The fatigue Severity Scale. Arch Neurol. 1992;46: 1121-1123.
- 10. Bateman L, Bested AC, Bonilla HF, et al. Myalgic encephalomyelitis/ chronic fatigue syn- drome: essentials of diagnosis and management. Mayo Clin Proc. 2021;96(11):2861-2878.
- 11. Rowe PC, Underhill RA, Friedman KJ, et al. Myalgic encephalomyelitis/chronic fatigue syndrome diagnosis and management in young people: a primer. Front Pediatr. 2017; 5:121.
- 12. Castro-Marrero J, Faro M, Aliste L, Sáez-Francàs N, et al. Comorbidity in chronic fatigue syndrome/myalgic encephalomyelitis: a nationwide population-based cohort study. Psy- chosomatics. 2017;58(5):533-543.
- 13. Hakim A, O’Callaghan C, De Wandele I, Stiles L, Pocinki A, Rowe P. Cardiovascular auto-
nomic dysfunction in Ehlers- Danlos syndromee- hypermobile type. Am J Med Genet C Semin. Med Genet. 2017;175(1):168-174.
- 14. König R, Paris, D, Sollberger, M, & Tscho- pp, R. Identifying the mental health burden in Myalgic Encephalomyelitis/Chronic Fatigue Syn- drome (ME/CFS) patients in Switzerland: A pilot study. Heliyon, 2024 10(5).
- 15. bp.105.017368. [56] A.R. Devendorf,
S.L. McManimen, L.A. Jason, Suicidal ideation in non-depressed individuals: the effects of a chronic, misunderstood illness, J. Health Psy- chol. 25 (2018) 2106–2117.
- 16. S.L. McManimen, D. McClellan, J. Stoo- thoff, L.A. Jason, Effects of unsupportive social interactions, stigma, and symptoms on patients with myalgic encephalomyelitis and chronic fatigue syndrome, J. Community Psychol. 46 (2018) 959–971.
- 17. P.A. Fennell, N. Dorr, S.S. George, Ele- ments of suffering in myalgic encephalomyelitis/ chronic fatigue syndrome: the experience of loss, grief, stigma, and trauma in the severely and very severely affected, Healthcare 9 (2021) 553.
- 18. A. Dickson, C. Knussen, P. Flowers, Stig- ma and the delegitimation experience: an inter- pretative phenomenological analysis of people living with chronic fatigue syndrome, Psychol. Health 22 (2007) 851–867.
- 19. Steiner S, et al. Understanding, diagno- sing, and treating Myalgic encephalomyelitis/ chronic fatigue syndrome–State of the art: Re- port of the 2nd international meeting at the Charité Fatigue Center. Autoimmunity reviews, 2023, p. 103452.
- 20. Crosby L, et al. Off label use of Aripipra- zole shows promise as a treatment for Myalgic Encephalomyelitis/Chronic Fatigue Syndrome (ME/CFS): a retrospective study of 101 patients treated with a low dose of Aripiprazole. Journal of translational medicine, 2021, vol. 19, p. 1-4.
- 21. Montoya JG, et al. Cytokine signature associated with disease severity in chronic fa- tigue syndrome patients. Proc Natl Acad Sci USA.2017;114(34): E7150–8.
- 22. Nakatomi Y, et al. Neuroinflammation in Patients with Chronic Fatigue Syndrome/Myalgic Encephalomyelitis: An (1)(1)C-(R)-PK11195 PET Study. JNucl Med. 2014;55(6):945–50.
- 23. Sobis J, Rykaczewska-Czerwinska M. The- rapeutic effect of aripiprazole in chronic schi- zophrenia is accompanied by anti-inflammatory activity. Pharmacol Rep. 2015;67(2):353–9.
- 24. Mantle D, et al. Mitochondrial dysfunction and coenzyme Q10 supplementation in post-vi- ral fatigue syndrome: an overview. International Journal of Molecular Sciences, 2024, vol. 25, no 1, p. 574.
- 25. Partridge S, et al. A systematic literature review on the clinical efficacy of low dose nal- trexone and its effect on putative pathophysio- logical mechanisms among patients diagnosed with fibromyalgia. Heliyon, 2023, vol. 9, no 5.
- 26. Driver C, D’SOUZA R. Efficacy of low-dose Naltrexone and predictors of treatment success or discontinuation in Fibromyalgia and other chronic pain conditions: A fourteen-year, enter- prise-wide retrospective analysis. Biomedicines, 2023, vol. 11, no 4, p. 1087.
- 27. Bested K, et al. Low-dose naltrexone for treatment of pain in patients with fibromyalgia: a randomized, double-blind, placebo-controlled, crossover study. Pain Reports, 2023, vol. 8, no 4, p. e1080.
- 28. Holden, S.; Maksoud, R.; Eaton-Fitch, N.; Cabanas, H.; Staines, D.; Marshall-Gradisnik,
S. A systematic review of mitocondrial abnor- malities in myalgic encephalomyelitis/chronic fatigue syndrome/systemic exertion intolerance disease. J. Transl. Med. 2020,18.
- 29. Myhill, S.; Booth, N.E.; McLaren-Howard, J. Chronic fatigue syndrome and mitochondrial dys- function. Int. J. Clin. Exp. Med.2009, 2, 1–16.
- 30. Castro-Marrero, J.; Cordero, M.D.; Saez-Francas, N.; Jimenez-Gutierrez, C.; Agui- lar-Montilla, F.J.; Aliste, L.; Alegre-Martin, J.Could mitochondrial dysfunction be a diffe- rentiating marker between chronic fatigue syn- drome and fibromyalgia? Antioxid. Redox Signal. 2013, 19, 1855–1860.
- 31. Giloteaux L, Goodrich JK, Walters WA, Le- vine SM, Ley RE, Hanson MR. Reduced diversity and altered composition of the gut microbiome in individuals with myalgic encephalomyelitis/chro- nic fatigue syndrome.Microbiome. 2016; 4:30.
- 32. Guo C, Che X, Briese T, Ranjan A, Allicock O, Yates RA, Cheng A, et al. Deficient butyra- te-producing capacity in the gut microbiome is associated with bacterial network disturbances and fatigue symptoms in ME/CFS. Cell Host Mi- crobe. 2023; 31:288-304.
- 33. Radjabzadeh D, Bosch JA, Uitterlinden AG, Zwinderman AH, et al. Gut microbiome-wide association study of depressive symptoms. Nat Commun. 2022; 13:7128.
- 34. Li Z, Zhou J, Liang H, Ye L, Lan L, Lu F, et al. Differences in alpha diversity of gut micro- biota in neurological diseases. Front Neurosci. 2022. https:// doi. org/ 10. 3389/ fnins. 2022.
879318.
- 35. Ser HL, Letchumanan V, Goh BH, Wong SH, Lee LH. The Use of fecal microbiome trans- plant in treating human diseases: too early for poop?







No comments! Be the first commenter?