AINE no selectivos y COXIB. Una evoluvion historica y algo mas
Introducción
Resumen
El dolor y la inflamación resultan padecimientos que han acompañado al ser humano a lo largo de toda su historia y siempre han demandado su pronta solución. Desde tiempos hipocráticos se usan derivados salicílicos para el control de las fiebres, pero ha sido el siglo XX con la revolución industrial donde se desarrollaron los antiinflamatorios no esteroides (AINE), fármacos esenciales para el alivio de la inflamación, el dolor y la fiebre. Este articulo resalta aspectos evolutivos de este grupo de fármacos haciendo hincapié en su seguridad e indicaciones y tiene dos objetivos, uno docente para dimen- sionar la real naturaleza de estas drogas y otro introductorio a los COXIB, los últimos AINE, que diseñados para ser panaceas terminaron siendo drogas sin muchas características diferenciales del resto.
Palabras clave
COXIB – AINE – Daño gastrointestinal – Efectos adversos cardiovasculares.
El dolor, independientemente de su origen, es uno de los cuadros más penosos y frecuentes que exigen solución inmediata (1). Por ello, el grupo de fármacos analgésicos conocidos como antiinflamatorios no esteroideos (AINE) son, si no el primero, uno de los grupos terapéuticos de más amplio uso médico-veterinario contra el dolor. Aunque su empleo se remonta a la fitoterapia hipocrática (uso de la corteza de sauce para calmar las fiebres y el dolor), fue en los siglos XIX y XX donde la revolución industrial, el desarrollo químico-farmacéutico y el avance farmacológico coincidieron para aislar, sintetizar y mejorar compuestos con efecto AINE.
En efecto, Hoffman en 1897, retomando las ideas de Gerhardt redescubre el ácido acetil salicílico y su compañía lo lanza como aspirina en 1899 iniciando la era AINE; aun cuando una década antes, en 1886, se comunicase que co- lorantes anilínicos y pirazolónicos tenían propiedades antipi- réticas y analgésicas. Casi un siglo después, Vane y colabo- radores demostraron que los AINE inhibían la biosíntesis de prostaglandinas (PG) por bloqueo de su enzima productora, la ciclooxigenasa (COX), sentando las bases del mecanismo de acción AINE (hecho que le valió el Premio Nobel del año 1982). Finalmente, a partir de 1991, tras la dilucidación de la estructura tridimensional de las dos isoformas COX surgen los inhibidores altamente selectivos de la COX-2 o simple- mente COXIB (2, 3). Hasta la aparición de los corticoides a
Serra HA. “AINE no selectivos y COXIB. Una evolución histórica y algo más”. Analgesia y manejo del Dolor 2025;1:4-13. Puede consultar otros artículos publicados por los autores en la revista Analgesia y manejo del Dolor en sciens.com.ar
mitad del siglo pasado o de la terapéutica biológica en este siglo, el único tratamiento disponible para las afecciones in- flamatorias crónicas como la artrosis o la artritis reumatoidea eran los AINE y esto explica porque se estimuló su síntesis y desarrollo durante todo el siglo XX buscando el más efectivo y seguro para el control del dolor y la inflamación. En el devenir se estudiaron mil o más compuestos de los cuales cayeron en desuso o fueron prohibidos más del 98%, consolidándose no más de una veintena.
En suma, los AINE son un conjunto heterogéneo de sustan- cias que comparten tres efectos: antiinflamatorio, antifebril y analgésico, aunque algunos son también antiagregantes pla- quetarios (4, 5). Clínicamente ofrecen importantes diferen- cias en eficacia y seguridad debidas a las propias moléculas y a la variabilidad de los pacientes que los reciben. Si bien son moléculas relativamente seguras, su gran consumo, abusivo con frecuencia, determina la aparición de efectos adversos de cuidado (6-8). Es objetivo de este trabajo destacar algunos aspectos relevantes de estas sustancias en su empleo clínico, sobre todo lo referente a seguridad, y a la postre, servir de introducción al artículo siguiente.
Las COX, el mecanismo de acción prin- cipal de los AINE y la clasificación fun- cional
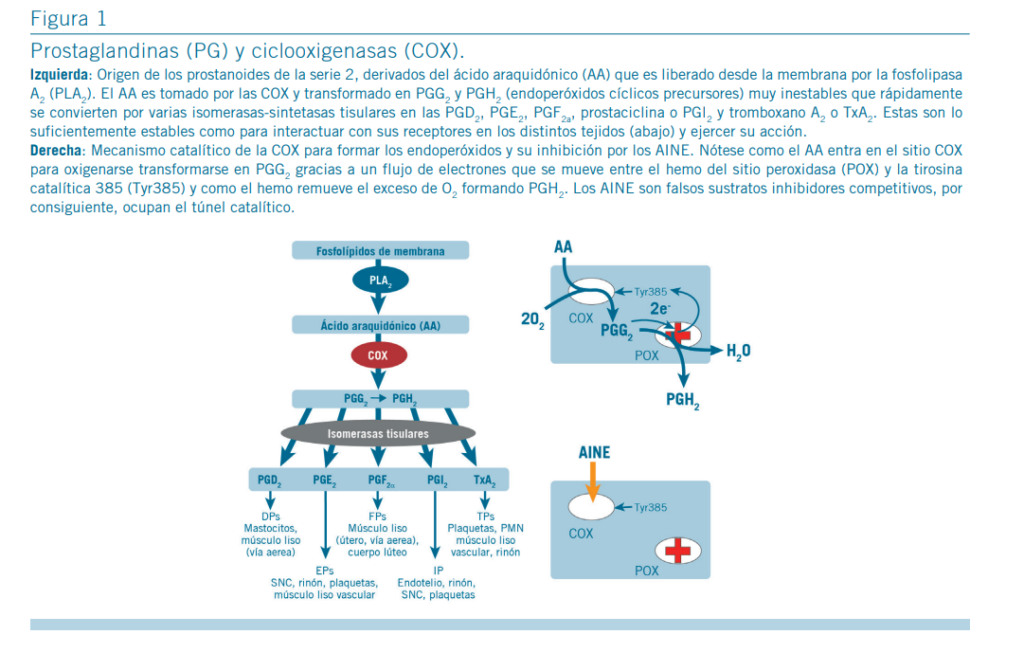
Las COX o prostaglandin endoperoxido sintetasas son hemoproteínas diméricas del retículo endoplásmico (9, 10). Catalizan la adición de O2 en las posiciones 11 y 15 de ácidos grasos poliinsaturados de 20 carbonos (genéricamente ácidos eicosa-n-enoicos) para sintetizar los endoperóxidos cíclicos, PGG y PGH, de los que derivan las demás PG y los tromboxanos (Tx). Debido a la abundancia de ácido araquidónico o eicosatetraenoico en la dieta humana habitual, los derivados prostanoides formados pertenecen casi todos a la serie 2 (Fi- gura 1 izquierda) (3).
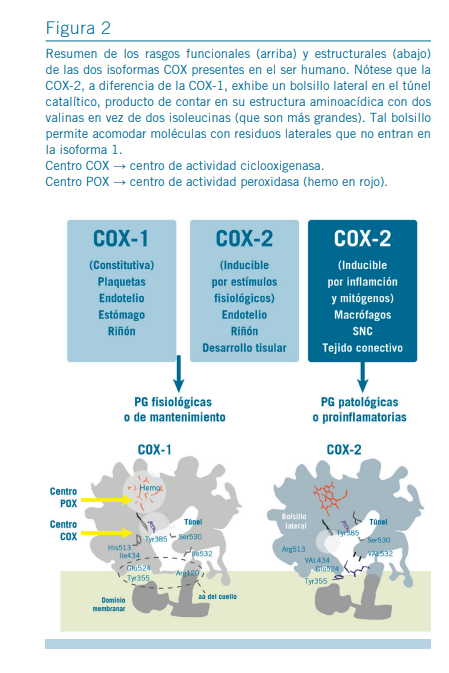
En el hombre, existen dos isoformas COX activas producto de sendos genes con un 60% de homología (3, 9), la COX-1 y la COX-2. La COX-1 se expresa constitutivamente en varios lugares del organismo como el tubo digestivo, las plaquetas, el endotelio vascular o el riñón para producir PG regulatorias de funciones tisulares como citoprotección o agregación pla- quetaria. En cambio, la COX-2 es inducible pues solo apa- rece en los tejidos tras estimulación. Las COX convierten el ácido araquidónico en prostanoides mediante dos reacciones secuenciales acopladas (por ello se dice que son enzimas bi- funcionales) la peroxidasa y la ciclooxigenasa (Figura 1 de- recha). La actividad peroxidasa requiere hemo y la PGG, de dicha actividad surgen la PGH (producto final) y los electrones necesarios para la actividad ciclooxigenasa que lleva a cabo la Tyr385 introduciendo dos moléculas de oxígeno en el ácido graso para formar la PGG (3).
Debido a que los principales estímulos inductores COX-2
son los mediadores inflamatorios, citokinas y mitógenos, se pensó que la COX-2 se expresaba solamente en tejidos infla-
mados para producir PG proinflamatorias y proalgesicas. Tal apreciación simplificada de la biología COX, COX-1 sinónimo de “fisiológica” y COX-2 sinónimo de “patológica” (3,11-13) está muy alejada de la realidad y condujo erróneamente al posicionamiento de los COXIB como los antiinflamatorios más eficientes, contundentes y seguros cuando en realidad son AINE poco gastrolesivos y mejores que otros únicamente en ciertas indicaciones. Esto es así porque la COX-2 es inducida también en tejidos no inflamados por estímulos fisiológicos, como p ej. el estrés de fricción sobre el endotelio vascular o la carga filtrada de Na+ en el aparato yuxtaglomerular. Así, los prostanoides derivados de esta enzima resultan fundamen- tales para la regulación del tono vascular, el funcionalismo renal, el crecimiento y la remodelación tisular, a la vez que toman parte en la fisiopatología tumoral (14-19). Además, los prostanoides producidos por la COX-2 en tejidos embrionarios participan de su desarrollo, tal como se demuestra en ratones “knock out COX-2” que presentan severas malformaciones re- nales al nacer y mueren al poco tiempo (9, 16-20). Finalmen- te, para complejizar la biología COX, en otras especies, pero no en el hombre, se expresa en el SNC una variante de corte extra del gen COX-1, la COX-3 (9, 20).
El mecanismo de acción principal de cualquier AINE es inhibir la actividad de las COX, reduciendo drásticamente la sín- tesis de prostanoides (Figura 1 derecha abajo). De la inhibi- ción COX dependen los efectos antifebriles, cardiovasculares, digestivos y renales de estas moléculas, pero sólo parte de los efectos antiinflamatorios y analgésicos ya que aquí se hallan implicados mecanismos adicionales (21-24). Todos, salvo el paracetamol, resultan falsos sustratos análogos de los ácidos eicosa-n-enoicos pues exhiben en una parte de su molécula una estructura espacial similar; esto justificaría porqué es- tructuras aparentemente diferentes tienen efectos similares. La aspirina inhibe adicionalmente y en forma irreversible las COX transfiriendo su grupo acetilo a la Ser530 formando un enlace covalente, que inactiva la enzima (3, 16). En cambio, el paracetamol y otras anilinas inhibiría las COX al interferir con el estado redox de la Tyr385 mediante la producción de metabolitos reactivos y/o agotamiento del glutatión (25).
Todo el proceso catalítico y su inhibición ocurre en un túnel hidrofóbico con acceso desde la membrana, pero levemente diferente en cada isoforma COX; por ejemplo, la COX-1 presenta un túnel sin un bolsillo lateral, mientras que la COX-2 tiene uno que puede dar cabida a moléculas con grupos laterales voluminosos como los de los COXIB (3, 10, 13, 16, 17) (Figura 2 abajo). En base a la selectividad COX los AINE pueden clasificarse funcionalmente como (11, 12, 17):
- Inhibidores selectivos de la COX-1 plaquetaria, aspirina a bajas dosis como antiagregante.
- Inhibidores no selectivos de las COX, salicilatos, naproxe- no, ibuprofeno, indometacina, piroxicam.
- Inhibidores preferenciales de la COX-2, meloxicam, di- clofenac.
- Inhibidores altamente selectivos de la COX-2 o COXIB, celecoxib, etoricoxib.
Sin embargo, esta clasificación desde el punto de vista far- macodinámico presenta algunas falacias.
- Primero, la selectividad de la aspirina sobre la COX-1 pla- quetaria, es resultado de tres hechos fisiológico-bioquímicos convergentes: las plaquetas son trozos celulares y carecen de maquinaria de reposición enzimática; la vía oral permite a la aspirina administrada a bajas dosis (100 mg) interactuar mientras se absorbe casi exclusivamente con las plaquetas en la circulación portal, y la aspirina es un inhibidor irreversible COX. Como las plaquetas no pueden producir nuevas molécu- las COX para reemplazar a las inhibidas se anula la actividad agregante TxA2 dependiente y su recuperación solo es función del recambio plaquetario. El efecto antiagregante se pierde a las dosis usuales antiinflamatorias o analgésicas (500 – 1000 mg), puesto que queda droga capaz de interferir con otras COX, en especial la COX-2 endotelial y menoscabar la síntesis de PGI2 que se contrapone a los efectos del TxA2 (16, 17, 26).
- Segundo, la definición de COXIB se aplica a AINE de síntesis dirigida es decir producidos conociendo y teniendo en cuenta la estructura del túnel catalítico de cada COX. Sin embargo, hay moléculas COX-2 selectivas como la nimesulida cuyo desarrollo se produjo incluso antes de la descripción del mecanismo de acción AINE (19).
Por ello, propusimos clasificar a los AINE desde el punto de vista farmacodinámico, funcional y terapéutico en solo dos grupos (ver Figura ):
- AINE no selectivos: aspirina, ibuprofeno, ketoprofeno, pi- roxicam, indometacina, ketorolac.
- AINE COX-2 selectivos: meloxicam, diclofenac, COXIB.

El shunt o desvío metabólico del ácido araquidónico
Cualquier ácido eicosa-n-enoico puede seguir vías alternati- vas a las COX y ser metabolizados a hidroperoxiácidos (HPE- TE), hidroxiácidos (HETE), lipoxinas (Lx), leucotrienos (LT) y endocanabinoides. Por otra parte, el estrés oxidativo celu- lar produce espontáneamente (sin enzimas) análogos pros- taglandínicos llamados isoprostanos (26, 27). Todos estos compuestos presentan diferente grado de actividad biológica sobre todos los órganos y tejidos de la economía. Tal vez las vías más importantes sean las que catalizan las lipooxigena- sas (LOX). La 5-LOX es fundamental para la síntesis de LTB, que es uno de los más importantes quimiotácticos, y los cis- teinil-LT, LTC, LTD y LTE, que en conjunto constituyen la sustancia de reacción lenta de la anafilaxia, el broncocons- trictor más potente y sostenido. Las 12 y 15-LOX en conjunto con la 5-LOX producen Lx, mientras que la 12-LOX produce 12-HPETE y 12-HETE, sustancias de modulación neuronal y activadoras de polimorfonucleares y macrófagos.
Cuando los AINE inhiben la síntesis de PG, queda disponible un exceso de ácido araquidónico que por shunt o des- vío metabólico sigue preferentemente las vías comentadas, produciendo efectos adversos o terapéuticos adicionales. Este mecanismo explica el asma por aspirina (28) y otras reac- ciones anafilactoides derivadas del exceso de cisteinil-LT en pacientes susceptibles, las microinjurias vasculares por LTB
(28) o la potenciación analgésica de los opiáceos por libera- ción 12-HPETE en el SNC (30, 31). Asimismo, si la COX-1 plaquetaria está inhibida, la 12-LOX produce un exceso de Lx cuya importancia biológica debe aún definirse (26).
Los efectos antiinflamatorios, los efec- tos adversos gastrointestinales y el ad- venimiento de los COXIB
Los cuadros inflamatorios agudos y crónicos presentan va- riados matices comprendidos entre dos extremos, el neurogé- nico y el inmunogénico, dependiendo del tipo de agente cau- sal, de la fisiopatología y de la variabilidad interindividual de los enfermos (10). Caracteriza al cuadro neurogénico su inicio a partir de reflejos nerviosos de tipo anterógrado en terminales libres activados por mecanismos neuroplásticos medulares o ganglionares y su mantenimiento debido a la participación de mediadores mastocitarios y neuropéptidos (32). Su síntoma principal y casi único es el dolor. En cambio, caracteriza al cuadro inmunogénico la existencia de una noxa desencade- nante (generalmente biológica), y su mantenimiento y progre- sión se debe a la participación de fenómenos como infiltración celular, fagocitosis y estallido respiratorio (33). Tiene tenden- cia a la cronicidad y su signo-sintomatología es más florida, siendo el dolor solo una de varias manifestaciones (34).
Por lo comentado, la demanda de AINE como tratamiento en primera instancia es sustancial, aunque si se analiza la fisiopatología de cada forma, los AINE serían más útiles en las formas neurogénicas que en las inmunogénicas, pues ejercen sobre las terminales libres nociceptivas claros efectos hiperpolarizantes y modificadores del umbral, a la vez que re- ducen la conducción de la información dolorosa (21, 22, 30, 31). En cambio, en la inflamación inmunogénica son menos contundentes que los glucocorticoides pues actúan en puntos intermedios y no sobre una vía final común. Bajo estas ideas los AINE modulan la actividad de macrófagos y polimorfonucleares impidiendo que dañen por exceso a los tejidos nobles, pero al no afectar linfocitos y mastocitos no sirven para tratar cuadros inmunoalérgicos e incluso por shunt pueden agravarlos.
Las diferencias antiinflamatorias entre los AINE se deben a que adicionalmente a la inhibición COX poseen otros blan- cos y mecanismos, y no todos actúan igual sobre estos, por ejemplo:
- El efecto de los salicilatos en procesos crónicos como fiebre reumática o artritis reumatoidea dependería fundamen- talmente del bloqueo en la vía del NF-kB (Factor Nuclear de transcripción de las cadenas k de IgG) que es el activador génico principal de la inflamación. Puesto que en estas pa- tologías se emplean dosis altas se especula que con ellas se obtienen las concentraciones plasmáticas necesarias para interferir con la IKK (quinasa activadora del NF-kB), varias veces superiores a las requeridas para inhibir la síntesis de PG (35, 36).
La indometacina, el ibuprofeno y el diclofenac exhiben actividad antiinflamatoria preferencial porque además de inhibir ambas COX, activan los PPARg y a (Receptores Ac- tivadores de Proliferación Peroxisomal) pues son agonistas parciales. Como resultado reprimen la actividad macrofágica, en especial el estallido respiratorio (23, 37, 38). Derivado de esto, varios AINE serían útiles en ciertas neoplasias (colon, pulmón) porque, además de inhibir la COX-2 tumoral, anta- gonizan la acción de la PGI sobre el PPARd, mecanismo que favorece la separación e indiferenciación celular propia de la tumorigénesis (23).
- Los AINE durante su uso crónico parecen ejercen efectos variables sobre el cartílago articular de pacientes con artrosis según su eficacia inhibitoria sobre las metaloproteasas; estu- diado el problema en modelos animales se ha propuesto que existirían tres tipos de AINE (39, 40): aquellos que protegen y mejoran la calidad del cartílago como el etodolac o los CO- XIB; aquellos que parecen no ejercer efecto alguno, como los oxicamos o el diclofenac, y aquellos que producen un efecto deletéreo favoreciendo su destrucción como los salicilatos, la indometacina o los derivados arilpropiónicos.
- Finalmente, el paracetamol carece de eficacia clínica en la inflamación inmunogénica debido a la abundancia de radi- cales libres del oxígeno derivados del estallido respiratorio en los focos inflamados. Estos radicales oxidan e inactivan al pa- racetamol antes de que alcance su blanco, pues para inhibir las COX requiere estar reducido (25, 41).
Al igual que con otros fármacos, los efectos adversos de los AINE pueden ser dosis dependientes y dosis independientes
(42). Los dosis dependientes o esperables derivan de los me- canismos de acción farmacológica o del efecto terapéutico, es decir relacionadas con la inhibición COX. Son comunes a todos los AINE, aunque las diferentes moléculas no exhiben igual riesgo. La gastrolesividad, los trastornos renales y car- diovasculares son reacciones de este tipo. Los dosis indepen- dientes o no esperables dependen de la idiosincrasia es decir que la genética de los pacientes u otra covariable tiende a promoverlos. Son fenómenos limitados a algunas sustancias y se deberían a polimorfismos en los blancos de acción, en las enzimas metabólicas, en los transportadores o en el complejo mayor de histocompatibilidad. Las reacciones anafilactoides y cutáneas, la hepatotoxicidad y la agranulocitosis pertenecen a este tipo que se relacionarían con la formación de metabolitos reactivos derivados de ciertos AINE.
De acuerdo con la frecuencia de aparición ocupan el primer
lugar lejos, las manifestaciones gastrointestinales; puede es- timarse que más del 50% los individuos que reciben AINE los presentan. Le siguen las reacciones alérgicas o pseudoalér- gicas (entre el 1 al 10% de los consumidores), la retención hídrica, edemas con propensión a la hipertensión arterial (hasta en un 5%) y las manifestaciones cutáneas (~0,3%). En cambio, son muy raras la hepatotoxicidad (0,00001 a 0,00008%), la agranulocitosis (0,000001%) y los trastornos nerviosos. Sin embargo, debe notarse que la sobredosifica- ción-sobreexposición y la intoxicación aguda predisponen a la aparición de cualquiera de ellas sin importar las frecuencias mencionadas (43, 44).
Como fue relatado en la introducción, las primeras sustan- cias en ser empleadas como antifebriles y antiinflamatorios fueron los derivados salicílicos, por eso la búsqueda de nue- vos AINE se centró en otros ácidos aun cuando ciertas ani- linas también las poseían. En paralelo comenzó a registrase intolerancia digestiva (recordar al respecto que Hoffman sin- tetizó el ácido acetilsalicílico como forma de reducirla) tanto que hoy se la reconoce como uno de los efectos adversos más serios atribuibles a un tratamiento farmacológico (43, 45). Así es que siempre fue de especial interés encontrar AINE que fuesen mejor tolerados.
Los mecanismos de lesión digestiva propuestos son tres, la irritación directa de la mucosa gástrica por AINE ácidos, la inhibición de la síntesis de PG citoprotectoras y el shunt del ácido araquidónico hacia 12-HPETE.
- La irritación local con epigastralgia suele ser la primera manifestación en aparecer sobre todo si se emplea la vía oral y se debe a que los AINE sufren atrapamiento iónico intracelu- lar en la mucosa gástrica. Esta acumulación es mayor cuanto más fuerte es su propiedad ácida (pKa más bajo) pudiendo dañar las células. La interpretación de este mecanismo ines- pecífico determinó la síntesis, investigación e introducción comercial de AINE enólico-fenólicos y sulfónicos mucho más débiles y casi sin atrapamiento mucoso para reemplazar a los
carboxílicos, pero esto no redujo las manifestaciones gastroin- testinales ante el uso crónico.
- Las PGE2 y PGI2, producto de la COX-1 principalmente, ejercen funciones tróficas y reparadoras en la mucosa gás-
trica, resumidas bajo el nombre de citoprotección (29). Este mecanismo reduce (pero no suprime) el daño químico y físico ocasionado por el jugo gástrico y los alimentos. Por ello, la inhibición de la síntesis de PG citoprotectoras por AINE no se- lectivos, está indefectiblemente unida al daño y a la aparición de lesiones erosivas ulcerativas gastroduodenales limitadas (4, 16, 43). La propensión al daño por estos AINE será mayor cuanto más afín por la COX-1 sean (10-13). Sin lugar a duda, esto potenció la búsqueda de moléculas selectivas carentes de efecto sobre la COX-1 que culminó con los COXIB.
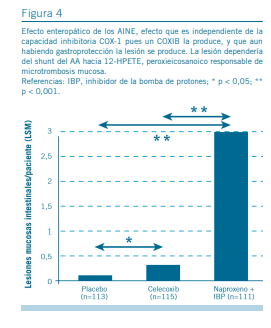
- Sin embargo, el shunt del ácido araquidónico hacia 12-HPETE es un mecanismo lesional no muy tenido en cuen- ta, aunque fuese descripto hace ya más de tres décadas (29). El incremento de 12-HPETE hace que esta molécula como activadora de los polimorfonucleares, induzca su deposición con formación microtrombos capilares con inflamación y daño isquémico mucoso. Normalmente la presencia de PGI2 endotelial (COX-2 dependiente) antagoniza la microtrombosis pero se halla inhibida. Este es un mecanismo que suele aparecer solapadamente con el uso continuo de cualquier AINE, y sería responsable de fenómenos erosivos tardíos en cualquier zona del tubo digestivo e incluso cuando se usan AINE con inhibidores de la bomba de protones (46) (Figura 4). En suma, por lo anteriormente expresado hoy día debe considerarse reemplazar el término gastrolesividad (o gastropatía) debida a AINE por enterolesividad (o enteropatía) debida a AINE ya que puede aparecer en diferente grado, en diferentes zonas del tubo digestivo, sobre todo con el uso prolongado de cualquier AINE, y que no responde exclusivamente de la inhibición COX-1 (19).
- Hacia fines de los 80 y principio de los 90 del siglo pasado había disponibles una gran cantidad de moléculas con efecto AINE; dentro de los derivados sulfónicos desarrollados bajo estudio se destacaban dos por poseer mínimos efectos gastrolesivos, el DuP-697 (una variante de las pirazolonas) y la nimesulida (un nitrocompuesto anilínico). Por ese tiempo también se produjo la identificación funcional y genética de las dos isoformas COX, con lo cual la expresión de estas enzi- mas en células de prueba proporcionó una forma adicional y más rápida de evaluar la eficacia y seguridad de los AINE que los típicos estudios en animales. A esto le siguió el modelado estructural proteico por computadora usando datos cristalográficos disponibles. Así, se reorientó la investigación hacia la búsqueda de sustancias con selectividad COX-2. En esta línea, los químicos de Searle (luego Pfizer) y los de Merck se embarcaron en una carrera a lo largo de la década de 1990 que, tomando al DuP-697 como modelo y los requerimientos estéricos de las COX, culminó con la introducción clínica del celecoxib y el rofecoxib (12, 13, 19, 47), los primeros COXIB diseñados racionalmente basados en una estructura sulfonil diaril cis-estilbeno sustituida con grupos químicos capaces de alojarse en el bolsillo lateral COX-2.
La saga cardiovascular de los COXIB¿peligros o enseñanzas?
La excelente tolerancia gástrica de los primeros COXIB generó una gran aceptación médica y social en los primeros años del nuevo siglo que promovió mucho el uso a largo plazo de estos compuestos. Uso que abarcaba no solo cuadros infla-

matorios crónicos como artritis reumatoidea y artrosis, sino también patología tumoral y neurodegenerativa relacionadas con la sobreexpresión COX-2 (23, 35, 48-51).
A los dos mencionados le siguieron la dupla parecoxib-val- decoxib (respectivamente prodroga y droga), el etoricoxib y el lumiracoxib (de Novartis, el único no estilbeníco derivado directo del diclofenac). Adicionalmente, la investigación se centró en la modificación de la estructura química de AINE clásicos, como indometacina o aspirina, dotándolos de cade- nas laterales o grupos voluminosos como forma de mejorar la selectividad COX-2. Sin embargo, estas aproximaciones fracasaron rotundamente (47).
Lamentablemente, la revisión de la seguridad de los estu- dios VIGOR y APPROVe (52, 53) determinó un mayor riesgo de padecer enfermedad cardiovascular isquémica con rofecoxib a largo plazo, lo cual encendió las alarmas e hizo extensiva tal revisión a los demás AINE, y a la vez determinó que compañía Merck decidiese retirar el fármaco de la comercialización mundial en forma unilateral, sin que mediara acción de autoridad regulatoria alguna. Como hemos visto, los AINE no selectivos a nivel circulatorio reducen tanto la PGI2 (COX-2 endotelial) como el TxA2
(COX-1 plaquetaria) lo que en principio no afecta la respuesta hemostática o el tono vascular. Pero si se administran junto con aspirina a dosis bajas antagonizan su efecto antiagregante, porque compiten a nivel del túnel catalítico de la COX-1 impidiendo su acetilación irreversible, lo cual puede resultar contraproducente (45). Los AINE selectivos, en cambio, carecen de efectos sobre la COX-1, por lo tanto, son proagregantes y vasoconstrictores, y conllevan mayor riesgo de padecer eventos trombóticos excepto que se administren con aspirina a bajas dosis (45, 54, 55). Y puesto que las PGE2 y PGI2, producto de las COX renales, son fundamentales para el correcto manejo de sodio y agua, es esperable también que aquellos individuos que reciban cualquier tipo de AINE, sobre todo en forma crónica, sufran retención hídrica con aparición de edemas y aumento de su presión arterial, y si están bajo terapia antihipertensiva respondan menos (3, 16, 26, 54, 56). Así, el tratamiento AINE prolongado puede predisponer a la enfermedad cardiovascular o agravar la situación de pacientes con antecedentes cardiovasculares. Dos metaanálisis realizados hace casi dos décadas atrás fueron claros al respecto:
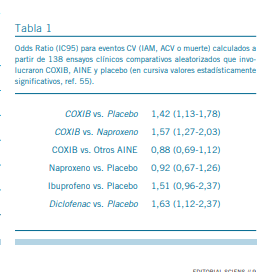
El de McGettigan y Henry (57) incluyó 23 estudios observacionales epidemiológicos (6 prospectivos de cohorte y 17 retrospectivos de caso-control) sobre consumo de AINE en la población general y muestra el mayor riesgo cardiovascular entre los consumidores de rofecoxib, diclofenac e indometacina, tres AINE pertenecientes a los dos grupos (Tabla 3). En la actualidad solo dos COXIB siguen comercializados, el celecoxib y el etoricoxib, ya que el valdecoxib siguió la misma suerte que el rofecoxib (58); mientras que el lumiracoxib y la nimesulida fueron retirados por hepatotoxicidad.
A propósito, la hepatotoxicidad por AINE es una manifestación infrecuente e impredecible excepto la inducida por paracetamol que es dosis dependiente. Suele aparecer entre 1 y 6 meses de iniciado el tratamiento como hallazgo de laboratorio (aumento de las transaminasas e hiperbilirrubinemia) o cuadros sintomáticos de distinta intensidad (hepatitis aguda o inflamación periportal). Si se detecta a tiempo y se suspende
el AINE el cuadro resuelve en 4-8 semanas, pero si no, puede culminar en insuficiencia hepática severa con riesgo de vida.
Está vinculada al metabolismo microsomal de los AINE, por tanto, la predisposición individual y los factores de riesgo jue- gan un gran papel. La infancia, la ancianidad, el sexo feme- nino, la autoinmunidad, las hipovitaminosis, el alcoholismo, el uso concomitante de fármacos inductores metabólicos y la presencia de hepatopatías preexistentes son los factores de riesgo destacables (43, 59).
Se han propuesto como mecanismos de hepatotoxicidad, la colestasis y la necrosis hepatocelular (59, 60). La colestasis surge como consecuencia de la competencia del AINE y la bi- lirrubina conjugados por el transportador MRP2 o ABCC2 del polo biliar. AINE voluminosos como la indometacina “traban” el transporte y la bilirrubina “sale” por sangre hacia el riñón generando hiperbilirrubinemia. La necrosis hepatocelular es más tórpida, se debería a la génesis de metabolitos reacti- vos especialmente a partir de AINE con estructura anilínica como el paracetamol, el diclofenac, el clonixinato de lisina, el lumiracoxib o la nimesulida; metabolitos que tienen la capa- cidad de transformarse en haptenos o generar daño por estrés oxidativo.
Por todo lo dicho en materia de seguridad, la prescripción y uso de los AINE ha cambiado notablemente. No solo del mi- llar de moléculas posibles desarrolladas bajo la premisa AINE se comercializan muy pocas en la actualidad, sino que la pau- ta y tiempos de uso de estos fármacos se ha reducido, las agencias regulatorias tienen siempre el ojo puesto sobre ellos, y el tipo de paciente/consumidor está mucho mejor informa- do. Así que la palabra adecuada a usar después del análisis de esta sección es precaución y no prohibición.
Conclusiones. Los AINE en la actualidad
Hoy día los AINE se usan, solos o asociados, en toda situa- ción donde hay inflamación, dolor o fiebre constituyendo las indicaciones clásicas (4, 61) a demanda (ocasional) o en tra- tamientos de distinta duración (los crónicos deben estar siem- pre bajo estricta supervisión médica). Bajo este contexto, los AINE se hallan indicados en: Procesos inflamatorios agudos y crónicos de diferente ubicación como artritis reumatoidea, fiebre reumática, artrosis, artritis de diversa etiología, ataque agudo de gota, inflamaciones derivadas de traumatismos y lesiones en general, fracturas, distensiones y aquellas que acompañan a la infección. Dolor leve a moderado de origen nociceptivo o nociplástico causado por procesos mioosteoar- ticulares, traumáticos, quirúrgicos, odontológicos, tumorales y viscerales (dolor cólico renoureteral o biliar); dismenorrea; cefaleas y como preventivos en las migrañas. Cuadros febriles infecciosos (incluido el síndrome gripal) o tumorales. Debe destacarse que los AINE resuelven síntomas, pero no causas, por ello para la mayoría de estas indicaciones resultan medi- cación sintomática y coadyuvante del tratamiento de base.
Adicionalmente, se los suele emplear en situaciones don-
de se producen PG en forma inadecuada. Estas son las lla- madas indicaciones alternativas (4, 49, 58, 61-65) siempre bajo control médico, por ejemplo, el síndrome de Bartter, la hipercalcemia paraneoplásica, la prevención de calcificación heterotópica tras la cirugía traumatológica, el cólico renal o biliar, como adyuvante de la terapia del cáncer colorrectal y en indicaciones obstétrico-neonatales como parto prematuro, polihidramnios y cierre del ductus arterioso. En muchas de estas últimas se ha empleado preferentemente indometacina o diclofenac por más de cuatro décadas y más recientemente, los COXIB.
Para la selección de un AINE en particular, deben tenerse en cuenta ciertas diferencias propias de la droga y propias del paciente (4, 10, 44, 66). Entre las primeras se hallan, el tipo según la isoforma COX inhibida (selectivo o no selectivo), su vida media (t½) de eliminación, la dosis y la vía de administración empleadas, y los objetivos y duración del tratamiento. Entre las segundas se tienen, las covariables propias (edad, sexo, talla y peso), la intensidad del proceso patológico, la variabilidad interindividual en la respuesta (etnia y farmaco- genética), la existencia de patologías y tratamientos conco- mitantes y los fenómenos subjetivos del paciente (efecto placebo, de fundamental importancia en los cuadros dolorosos). Además, debe considerase que:
- Dosis usuales producen un efecto terapéutico cercano al máximo. Así, dosis mayores sólo producirán más efectos adversos y toxicidad aguda sin aumentar sustancialmente la eficacia.
- Con t½ similares, la duración de acción es mayor con AINE inhibidores irreversibles o reversibles tiempo dependientes. Si se trata de los últimos, con dosis infra máximas, la duración de acción es, aproximadamente, proporcional a la t½ de eli- minación.
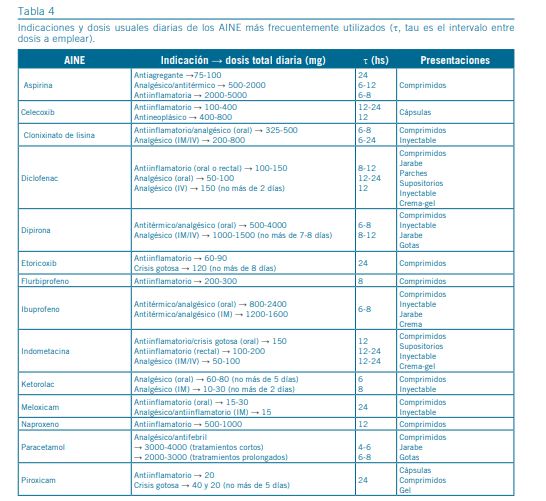
La Tabla 4 resume algunos aspectos para tener en cuenta del uso y dosificación de los AINE.
En suma, los AINE son fármacos terapéuticamente muy útiles porque presentan acciones superpuestas a otros grupos de drogas, pero sin ocasionar sus efectos adversos. P ej., son antiinflamatorios, pero no provocan los efectos catabólicos, inmunosupresores y hormonales de los glucocorticoides; son analgésicos, pero no causan depresión del SNC o la farmaco- dependencia típica de los opiáceos, ni afectan otras modalidades sensoriales como los anestésicos locales; unos pocos resultan antiagregantes plaquetarios sin causar el sangrado de los anticoagulantes, y finalmente, son antifebriles sin causar hipotermia. Pero aún así, no debe olvidarse que no son inocuos y que muchísima gente abusa de ellos pues no los considera fármacos, especialmente aquellos de venta libre. Aquí es como profesionales de la salud que debemos ejercer docencia y disipar temores para un mejor beneficio de nuestros pacientes ante el uso de la terapia farmacológica.
Referencias bibliográficas
- 1. Raja SN, Carr DB, Cohen M, Finnerup NB, Flor H, Gibson S, et al. The revised International Association for the Study of Pain definition of pain: Concepts, cha- llenges, and compromises. Pain 2020; 161: 1976-
82. doi: 10.1097/j.pain.0000000000001939.
- Vane JR. Inhibition of prostaglandin synthesis as a mechanism of action for aspirin-like drugs. Nat New Biol 1971; 231: 232-5. doi: 10.1038/new- bio231232a0.
- Blobaum AL, Marnett LJ. Structural and functional basis of cyclooxigenase inhibition. J Med Chem 2007; 50: 1425-41. doi: 10.1021/jm0613166.
- Burke A, Smyth E, FitzGerald GA. Analgesic-Anti- pyretic Agents; Pharmacotherapy of Gout. In Brunton LL, Lazo JS, Parker KL, eds. Goodman & Gilman´s The Pharmacological Basis of Therapeutics 11th ed. New
York: McGraw Hill 2006; pp 671-715.
- Miner J, Hoffhines A. The discovery of aspirin´s antithrombotic effects. Tex Heart Inst J 2007; 34: 179-186.
- Wolfe MM, Lichtenstein DR, Singh G. Gastrointes- tinal toxicity of nonsteroidal antiinflammatory drugs. N Eng J Med 1999; 340: 1888-99. doi: 10.1056/ NEJM199906173402407.
- Dieppe P, Bartlett C, Davey P, et al. Balancing be- nefits and harms: The example of non-steroidal an- ti-inflammatory drugs. Br Med J 2004; 329: 31-4. doi: 10.1136/bmj.329.7456.31.
- Trelle S, Reichenbach S, Wandel S, Hildebrand P, Tschannen B, Villiger PM, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: Network me- ta-analysis. BMJ 2011; 342: c7086. doi: 10.1136/ bmj.c7086.
- Smith WL, DeWitt DL, Garavito RM. Cyclooxigena- ses: Structural, cellular and molecular biology. Annu Rev Biochem 2000; 69: 145-82. doi: 10.1146/annu- rev.biochem.69.1.145.
- FitzGerald GA, Patrono C. The coxibs, selective in- hibitors of cyclooxygenase-2. N Engl J Med 2001; 345: 433-42. doi: 10.1056/NEJM200108093450607.
- Frölich JC. A classification of NSAIDs according to the relative inhibition of cyclooxygenase isoenzymes. Trends Pharmacol Sci 1997; 18: 30-4. doi: 10.1016/ s0165-6147(96)01017-6.
- Marnett LJ, Kalgutkar AS. Cyclooxygenase 2 in- hibitors: Discovery, selectivity and the future. Trends Pharmacol Sci 1999; 20: 465-9. doi:10.1016/ s0165-6147(99)01385-1.
- 2 inhibitors. Nat Rev Drug Discov 2003; 3: 179-
91. doi:10.1038/nrd1034.
- Nasrallah R, Hébert RL. Prostacyclin signaling in the kidney: Implications for health and disease. Am J Physiol (Renal Physiol) 2005; 289: F235-46. doi: 10.1152/ajprenal.00454.2004.
- Nasrallah R, Hassouneh R, Hébert RL. PGE2, Kid- ney disease, and cardiovascular risk: Beyond hyper- tension and diabetes. J Am Soc Nephrol 2016; 27: 666-76. doi: 10.1681/ASN.2015050528.
- Harris RC, Breyer MD. Update on cyclooxygena- se-2 inhibitors. Clin J Am Soc Nephrol 2006; 1: 236-
45. doi: 10.2215/CJN.00890805.
- Patrono C, Baigent C. Nonsteroidal anti-in- flammatory drugs and the heart. Circulation 2014; 129: 907-16. doi: 10.1161/CIRCULATIONA- HA.113.004480.
- Langenbach R, Loftin CD, Lee C, Tiano H. Cy- clooxygenase-deficient mice. A summary of their cha- racteristics and susceptibilities to inflammation and carcinogenesis. Ann N Y Acad Sci 1999; 889: 52-61. doi: 10.1111/j.1749-6632.1999.tb08723.x.
- Caiazzo E, Ialenti A, Cicala C. The relatively se- lective cyclooxygenase-2 inhibitor nimesulide: What’s going on? Eur J Pharmacol 2019; 848: 105-11. doi: 10.1016/j.ejphar.2019.01.044.
- Davies NM, Good RL, Roupe KA, Yáñez JA. Ci- clooxygenase-3: Axiom, dogma, anomaly, enigma or splice error? – not as easy as 1, 2, 3. J Pharm Phar- maceut Sci 2004; 7: 217-26. Erratum in: J Pharm
Pharm Sci 2006; 9: following 433.
- Ortiz MI, Torres-López JE, Castañeda-Hernández G, et al. Pharmacological evidence for the activation of K(+) channels by diclofenac. Eur J Pharmacol 2002; 438: 85-91. doi: 10.1016/s0014-2999(02)01288-
8.
- dos Santos GG, Dias EV, Teixeira JM, Athie MC, Bonet IJ, Tambeli CH, Parada CA. The analgesic effect of dipyrone in peripheral tissue involves two different mechanisms: Neuronal K(ATP) channel opening and CB(1) receptor activation. Eur J Pharmacol. 2014; 741: 124-31. doi: 10.1016/j.ejphar.2014.07.019.
- Tegeder I, Pfeilschifter J, Gleisslinger G. Cyclooxy- genase-independent actions of cyclooxygenase inhi- bitors. FASEB J 2001; 15: 2057-72. doi: 10.1096/
fj.01-0390rev.
- Pacher P, Batkai S, Kunos G. The endocanabinoid system as an emerging target of pharmacotherapy. Pharmacol Rev 2006; 58: 389-462. doi: 10.1124/ pr.58.3.2.
- Graham GG, Scott KF. Mechanisms of action of paracetamol. Am J Ther 2005; 12: 46-55. doi: 10.1097/00045391-200501000-00008.
- Smyth EM, Burke A, FitzGerald GA. Lipid-derived Autacoids: Eicosanoids and Platelet-activated Factor. In Brunton LL, Lazo JS, Parker KL, eds. Goodman & Gilman´s The Pharmacological Basis of Therapeutics 11th ed. New York: McGraw Hill 2006; pp 653-70.
- Minuz P, Fava C, Lechi A. Lipid peroxidation, isoprostanes and vascular damage. Pharmacol Rep 2006; 58 (suppl): 57-68.
- Power I. Aspirin-induced asthma. Br J Anaesth 1993; 71: 619-21. doi: 10.1093/bja/71.5.619.
- Wallace JL, Granger DN. Pathogenesis of NSAID gastropathy: Are neutrophils the culprits? Trends Phar- macol Sci 1992; 13: 129-30. doi: 10.1016/0165-
6147(92)90046-9.
- Christie MJ, Vaughan CW, Ingram SL. Opioids, NSAIDs and 5-lipoxygenase inhibitors act synergistica- lly in brain via arachidonic acid metabolism. Inflamm Res 1999; 48:1-4. doi: 10.1007/s000110050367.
- Yaksh TL. Spinal systems and pain processing: De- velopment of novel analgesic drugs with mechanistica- lly defined models. Trends Pharmacol Sci 1999; 20: 329-37. doi: 10.1016/s0165-6147(99)01370-x.
- Siiskonen H, Harvima I. Mast cells and sensory nerves contribute to neurogenic inflammation and pru- ritus in chronic skin inflammation. Front Cell Neurosci 2019; 13: 422. doi: 10.3389/fncel.2019.00422.
- Lugrin J, Rosenblatt-Velin N, Parapanov R, Liau-
det L. The role of oxidative stress during inflammatory processes. Biol Chem 2014; 395: 203-30. doi: 10.1515/hsz-2013-0241.
- Cook AD, Christensen AD, Tewari D, McMahon SB, Hamilton JA. Immune cytokines and their recep- tors in inflammatory pain. Trends Inmunol 2018; 39: 240-55. doi: 10.1016/j.it.2017.12.003.
- Yamamoto Y, Gaynor RB. Therapeutic potential of inhibition of the NF-kB pathway in the treatment of inflammation and cancer. J Clin Invest 2001; 107: 135-42. doi: 10.1172/JCI11914.
- Frantz B, O’Neill EA. The effect of sodium salicyla- te and aspirin on NF-kappa B. Science 1995; 270: 2017-9. doi: 10.1126/science.270.5244.2017.
- Lehmann JM, Lenhard JM, Oliver BB, Ringold GM, Kliewer SA. Peroxisome proliferator-activated re- ceptors alpha and gamma are activated by indometha- cin and other non-steroidal anti-inflammatory drugs. J Biol Chem 1997; 272: 3406-10. doi: 10.1074/ jbc.272.6.3406.
- Puhl AC, Milton FA, Cvoro A, Sieglaff DH, Cam- pos JC, Bernardes A, et al. Mechanisms of peroxisome proliferator activated receptor g regulation by non-ste- roidal anti-inflammatory drugs. Nucl Recept Signal 2015; 13: e004. doi: 10.1621/nrs.13004.
- Mastbergen SC, Jansen NW, Bijlsma JW, Lafeber FP. Differential direct effects of cyclo-oxygenase-1/2 inhibition on proteoglycan turnover of human osteoar- thritic cartilage: An in vitro study. Arthritis Res Ther 2006; 8: R2. doi: 10.1186/ar1846.
- Manicourt DH, Bevilacqua M, Righini V, Famaey JP, Devogelaer JP. Comparative effect of nimesulide and ibuprofen on the urinary levels of collagen type II C-telopeptide degradation products and on serum levels of hyaluronan and matrix metalloproteinases-3 and -13 in patients with flare-up of osteoarthritis. Drug R D 2005; 6: 261-71. doi: 10.2165/00126839-
200506050-00002.
- Kis B, Snipes JA, Busija DW. Acetaminophen and the cyclooxygenase-3 puzzle: Sorting out facts, fic- tions and uncertainties. J Pharmacol Exp Ther 2005; 315: 1-7. doi: 10.1124/jpet.105.085431.
- Iannantuono R, Devoto FM. Capítulo 6 Farmacolo- gía Clínica. En: Zieher LM, Iannatuono RF, Serra HA, eds. Farmacología General y de la Neurotransmisión 3ra ed. Buenos Aires: Ursino 2003; pp 101-22.
- Non-steroidal anti-inflammatory drugs (NSAIDs). In Aronson JK, Dukes MNG, eds. Meyler´s Side Effects of Drugs. The International Encyclopaedia of Adverse Drug Reactions and Interactions 15th ed. Amsterdam: Elsevier 2006; pp 2555-82.
- Samer CF, Piguet V, Dayer P, Desmeules JA. Poly- morphisme génétique et interactions médicamenteu- ses: leur importance dans le traitement de la douleur. Can J Anaesth 2005; 52: 806-21. doi: 10.1007/ BF03021775.
- Laufer S. Osteoarthritis therapy-are there still un- met needs? Rheumatology 2004; 43 (suppl 1): i9-15. doi: 10.1093/rheumatology/keh103.
- Goldstein JL, Eisen GM, Lewis B, Gralnek IM, Zlotnick S, Fort JG. Video capsule endoscopy to pros- pectively assess small bowel injury with celecoxib, naproxen plus omeprazol, and placebo. Clin Gastroen- terol Hepatol 2005; 3: 133-41.
- Talley JJ. Selective inhibitors of cyclooxygenase-2 (COX-2). Prog Med Chem 1999; 36: 201-34. doi: 10.1016/s0079-6468(08)70048-1.
- Thun MJ, Namboodiri MM, Calle EE, Flanders WD, Heath CW Jr. Aspirin use and risk of fatal cancer. Cancer Res 1993; 53: 1322-7.
- Fujimura T, Ohta T, Oyama K, Miyashita T, Miwa
K. Cyclooxygenase-2 (COX-2) in carcinogenesis and selective COX-2 inhibitors for chemoprevention in gas- trointestinal cancers. J Gastrointest Cancer 2007; 38: 78-82. doi: 10.1007/s12029-008-9035-x.
- Harris RE, Beebe-Donk J, Alshafie GA. Can- cer chemoprevention by cyclooxygenase 2 (COX-2) blockade: Results of case control studies. Subcell
Biochem 2007; 42:193-212. doi: 10.1007/1-4020- 5688-5_9.
- Cerchietti LC, Navigante AH, Peluffo GD, Diament MJ, Stillitani I, Klein SA, Cabalar ME. Effects of cele- coxib, medroxyprogesterone, and dietary intervention on systemic syndromes in patients with advanced lung adenocarcinoma: A pilot study. J Pain Symptom Manage 2004; 27: 85-95. doi: 10.1016/j.jpainsym- man.2003.05.010.
- Bombardier C, Laine L, Reicin A, Shapiro D, Burgos-Vargas R, Davis B, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. VIGOR Study Group. N Engl J Med 2000; 343: 1520-8. 10.1056/ NEJM200011233432103.
- Bresalier RS, Sandler RS, Quan H, Bolognese JA, Oxenius B, Horgan K, et al. Cardiovascular events as- sociated with rofecoxib in a colorectal adenoma che- moprevention trial. N Engl J Med 2005; 352: 1092-
102. doi: 10.1056/NEJMoa050493. Erratum in: N Engl J Med 2006; 355: 221.
- Grosser T, Fries S, FitzGerald GA. Biological basis for the cardiovascular consequences of COX-2 inhibi- tion: Therapeutic challenges and opportunities. J Clin Invest 2006; 116: 4-15. doi: 10.1172/JCI27291.
- Kearny PM, Baigent C, Godwin J, Emberson H, Halls JR, Patrono C. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steriodal anti-inflam- matory drugs increase the risk of atherothrombo- sis? Meta-analysis of randomised trials. BMJ 2006; 332:1302-5. doi: 10.1136/bmj.332.7553.1302.
- Whelton A, Hamilton CW. Nonsteroidal anti-in- flammatory drugs: effects on kidney function. J Clin Pharmacol 1991; 31: 588-98. doi: 10.1002/j.1552- 4604.1991.tb03743.x.
- McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase: A systematic review of the observational studies of selective and nonselecti- ve inhibitors of cyclooxygenase 2. JAMA 2006; 296:
1633-44. doi: 10.1001/jama.296.13.jrv60011.
- Kerr DJ, Dunn JA, Langman MJ, Smith JL, Mid- gley RS, Stanley A, et al. Rofecoxib and cardiovascular adverse events in adjuvant treatment of colorectal can- cer. N Engl J Med 2007; 357: 360-9. doi: 10.1056/ NEJMoa071841.
- O´Connor N, Dargan PI, Jones AL. Hepatoce- llular damage from non-steroidal anti-inflammatory drugs. QJM 2003; 96: 787-91. doi: 10.1093/qjmed/ hcg138.
- Tang W. The metabolism of diclofenac-enzymolo- gy and toxicology perspectives. Curr Drug Metab 2003; 4: 319-29. doi: 10.2174/1389200033489398.
- Antiinflamatorios no esteroides y específicos. En Litter M. Farmacología Experimental y Clínica 7ma ed. Buenos Aires: Editorial El Ateneo 1986; pp 1303-36.
- Heymann MA, Rudolph AM, Silverman NH. Closure of the ductus arteriosus in premature in- fants by inhibition of prostaglandin synthesis. N Engl J Med 1976; 295: 530-3. doi: 10.1056/ NEJM197609022951004.
- McLaren AC. Prophylaxis with indomethacin for heterotopic bone. After open reduction of fractures of the acetabulum. J Bone Joint Surg Am 1990; 72: 245-7.
- Mahony L, Carnero V, Brett C, Heymann MA, Cly- man RI. Prophylactic indomethacin therapy for patient ductus arteriosus in very-low-birth-weight infants. N Engl J Med 1982; 306: 506-10. doi: 10.1056/ NEJM198203043060903.
- Moise KJ Jr, Huhta JC, Sharif DS, Ou CN, Kirshon B, Wasserstrum N, Cano L. Indomethacin in the treat- ment of premature labor. Effects on the fetal ductus arteriosus. N Engl J Med 1988; 319: 327-31. doi: 10.1056/NEJM198808113190602.
- Rodrigues AD. Impact of CYP2C9 genotype on pharmacokinetics: Are all cyclooxygenase inhibitors the same? Drug Metab Dispos 2005; 33: 1567-75. doi: 10.1124/dmd.105.006452.







No comments! Be the first commenter?