Los trastornos epilépticos requieren tratamientos prolongados con fármacos antiepilépticos con mecanismos de acción complementarios. Aunque se han sintetizado fármacos eficaces en el control de este tipo de patologías, el perfil de seguridad de los antiepilépticos limita, en muchos casos, la continuidad del tratamiento. Se estima que un 25% de los pacientes perderán adherencia y, por tanto, eficacia, en el control de las crisis comiciales debido a efec- tos adversos. Dada esta problemática, el 30% de los pacientes tratados con fármacos antiepilépticos desarrollarán formas resistentes de su patología. El brivaracetam fue desarrollado a partir del levetiracetam para dar respuestas a estas falencias del abordaje de pacientes con tales trastornos. En esta reseña, se describen las características claves del brivaracetam.
Scolari MJ. “Actualización en Psiconeurofarmacología: Brivaracetam”. Psicofarmacología 2024;136:25-30. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El tratamiento de los trastornos epilépticos (TE) re- quiere, con frecuencia, el empleo de diferentes fárma- cos antiepilépticos (FAE) con mecanismos de acción complementarios. Fenitoína y fenobarbital, fueron, hace décadas, los pilares del tratamiento a pesar de sus efectos adversos. Se los conoce como FAE de primera generación. A la fecha, suelen ser evitados por su per- fil de seguridad y se los emplea en condiciones refrac-
tarias (1). Luego, fueron desarrollados otros FAE, con mecanismos de acción novedosos, que fueron despla- zando a la fenitoína y fenobarbital gradualmente. Todos con características químicas muy distintas. Entre ellos podemos mencionar: carbamazepina, oxcabazepina, derivados del ácido valproico, gabapentina, pregabali- na, benzodiazepinas, entre otros (2 y 3). Notablemen- te, pregabalina y gabapentina han entrado en desuso como FAE y han encontrado su lugar en terapéutica como coadyuvantes en el manejo del dolor. Las benzo- diazepinas, han demostrado desarrollar tolerancia en el
tratamiento de los TE. Sin embargo, midazolam y Lo- razepam, aún se emplean por vía endovenosa en status dentro de la terapia intensiva. En la figura 1 se muestra la estructura química de LVT y BVT.
Aunque todos los FAE mencionados mostraron algún grado de eficacia en el tratamiento de los TE, se estima que un tercio de los pacientes desarrollan estados resis- tentes al tratamiento (4). Una de las causas principales de este fenómeno, es la falta de adherencia a la terapia debido a efectos adversos. Alrededor del 25% de los pa- cientes bajo tratamiento antiepiléptico lo abandonarán antes de alcanzar la dosis efectiva, con el consecuente aumento de la morbilidad y los costos en salud (5). A la luz de esta problemática, los investigadores centraron sus esfuerzos en el desarrollo de mecanismos de acción innovadores. Uno de ellos fue la inhibición de la glico- proteína vesicular sináptica 2A (GVS2A). Los principa- les representantes de los FAE con este mecanismo son levetiracetam (LVT) y brivaracetam (BVT).
Indicaciones aprobadas
Según la administración nacional de medicamentos, alimentos y tecnología médica (ANMAT), BVT se en- cuentra aprobado para:
Tratamiento de las crisis de inicio parcial en pacien-
tes de 4 años de edad y mayores con epilepsia.
Bases neurocientíficas y mecanismo de acción
Para comprender como BVT ejerce sus efectos te- rapéuticos es necesario repasar el “ciclo de vida” de cualquier neurotransmisor (NT). Luego se su síntesis, el NT es almacenado en vesículas sinápticas a la espera de su liberación. Este proceso esta mediado por glico- proteínas vesiculares. Con la llegada de un potencial de acción excitatorio, la vesícula sináptica cargada de NT migra hacia la membrana neuronal y se funde con ella mediante exocitosis dependiente de calcio (6). De esta forma, el NT se libera a la brecha sináptica para interactuar con los receptores pre y postsinápticos y ser recaptado. Nuevamente dentro de la terminal presináp- tica, el NT es degrado o nuevamente almacenado en la vesícula sináptica.
Sin embargo, dado que la GSV2A se ubica en prác- ticamente todas las neuronas serán excitatorias o no, explicar como LVT y BVT ejercen sus acciones, no es materia sencilla. De modo simplificado, una crisis epi- léptica puede entenderse como un desbalance entre la neurotransmisión excitatoria e inhibitoria. Sea, por exceso de la neurotransmisión excitatoria o defecto de
Figura1
Estructura química del levetiracetam y brivaracetam.
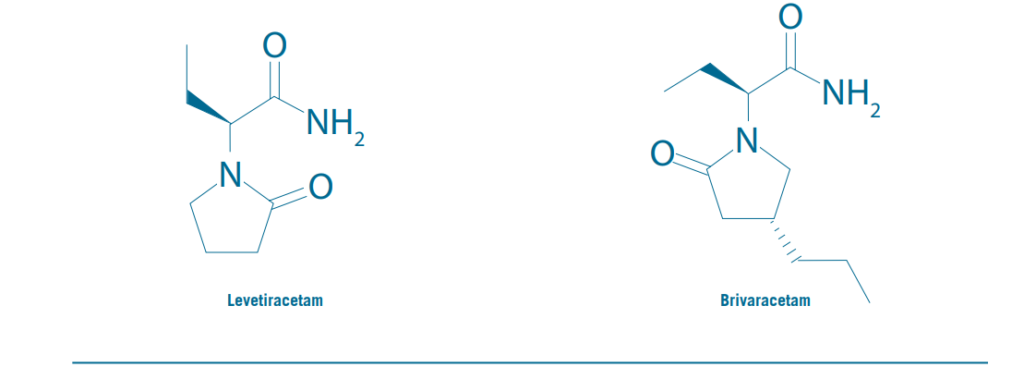
la inhibitoria. De esta forma, LVT y BVT afectarían am- bos tipos de neurotransmisión, aunque nuestro conoci- miento acerca ello es limitado. Ohno y colaboradores
(7) observaron, en modelos animales de epilepsia, un incremento de GSV2A en interneuronas gabaérgicas del giro dentado, sin alteraciones en hipocampo. Sugi- riendo una sobreexpresión región-específica. Más aún, GSV2A mostraría cambios temporales de expresión en neuronas glutamatérgicas (excitatorias) y gabaérgicas (inhibitorias) del hipocampo, durante la crisis epilépti- ca (8). Estos hallazgos, ponen de manifiesto la intrinca- da relación entre la densidad de expresión de GSV2A y la evolución de la crisis.
Se sugiere que LVT disminuye la liberación presináp- tica de NT, mediante la unión a GSV2A. De hecho, la exposición prolongada a LVT reduce la tasa de libera- ción de vesículas presinápticas (9). LVT reduciría la exocitosis mediada por calcio con la consecuente dis- minución de la neurotransmisión, siendo la excitatoria la que posee mayor sensibilidad a sus efectos (10). El mecanismo de acción del BVT sería idéntico al del LVT, con la diferencia de que ha demostrado mayor afinidad por GSV2A que éste último (11). De hecho, BVT es el primer congénere del LVT, llamados en conjunto como racetames.
BVT muestra un perfil farmacocinético favorable con una cinética lineal y predecible con una biodisponibi- lidad cercana al 100%. Su absorción no es afectada por las comidas, incluyendo aquellas con alto contenido graso. Se une escasamente a proteínas plasmáticas con una vida media de eliminación de aproximadamente 9 horas. Se elimina fundamentalmente por vía hepática por metabolismo hidrolítico dando un metabolito áci- do. Posee una vía secundaria de metabolización, vía CYP2C19, originando un metabolito hidroxilado. Los metabolitos del BVT son farmacológicamente inactivos. BVT se excreta totalmente por orina (8 a 11% inaltera- do). (12). Estas características sugieren que la dosis de BVT debería ser disminuida en pacientes con falla he- pática, pero no serían necesarios ajustes en pacientes con insuficiencia renal (13, 14).
En Argentina, BVT está disponible en comprimidos (25, 50 y 100mg), solución oral (10mg/ml por 300ml) y ampolla inyectable (10mg/ml por 5 ml).
En la tabla 1 se muestras las características compara- tivas entre LVT y BVT.
Experiencia clínica
En 2021, Lattanzi y colaboradores realizaron el estu- dio BRIVAFIRST (15). El mismo tuvo un diseño retros- pectivo y multicéntrico, con un período de seguimiento de 12 meses sobre pacientes con epilepsia focal re- sistente, a los cuales se les agregó BVT a su terapia. Los desenlaces principales fueron: ausencia de crisis, respuesta de las crisis (reducción de al menos el 50% en la frecuencia de crisis) y abandono del tratamiento. Los autores tuvieron en cuenta el uso previo de LVT y el abandono previo por efectos adversos. Se incluye- ron 1029 pacientes con una mediana de edad de 45 años y 47,3% de sexo masculino. Los FAE mayormen- te empleados por los pacientes fueron carbamazepina, ácido valproico, lacosamida, fenobarbital, lamotrigina, perampanel y benzodiazepinas. Se observó una tasa de ausencia de crisis del 22,3% en pacientes que no habían usado LVT previamente y de 7,1% en aquellos que habían empleado este FAE y habían abandonado el tratamiento por falta de eficacia. En aquellos pacientes que habían discontinuado el tratamiento por efectos ad- versos (con uso de LVT), la tasa de ausencia de crisis fue del 31,2%. La respuesta de estos grupos de pacien- tes a las crisis fue del 47,9%, 29,7% y 42,8%, res- pectivamente. Notablemente, 25,8% de los pacientes discontinuaron la terapia con BVT. Los efectos adversos mayormente detectados fueron: somnolencia, agitación/ nerviosismo, vértigo, fatiga y cefalea. La mayoría de es- tos (75,4%) fueron considerados leves. La prevalencia de reacciones adversas fue superior en aquellos pacien- tes que no habían empleado previamente LVT.
En 2023, Roberti y colaboradores (16) llevaron a cabo el estudio COMPARE en el cual compararon la efi- cacia y seguridad de BVT, lacosamida, eslicarbazepina y perampanel como FAE agregado a la terapia. El diseño fue retrospectivo y multicéntrico. Se realizó entre 2018 y 2021 en instituciones italianas. Se incluyeron 960 pacientes de los cuales 52,9% eran de sexo femenino. La mediana de edad de la muestra fue de 43 años. Notablemente, en comparación con lacosamida, todos los FAE estudiamos mostraron mayor riesgo de aban- dono. Siendo éste significativo para los pacientes que recibieron BVT sin haber recibido LVT y perampanel. En
términos de eficacia BVT mostró odds ratios menores en comparación con otros FAE. Sin embargo, los au- tores observaron una eficacia significativamente mayor en mujeres que no habían recibido LVT previamente, en comparación con hombres de tratamiento similar. Los principales efectos adversos detectados en la rama BVT sin LVT previo fueron: irritabilidad (20,4%), somnolencia (20,4%), agitación (13,0%) y fatiga (7,4%). En la rama
BVT con LVT previo, el perfil de seguridad fue similar, aunque se observó un incremento en la agresividad del 5,6% al 14,3%.
Efectos neurocognitivos de los fármacos antiepilépticos
Aun son varios los factores que pueden afectas las
Tabla 1
Características generales comparadas del levetiracetam y brivaracetam.
| Variable | Levetiracetam | Brivaracetam |
| Mecanismo de acción más pro- bable | Inhibición de GSV2A | Inhibición de GSV2A (alta afinidad) |
| Presentaciones en Argentina | Comprimidos: 500 y 1000mg. Solución oral: 100mg/ml por 300ml. Ampolla inyectable: 100mg/ml por 5ml. | Comprimidos: 25, 50 y 100mg. Solución oral: 10mg/ml por 300ml. Ampolla inyectable: 10mg/ml por 5ml. |
| Perfil farmacocinético | Lineal | Lineal |
| Biodisponibilidad | Cercana al 100% | Cercana al 100% |
| Vida media | 7 horas | 9 horas |
| Unión a proteínas | Baja (10%) | Baja (17,5%) |
| Metabolismo | Fundamentalmente hidrolítico | Hidrolítico CYP2C19 |
| Excreción | Urinaria (66% inalterado) | Urinaria (11% inalterado) |
funciones neurocognitivas como, la atención, la memo- ria, lectura, entendimiento y otras, los FAE forman parte de las causas modificables. Los FAE que modifican la función gabaérgica parecerían estar mayormente aso- ciados a estos disturbios en comparación con los FAE que afectas los canales iónicos (17). Sin embargo, no es sencillo realizar una generalización basada en me- canismos de acción, dado que varios FAE posee meca- nismos de acción múltiples. Por otro lado, los niños y adolescentes serían más susceptibles que los adultos a estos efectos indeseados. En este contexto, Besag y Vasey (18) realizaron una revisión sobre los efectos neurocognitivos de los FAE. Los autores destacan que LVT no presentaría mayores alteraciones neurocogniti-
vas negativas, excepto en ciertos infantes que podrían presentar disturbios en el desarrollo motor y cognitivo con la exposición prolongada a LVT. La evidencia sobre BVT es escasa dado que es un FAE, aún, nuevo en el mercado (aprobado en 2016 por la Food and Drugs Ad- ministration). Sin embargo, el perfil de seguridad sería similar al de su precursor: LVT.
Notablemente, la base de datos de la Organización Mundial de la Salud, vigiaccess, registra 53.676 even- tos adversos para el LVT y 4.690 para el BVT (19). En la tabla 2, se detallan los porcentajes de los trastornos neuropsiquiátricos mayormente asociados a estos FAE.
Tabla 2
Eventos adversos neuropsiquiátricos más frecuentes, reportados en vigiaccess para levetiracetam y brivaracetam.
| Evento adverso Levetiracetam (%) Brivaracetam (%) | ||
| Somnolencia | 5,3 | 6,1 |
| Mareos | 3,9 | 6,0 |
| Agresividad | 3,5 | 4,6 |
| Cefalea | 3,1 | 3,4 |
| Irritabilidad | 2,9 | 4,6 |
| Ansiedad | 1,9 | 3,4 |
| Alteraciones en la memoria | 1,4 | 2,4 |
Comentarios finales
La atención centrada en el paciente y la búsqueda de moléculas eficaces con el mejor perfil de seguridad po- sible, debe ser la meta de los investigados y el personal asistencial. El surgimiento del LVT y BVT fue motivado por la falta de respuesta al tratamiento de los TE y por el perfil de seguridad de los FAE predecesores. Aún no
queda claro si estas moléculas marcan un “punto de llegada” en el abordaje de los TE, pero sí que han apor- tado un mecanismo de acción novedoso con un perfil de seguridad aparentemente aceptable. La experiencia venidera aportará datos sobre las diferencias entre LVT y BVT más allá de la afinidad de unión a GSV2A, dado que la evidencia revisada no sería del todo contundente en este aspecto.
Referencias bibliográficas
- 1. Taylor S, Tudur Smith C, Williamson PR, Marson AG. Phenobarbitone versus phenytoin monotherapy for partial onset seizures and ge- neralized onset tonic-clonic seizures. Cochra- ne Database Syst Rev. 2001;(4):CD002217. doi: 10.1002/14651858.CD002217.
- 2. Shorvon SD. Drug treatment of epi- lepsy in the century of the ILAE: the first 50 years, 1909-1958. Epilepsia. 2009 Mar;50 Suppl 3:69-92. doi: 10.1111/j.1528- 1167.2009.02041.x.
- 3. Shorvon SD. Drug treatment of epilepsy in the century of the ILAE: the second 50 years, 1959-2009. Epilepsia. 2009 Mar;50 Suppl 3:93-130. doi: 10.1111/j.1528- 1167.2009.02042.x.
- 4. Berg AT. Identification of pharma- coresistant epilepsy. Neurol Clin. 2009 Nov;27(4):1003-1013. doi: 10.1016/j. ncl.2009.06.001.
- 5. Perucca P, Gilliam FG. Adverse effects of antiepileptic drugs. Lancet Neurol. 2012 Sep;11(9):792-802. doi: 10.1016/S1474- 4422(12)70153-9.
- 6. Rossi R, Arjmand S, Bærentzen SL, Gjedde A, Landau AM. Synaptic Vesicle Gly- coprotein 2A: Features and Functions. Front Neurosci. 2022 Apr 28;16:864514. doi: 10.3389/fnins.2022.864514.
- 7. Ohno Y, Ishihara S, Terada R, Kikuta M, Sofue N, Kawai Y, Serikawa T, Sasa M. Preferential increase in the hippocampal sy- naptic vesicle protein 2A (SV2A) by pentyle- netetrazole kindling. Biochem Biophys Res Commun. 2009 Dec 18;390(3):415-20. doi: 10.1016/j.bbrc.2009.09.035.
- 8. Contreras-García IJ, Pichardo-Macías LA, Santana-Gómez CE, Sánchez-Huerta K, Ramírez-Hernández R, Gómez-González B, et al. Differential expression of synaptic vesicle protein 2A after status epilepticus and du- ring epilepsy in a lithium-pilocarpine model. Epilepsy Behav. 2018 Nov;88:283-294. doi: 10.1016/j.yebeh.2018.08.023.
- 9. Yang XF, Weisenfeld A, Rothman SM. Prolonged exposure to levetiracetam reveals a presynaptic effect on neurotransmission. Epilepsia. 2007 Oct;48(10):1861-9. doi: 10.1111/j.1528-1167.2006.01132.x.
- 10. Harada S, Tanaka S, Takahashi Y, Mat sumura H, Shimamoto C, Nakano T, et al. Inhi- bition of Ca(2+)-regulated exocytosis by leveti- racetam, a ligand for SV2A, in antral mucous cells of guinea pigs. Eur J Pharmacol. 2013 Dec 5;721(1-3):185-92. doi: 10.1016/j.
ejphar.2013.09.037.
- 11. Mumoli L, Palleria C, Gasparini S, Citra- ro R, Labate A, Ferlazzo E, et al. Brivaracetam: review of its pharmacology and potential use as adjunctive therapy in patients with partial onset seizures. Drug Des Devel Ther. 2015 Oct 19;9:5719-25. doi: 10.2147/DDDT.S81474.
- 12. Rolan P, Sargentini-Maier ML, Pigeo- let E, Stockis A. The pharmacokinetics, CNS pharmacodynamics and adverse event profile of brivaracetam after multiple increasing oral doses in healthy men. Br J Clin Pharmacol. 2008 Jul;66(1):71-5. doi: 10.1111/j.1365-
2125.2008.03158.x.
- 13. Sargentini-Maier ML, Sokalski A, Bou- langer P, Jacobs T, Stockis A. Brivaracetam disposition in renal impairment. J Clin Phar- macol. 2012 Dec;52(12):1927-33. doi: 10.1177/0091270011431457.
- 14. Stockis A, Sargentini-Maier ML, Hors- mans Y. Brivaracetam disposition in mild to severe hepatic impairment. J Clin Pharma- col. 2013 Jun;53(6):633-41. doi: 10.1002/
jcph.82.
- 15. Lattanzi S, Canafoglia L, Canevini MP, Casciato S, Chiesa V, Dainese F, et al. Ad- junctive Brivaracetam in Focal Epilepsy: Re- al-World Evidence from the BRIVAracetam add-on First Italian netwoRk STudy (BRIVA- FIRST). CNS Drugs. 2021 Dec;35(12):1289- 1301. doi: 10.1007/s40263-021-00856-3.
- 16. Roberti R, Di Gennaro G, Anzellotti F, Arnaldi D, Belcastro V, Beretta S, et al. A real-world comparison among third-ge- neration antiseizure medications: Re- sults from the COMPARE study. Epilepsia. 2024 Feb;65(2):456-472. doi: 10.1111/ epi.17843.
- 17. Ijff DM, Aldenkamp AP. Cognitive si- de-effects of antiepileptic drugs in children. Handb Clin Neurol. 2013;111:707-18. doi: 10.1016/B978-0-444-52891-9.00073-7.
- 18. Besag FMC, Vasey MJ. Neurocognitive Effects of Antiseizure Medications in Chil- dren and Adolescents with Epilepsy. Pae- diatr Drugs. 2021 May;23(3):253-286. doi: 10.1007/s40272-021-00448-0.
- 19. Organización Mundial de la Salud. Vi- giaccess. Disponible en: www.vigiaccess.org Búsqueda brivaracetam y levetiracetam. Con- sultado: 26-02-2024.







No comments! Be the first commenter?