El sueño es un fenómeno fisiológico esencial para la homeostasis y el mantenimiento de la salud de los seres humanos. Ocupa un tercio de nuestras vidas y en élse producen múltiples fenómenos corporales y se consolidan funciones intelectuales como el aprendizaje y la memoria.
Conforme los individuos envejecen, la cantidad y calidad del sueño suelen alterarse incrementándose el tiempo de vigilia, disminuyendo el sueño profundo y todo ello puede causar mayor somnolencia diurna y descenso del nivel de alerta.
La demencia es un síndrome cognitivo – comportamental en el cual hay un deterioro generalmente lento y progresivo de diversas funciones mentales superiores.
La demencia más prevalente es la enfermedad de Alzheimer y su incidencia aumenta conforme pasa el tiempo, los factores de riesgo son multifactoriales pero la edad es el más frecuente.
Los síntomas principales pueden dividirse en cognitivos, conductuales y cronobiológicos.
Dentro de las alteraciones cronobiológicas, la disfunción del sueño es muy común que incluyen el insomnio, la somnolencia diurna, el sueño fragmentado y el fenómeno de agitación vesperal o sundowning.
El sueño en la enfermedad de Alzheimer se evalúa mediante la anamnesisal paciente, los familiares y cuidadores. También se dispones de escalas para medir el grado de somnolencia y la sobrecarga que genera para los cuidadores.
Los tratamientos incluyen terapia con luz brillante, uso de cronobióticos como melatonina y en casos seleccionados la farma- coterapia. La higiene del sueño siempre es fundamental y se adecua a las necesidades de cada individuo afectado.
Palabras clave
Sueño normal – Demencia – Enfermedad de Alzheimer – Sueño en la demencia – Tratamiento.
Samperisi G. “Alteraciones del sueño en la enfermedad de Alzheimer”. Psicofarmacología 2023;134:24-30. Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
El sueño es un estado fisiológico y conductual que tiene como características fundamentales ser rítmico, activo, heterogéneo, reversible y que cursa con una disminución de la actividad mo- tora y en algunos aspectos cierta inmovilidad y relajación mus- cular (Sarubbo et al., 2018) (Harrington J, et al., 2012).
El dormir ocupa un tercio de nuestras vidas por tanto un adulto de 40 años ha pasado aproximadamente 12 años en ese programa fisiológico el cual es clave para mantener la homeostasis y la salud en general.
El sueño se divide, desde el punto de vista fisiológico y con- ductual, en dos etapas, sueño NREM o de movimientos ocula- res no rápidos y sueño REM (con movimientos oculares rápidos) o paradojal por su semejanza con la vigilia (Cardinali, 2007).
El tiempo total del sueño NREM es de un 75% y el sueño REM representa el 25% restante.
En la Figura 1 se detallan estas etapas.
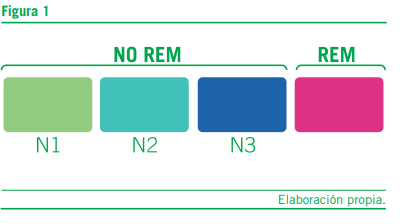
El sueño NOREM que es reparador y en el que se desarro- llan diferentes cambios homeostáticos, consta de tres etapas de creciente profundidad, desde la N1 con somnolencia leve hasta la N3 de sueño profundo. En esta etapa se facilita la memoria declarativa o explícita.
El sueño REM le sigue a continuación y en el también acon- tecen variaciones fisiológicas clave y se da con mayor intensi- dad la actividad onírica y aparecen los clásicos ensueños. En cuanto a las funciones intelectuales, durante esta etapa del sueño, se facilita la memoria de procedimiento y la memoria semántica (España RA et al., 2011).
Con el paso del tiempo, la arquitectura del sueño se va mo- dificando y, en las personas mayores, comienzan a perder el sueño lento y aumenta la cantidad de tiempo ligero o superfi- cial. La latencia (tiempo que tarda un individuo en dormir) se incrementa (Phillips B, Ancoli-Israel S, 2000).
En las personas mayores los cambios fisiológicos y de los ritmos circadianos hacen que los patrones del sueño se modi- fiquen y el impacto diurno sea más evidente (menor nivel de alerta durante el día, somnolencia diurna, riesgo incrementa- do de caídas y necesidad de mayores siestas durante la vigi- lia). (Chokroverty S, 2009).
Definiendo la demencia
La demencia se puede definir como un síndrome de deterio- ro global cognitivo- comportamental, adquirido, degenerativo (en la mayoría de los casos), multi-etiológico y progresivo, que va a repercutir en la vida laboral, familiar y social de la perso- na (Acosta et al., 2012).
Se define como síndrome ya que las causas son diversas, adquirido porque lo diferencia del déficit intelectual y progre- sivo ya que la declinación cognoscitiva empeora con el paso del tiempo.
Dentro de las patologías neuropsiquiátricas ligadas al enveje- cimiento, las demencias y la enfermedad de Alzheimer en espe- cial (EA) es la de mayor prevalencia y afecta múltiples aspectos de la vida de la persona que la padece (Lyketsos C, 2009).
Epidemiologia de la EA
La enfermedad de Alzheimer, es la causa más común de demencia en general y la más frecuente entre los deterioros cognitivos de causa degenerativa.
Su incidencia aumenta con la edad y se va duplicando cada 5 años después de los 65 años (Garre-Olmo J, 2018).
El número aproximado de personas viviendo con demencia es de 55 millones en 2019. Se calcula que aumentara a 139 millones en 2050 de acuerdo a los cálculos más recientes de la Organización Mundial de la Salud (Alzheimer´s Disease International, 2022).
Factores de riesgo para la demencia y la EA
En el año 2020 se publicó un artículo muy interesante en Lancet en el cual se daba cuenta de los factores de riesgo (FR) más importantes para demencia. Lo interesante de esta publicación es que los FR modificables, a nivel global, eran de un 40% versus un 60% de los no modificables. Un dato de sumo interés para nuestra región (Latinoamérica) es que los FR modificables se elevaban a un 56%.
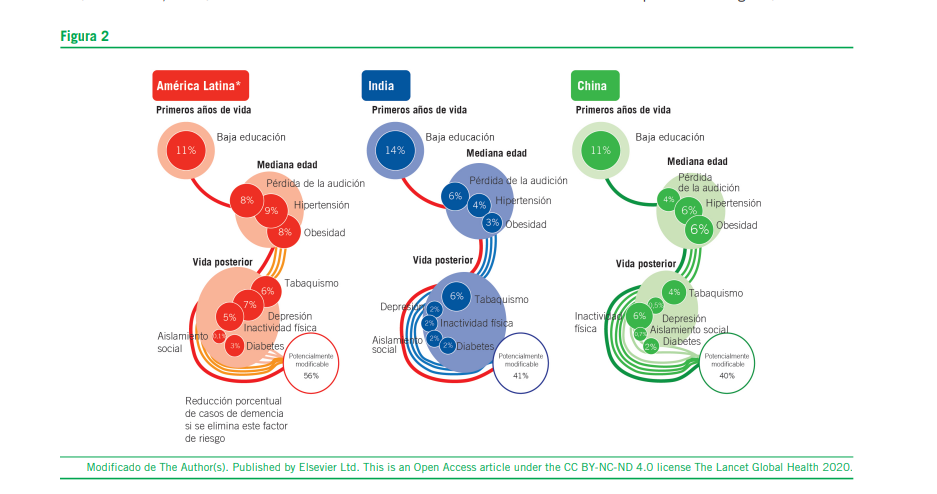
En el listado de estos factores de riesgo es clave resaltar:
- Pobre educación
- Pérdida auditiva
- Hipertensión arterial
- Obesidad
- Tabaquismo
- Depresión
- Inactividad física
- Aislamiento social
- Diabetes
Lo interesante de estos datos es que podemos extrapolarlos, en parte, a los trastornos del sueño y muchos de ellos impac- tan negativamente en la calidad y eficiencia del mismo, tanto en la salud como en la enfermedad como por ejemplo la EA.
Manifestaciones clínicas de la enfermedad de Alzheimer
Si bien la fenomenología de esta condición neuropsiquiá- trica puede ser amplia los rasgos distintivos más frecuentes se pueden agrupar en tres grandes apartados: (Taragano F, 2019) (Cardinali D, 2007) (Brusco L, 2012)
- Cognitivos
- Conductuales
- Cronobiológicos.
La sintomatología cognitiva incluye, alteraciones de la me- moria episódica anterógrada, disfunciones del lenguaje del tipo anomias, trastornos de las praxias y las gnosias, desorien- tación temporal y espacial, disfunción ejecutiva.
La semiología conductual incluye, apatía, elementos depre- sivos, agitación, trastornos de la personalidad, ideación deli- rante, ocasional comportamiento agresivo e irritabilidad.
Las alteraciones cronobiológicas son las que más nos inte- resan atendiendo a los fines de este artículo y sus manifesta- ciones más frecuentes son:
Alteraciones de la temperatura corporal, secreción de hor- monas y especialmente del ritmo sueño-vigilia.
En el presente artículo vamos a ahondar en las alteraciones cronobiológicas presentes en esta enfermedad y dentro de las ritmopatías, los trastornos del sueño en particular.
Alteraciones del sueño en la enfermedad de Alzheimer
Los trastornos del sueño son todos los problemas relaciona- dos con el dormir.
Estos incluyen la dificultad para el inicio o el mantenimien-
to del sueño, tener somnolencia excesiva durante el día, que- darse dormido en situaciones inapropiadas, alteraciones del ritmo sueño-vigilia y presentar conductas anormales durante el periodo de sueño (National Health Institute).
¿Cómo es el sueño en el adulto mayor?
Durante el envejecimiento hay cambios en el patrón de sue- ño tanto en calidad como en cantidad del mismo. Las altera- ciones más comunes incluyen:
- Reducción total del tiempo de sueño.
- El sueño de ondas lentas (NREM especialmente fase 3) es más corto.
- Aumenta el tiempo de sueño superficial.
- Latencia aumentada del primer sueño REM.
- Insomnio (despertares frecuentes y sueño fragmentado).
- Síndrome de fase adelantada del sueño (las personas sue- len dormirse más temprano).
- Trastorno de conducta del sueño REM, es una parasom- nia en la cual la atonía fisiológica que acompaña a esta etapa del sueño se ve alterada y por tanto la persona experimenta una inusitada actividad motora durante la ensoñación la cual puede manifestarse desde movimientos simples hasta lanzar patadas o golpes de puño (Chokroverty, 2011) (Miranda JL, et al., 2015).
Todos estos cambios en la arquitectura del sueño tienen un impacto variable en las personas afectadas y pueden aumen- tar la susceptibilidad a padecer diferentes patologías.
En el tema que nos ocupa aumentan las posibilidades de la institucionalización de los pacientes (Rochelle E, et al., 2006). Se alteran las capacidades intelectuales de las personas, ya que la somnolencia diurna excesiva limita la capacidad
atencional (Oludamilola Salami, et al., 2011).
Por último, al estar disminuido el sueño, tanto en su fase REM como NREM (de ondas lentas) se perturban las capaci- dades restaurativas del mismo y la consolidación de la memo- ria (Kandel E, Schwartz J, Jessell T. 2001).
Fisiopatología
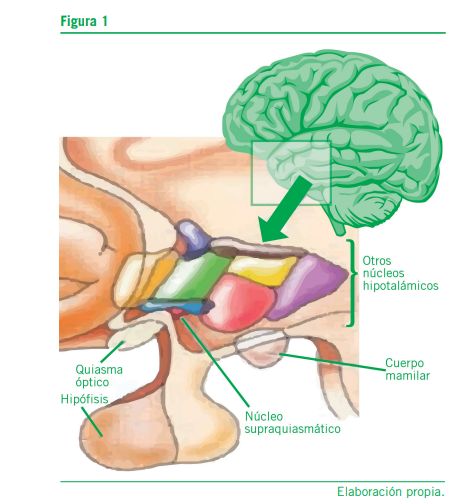
En el ser humano existe una compleja red interconectada y centros nerviosos encargados de la regulación de los ritmos sueño-vigilia.
En el zona anterior del hipotálamo se encuentran los cen- tros reguladores del sueño y del ritmo circadiano. Otras regio- nes del sistema nervioso involucradas son el sistema reticular activador ascendente, el núcleo supraquiasmático (es consi- derado el reloj endógeno principal que regula estos ritmos), la protuberancia anular y la glándula pineal (Fuller P, et al., 2006).
En la Figura 3 se exponen estas estructuras anatómicas.
La melatonina, hormona reguladora por excelencia del sue- ño, se produce en la glándula pineal y su concentración au- menta considerablemente en la noche cuando disminuye la luz (Cipolla-Neto J, et al., 2018).
La acetilcolina es un neurotransmisor con múltiples fun- ciones como por ejemplo, regulación de la actividad cerebral general durante el estado de alerta y en los ciclos de sueño y vigilia. También se ha implicado en los procesos de memoria y asociación (Bear M, Connors B, Paradiso M, 2016) (Flores Soto M, Segura Torres J, 2005).
En el caso de la demencia, los trastornos del sueño suelen ser marcadores de neurodegeneración de las vías y circuitos nerviosos que regulan los ritmos sueño-vigilia y la arquitectura del sueño (Rose KM, Lorentz R. 2010).
En la EA, la perdida de inervación colinérgica en zonas mesiales del lóbulo temporal como el hipocampo y el córtex entorrinal, son sucesos muy importantes que explican, en par-
Figura 1
Elaboración propia.
te, la afectación de la memoria declarativa. Esta hipofunción colinérgica contribuye al déficit mnesico y del sueño en esta enfermedad (Wenk G, 2003).
Se conoce que la disfunción de los ritmos circadianos que acontecen en la EA, se debe a pérdida neuronal progresiva en el núcleo supraquiasmático del hipotálamo (Mc Curry SM et al., 2003).
Principales alteraciones del sueño en per- sonas con enfermedad de Alzheimer
Las alteraciones del sueño en la EA afectan aproximada- mente al 40% de las personas que sufren esta condición lo cual causa una importante disfunción psicofísica en el pa- ciente y los cuidadores (Brusco L, Olivar N, 2021).
La presentación clínica es variada y las más frecuentes se citan a continuación: (Agüera Ortiz L, Martin Carrasco M, Sánchez Pérez M, 2021), (Alberca R, López Pousa S, 2011).
- Sueño fragmentado
- Tiempo total de sueño disminuido
- Despertares frecuentes
- Insomnio
- Somnolencia diurna excesiva
- Alteraciones del ritmo circadiano (avance de fase del sueño)
- Fenómeno de agitación vesperal (sundowning)
Si bien los diferentes trastornos del sueño asociados a la EA son heterogéneos, tienen en general como denominador común un sueño poco eficiente, de mala calidad y cantidad e impacto tanto nocturno como diurno.
Las alteraciones del sueño en personas afectada por esta patología no difieren demasiado a lo observado en adultos ma- yores sin demencia (Gabelle A, Dauvilliers Y, 2010).
El insomnio es una causa frecuente de disfunción del sueño en la demencia, la fragmentación del sueño, los despertares frecuentes y la reducción del tiempo total del mismo, contribuyen a la mayor necesidad de siestas diurnas, empeoramiento del enlentecimiento cognitivo y riesgo asociado de accidentes (caídas) y sobrecarga del cuidador (Vitiello MV, Borson S,
Tabla 1
| Escala | Parámetro que evalúa |
| Epworth Sleepiness Scale (Johns MB, et al., 1991) | Mide el nivel de somnolencia diurna con un puntaje desde 0 a 24 puntos. Siendo 11 el punto de corte, por encima de este valor debe estudiarse con detalle para determinar la causa. |
| Sleep Disorder Inventory (Tracten- berg R, et al., 2003) | Determina la frecuencia, severidad y sobrecarga del cuidador de una persona con demencia tipo Alzheimer y trastornos del sueño. Esta escala determina como ha sido el sueño en el período previo a su administración. |
| Stanford Sleepiness Scale (Hoddes E, Dement W, Zarcone V, 1972) | Instrumento de 7 ítems que evalúa la somnolencia subjetiva. |
| Pittsburgh Sleep Quality Index (Buysse D, et al., 1989) | Evalúa 19 aspectos vinculados al sueño en el último mes, desde la menor a mayor dificultad para dormir. |
2001) (Bhatt MH, Podder N, Chokroverty S, 2005).
Un síntoma disruptivo y generador de múltiples complica- ciones en el sueño y la esfera conductual de las personas con EA es el fenómeno de agitación vesperal, síndrome del ocaso o “sundowning”.
La agitación vesperal es la exacerbación que generalmente ocurre al atardecer o por las noches, de sintomatología con- ductual, la cual altera el sueño nocturno (Boronat A, Ferrei- ra-Maia AP, Yuang-Pang W, 2019).
Esta disfunción, que engloba problemas de sueño, conduc- tuales y cronobiológicos, se manifiesta por: (Zhou et al., 2012)
- Desorientación témporo-espacial y confusión.
- Agitación, ansiedad excesiva y conductas motoras erráti- cas y sin sentido.
- Automatismos como vocalizaciones prolongadas y sin sentido.
- Disfunciones sensoperceptivas (alucinaciones, especial- mente visuales).
La terapéutica de estas disfunciones del sueño es complejo y desafiante y se abordaran, sus aspectos básicos, en el apar- tado de tratamiento.
Abordaje diagnóstico
Las personas afectadas de demencia y enfermedad de Al- zheimer en especial, tienen muy frecuentemente trastornos del sueño como parte de su cuadro clínico.
No existe un protocolo diagnóstico universalmente acepta- do y se requiere un enfoque general e individualizado depen-
Tabla 2

diendo de otros cuadros clínicos generales que pueda tener la persona.
En el caso de la demencia, además de la evaluación del paciente, es clave la entrevista con los familiares y cuidadores (Gil Gregorio P, 2010) (Blazer D, Steffens D, 2010) (Boland R, Verduin M, 2022).
En la evaluación general se debe incluir un examen clínico y neuropsiquiátrico, determinar el uso de fármacos o tóxicos que interfieran en el sueño, exámenes de laboratorio según sospecha clínica, escalas de cribado para alteraciones del sueño y, en casos particulares, estudios específicos de sueño como actigrafía, polisomnografia y otros (Yesavage J, et al. 2003) (Chokroverty S, 2009).
Las escalas más usualmente utilizadas para cribado de sue- ño en general y que también se aplican en la demencia son las que muestra la Tabla 1.
Enfoque terapéutico
El tratamiento de desórdenes neuropsiquiátricos como la enfermedad de Alzheimer es complejo y las disfunciones del sueño no escapan a esta dificultad.
Es clave tener en mente la comorbilidad, que en este grupo etario es muy frecuente, y la farmacoterapia para otros cua- dros clínicos generales que pueda estar cursando el paciente. En el manejo de los trastornos del sueño en la EA existen tres enfoques que son los que cuentan con mayor respaldo, ellos
son: (Peter-Derex L, Yammine P, Bastuji H, Croisile B, 2015)
- Medidas higiénicas del sueño
- Terapia de luz brillante (TLB)
- Melatonina
La Tabla 2 detalla los puntos centrales de la higiene del sueño.
Cada una de estas recomendaciones debe adaptarse al en- torno de la persona, ya sea su domicilio o una institución de cuidados especializada.
La terapia de luz brillante (TLB)
La luz juega un rol clave en la regulación de diversos ritmos como la temperatura corporal central, el ciclo circadiano de actividad y reposo y la melatonina entre otros (Wu YH, Swaab DF, 2007).
El núcleo supraquiasmático (NSQ) del hipotálamo, que recibe información lumínica por el haz retinohipotalámico, es considerado el “reloj maestro” que sincroniza los ritmos cronobiológicos de todos los relojes biológicos. La injuria es- tructural del sistema nervioso central, que causa la EA, altera los distintos patrones circadianos y por tanto los ritmos sue- ño –vigilia se ven alterados en su sincronización (Roccaro I,
Smirni D, 2020).
La TLB consiste en la exposición lumínica, a una intensidad que varía entre 2500 a 10000 Lux (lux es la cantidad de nivel luminoso que se proyecta en una superficie) en un lapso de tiempo que varía entre 30 minutos y hasta 2 horas por día (Mishima K, Okawa M, Hozumi S, Hishikawa Y, 2000).
La TLB es un tratamiento útil pese a que varios estudios realizados sobre su eficacia no son randomizados. Pese a ello se recomienda como una terapéutica a implementar en los trastornos del sueño en la EA y otras demencias (Jun Song Isaac Tan et al., 2022).
Melatonina
La melatonina es un cronobiótico, citoprotector, inmunomo- dulador y antioxidante (entre muchas otras funciones) amplia- mente distribuido en el ser humano y otras especies (Hardeland et al., 20119) (Cardinali D, Scacchi Bernasconi P, 2010).
Su uso, en los trastornos del sueño en la EA, ha resultado eficaz especialmente en el tratamiento del “sundowning” o agitación vesperal. Diversos autores hallaron mejorías signifi- cativas en la regulación de los ritmos sueño vigilia en adultos mayores con demencia (Cardinali et al., 2002) (Cohen- Mans- field et al., 2000).
La dosis usual varía entre 3 a 9 mg/día con buena tolerancia y escasos efectos adversos comparados con placebo (Brusco L et al., 1998).
Otras estrategias farmacológicas
El uso de neuropsicofármacos, para el tratamiento de los tras- tornos del sueño en la EA, debe ser evaluado con detalle, indi- cado y supervisado por especialistas con amplios conocimien- tos básicos y clínicos de la farmacología del sistema nervioso central, de la enfermedad de Alzheimer y otras demencias.
Los agonistas gabaérgicos (benzodiacepinas, zolpidem, zaleplon, zopiclona, eszopiclona y otros) se usan frecuentemente (especialmente en el insomnio) pero sus efectos colaterales (se- dación, somnolencia diurna, amnesia anterógrada, ocasionales efectos paradojales e insomnio de rebote) limitan su uso en la población adulta mayor con demencia (Profenno L, et al., 2004). Otro medicamento como trazodona (un antagonista de re- ceptores subtipo 2 de serotonina y agonista parcial de recep- tores de serotonina 1A) resulta parcialmente útil y no está exento de eventos adversos complicados, especialmente seda-
ción excesiva e hipotensión ortostática (Jufe G, 2017). Mirtazapina, un bloqueante multirreceptorial con efecto se-
dativo, se ha ensayado en dosis bajas (15 mg/día) (Wiegand M, et al., 2008).
Finalmente los fármacos bloqueantes dopaminérgicos, an- tagonistas dopaminérgicos y serotoninérgicos (antipsicóticos de 1°, 2° y 3° generación) no están exentos de controversias y complicaciones graves en personas con demencia, los eventos adversos más complicados son a nivel cardio y cerebrovascu- lares (Riesgo aumentado de ictus).
Ello llevo a la Food and Drug administration (FDA) de Esta- dos Unidos a publicar un warning (advertencia) sobre el uso de estas moléculas en este segmento poblacional con pato- logías neuropsiquiátricas como las demencias (FDA, 2005).
Por este motivo la indicación de los antipsicóticos debe rea- lizarse con suma precaución, valorando cada caso en particu- lar y previendo los posibles efectos adversos.
No obstante ello, los fármacos que tienen un efecto sedativo y evidencia de utilidad en el sueño algunos fenómenos conduc- tuales en la demencia son, quetiapina en dosis de 12,5 a 25 mg por noche, risperidona 0,5 a 1 mg y olanzapina 2,5 a 5 mg siempre administrados por la noche (Rocca P, et al., 2007).
Como vemos, el manejo clínico, farmacológico y no farma- cológico de esta enfermedad es un desafío para el profesional tratante y debe valorarse cada caso en particular y adaptar la terapéutica de acuerdo con las características clínicas de cada paciente y de su entorno.
Bibliografía
- 1. Sarubbo L, Tamosiunas G, Bocchino S. “Tras- tornos del sueño. Parte II. Sus efectos y su neuro- biología, Psicofarmaclogía 2018; 108:26-30.
- 2. Harrington J, Lee- Chiong T. Basic biology of sleep. DentClin North Am 2012; 56:319-30.
- 3. Cardinali D. 2007. Neurociencia aplicada, sus fundamentos. Editorial Médica Panamericana.
- 4. España RA, Scamell TE. Sleepneurobiolo- gyfrom a clinicalperspective. Sleep 2011; 34:
845-58.
- 5. Phillips B, Ancoli-Israel S. Sleepdisorders in theelderly. SleepMed 2000; 2: 99-114.
- 6. Chokroverty S. 2009. Physiologicchanges
in sleep. In Chokroverty S, editor Sleepdisorders medicine. Basic science, technicalconsidera- tions and clinicalaspects. 3 rdedition. Saun- ders-Elsevier, pages 81-104.
- 7. Lyketsos C. Demencia y síndromes cogni- tivos más leves. En Blazer D, Steffens D.2010. Tratado de psiquiatría geriátrica. 4° edición. El- sevier.
- 8. Acosta D, Brusco L, Fuentes Guglielmetti P, Guerra M, Mena R, Nitrini R, Trujillo de los Santos Z, Ventura R. 2012. La enfermedad de Alzheimer, diagnóstico y tratamiento: una pers- pectiva latinoamericana. Editorial Médica Pana- mericana.
- 9. Garre-Olmo J. Epidemiology of Alzheimer´s-
disease and otherdementias. RevNeurol 2018 Jun 1; 66 (11): 377-386.
- 10. Alzheimer´sDisease International (ADI). WorldReport 2022.
- 11. Livingston G, Huntley J, Sommerlad A, Ames D, Ballard C, Benerjee S, et al. Dementia- prevention, intervention, and care: 2020 report of TheLancetCommission. TheLancetCommis- sions, volume 396, issue10248, p 413-446,
August 08, 2020.
- 12. Taragano F. 2019. Deterioro cognitivo: un desafío en clínica médica y atención primaria. Gerontopsiquiatría. 1° edición. Laboratorio Gador.
- 13. Cardinali D. 2007. Neurociencia aplicada, sus fundamentos. Editorial Medica Panamerica-
na, caps 14 y 15.
- 14. Brusco L. 2012. Trastornos del sueño y de los ritmos biológicos en la enfermedad de Al- zheimer. Editorial Salerno.
- 15. NationalHealthInsititute. Recuperado 12 de febrero 2023.https://medlineplus.gov/spani- sh/ency/article/000800.htm.
- 16. Chokroverty S. 2009. Sleepdisordersmedi- cine.Basicscience, technicalconsiderations and clinicalaspects. 3rd edition. Saunders-Elsevier.
- 17. Miranda et al. Demencia y sueño, en So- ciedad española de sueño, editores Tratado de Medicina del sueño. 2015, pag 805-811. Edito- rial Médica Panamericana.
- 18. Rochelle E, et al. Characterizinsleeppro- blems in personswithAlzheimer´sdiseaseand nor- mal elderly, J Sleep Res, (2006) 15, 97-103.
- 19. Oludamilola Salami, et al. Treatment of sleepdisturbances in Alzheimer´sdementia. Int J GeriatrPsychiatry (2011) 26: 771-782.
- 20. Kandel E, Schwartz J, Jessell T. 2001.Principios de Neurociencia.4°ed. Mc Graw-Hill.
- 21. Fuller P, et al. Neurobiology of thes- leep-wakecycle: sleeparchitecture, circadianre- gulation and regulatoryfeedback. J BiolRhytms, 2006; 21:482-93.
- 22. Cipolla Neto J, Gaspar do Amaral F. Me- latonin as a hormone: new physiological and cli- nicalinsights. Endocrinereviews, vol 39, issue6, 2018, pages 990-1028.
- 23. Bear M, Connors B, Paradiso M.2016. Neurociencia, la exploración del cerebro.4° ed. WoltersKluwer.
- 24. Flores Soto M, Segura Torres J. RevMex- Neurosci, vol 6, número 4, Julio-Agosto 2005.
- 25. Pinel J. Biopsicología. 2001. 4° ed. Pear- son.
- 26. Rose KM, Lorentz R. Sleepdisturbances in dementia. J GerontolNurs 2010: 36 (5): 9-14.
- 27. Wenk G. Neuropathologicchanges in Al- zheimer´sdisease. J ClinPsychiatry 2003; [suppl 9]: 7-10.
- 28. Mc Curry SM, Ancoli- Israel s. Sleepdys- function in Alzheimer´sdisease and otherdemen- tias. Currtreatoptionsneurol, 2003; 5: 261-72.
- 29. Brusco LI, Olivar N.2021. Manual de ac- tualización de la enfermedad de Alzheimer. Aka- dia Editorial.
- 30. Agüera Ortiz L, Martin Carrasco M, Sán- chez Pérez M. 2021. Psiquiatría Geriátrica. El- sevier.
- 31. Alberca R, López Pousa S. 2011. Enfer- medad de Alzheimer y otras demencias. Edito- rial Médica Panamericana.
- 32. Gabelle A, Dauvilliers Y. Editorial: sleep and dementia. J NutrHealthAging, 2010; 14
(3): 201-2.
- 33. Vitiello MV, Borson S (2001) Sleepdistur- bances in patientswithAlzheimer´sdisease: epi- demiology, pathophysiology and treatment. CNS Drugs 15: 777-796.
- 34. Bhatt MH, Podder N, Chokroverty S. Sleep and neurodegenerativedisorders. Seminneurol
2005; 25: 39-51.
- 35. Boronat A, Ferreira Maia AP, YuangPang
W. Sundown síndrome in olderpersons: a scopin- greview. Journal of americans medical director- sassciation. Vol 20, issue 6, June 2019, pages
664-671.
- 36. Zhou QP, et al. Themanagement of sleep and circadiandisturbances in patientswithde- mentia. Currneurolneuroscirep (2012) Apr; 12
(2): 193-204.
- 37. Gil Gregorio. 2010. Tratado de Neuropsi- cogeriatría. Ergon.
- 38. Blazer D, Steffen D. 2010. Tratado de Psi- quiatría Geriátrica. Elsevier.
- 39. Boland R, Verduin M. 2022. Kaplan y Sa- dock Sinopsis de Psiquiatría. WoltersKluwer.
- 40. Yesavage J, et al. Development of diag- nosticcriteriafordefiningsleepdisturbances in Alzheimer´sdisease. J GeriatPsychiatryNeurol (2003) 16:131.
- 41. Chokroverty S. Aproximación al paciente con alteraciones del sueño. En Chokroverty S. 2011. Medicina de los trastornos del sueño, as- pectos básicos, consideraciones técnicas y apli- caciones clínicas. Elsevier.
- 42. Johns MB, et al. A new methodformeasu- ringdaytimesleepiness: theEpworthslepinesssca- le. Sleep (1991) Dec; 14 (6): 540-5.
- 43. Tractenberg R, Singer C, Cummings J, Thal L. Thesleepdisorderinventory: aninstrumen- tforstudies of sleepdisturbance in personswithA- lzheimer´sdisease. Volume 12, issue 4, decem-
ber 2003, pages 331-337.
- 44. Hoddes E, Dement W, Zarcone V. Thedeve- lopment and use of theStanforssleepinessscale (SSS) Psychophysiology, 9. 150 (1972).
- 45. Buysse D, et al. The Pittsburgh sleepqua- lityindex: a new instrumentforpsychiatrypractice and research. Psychiatry Res (1989) May; 28
(2); 193-213.
- 46. Peter-Derex L, Yommine P, Bastuji H, Croisile B. Sleep and Alzheimer´sdiseaseSleep- medrev. 2015 Feb; 19: 29-38.
- 47. WorldSleepSociety. Recuperado 12 de febrero 2023.https://worldsleepday.org/usetool- kit./resources/10tips-for-better-sleep.
- 48. Roccaro I, Smirni D. Fiat lux. The light becametherapy. Anoveview and thebright light therapy in Alzheimer´sdiseasesleepdisorders. Journal of Alzheimer´sdisease, vol 77, n° 1 pp 113-125. 2020.
- 49. Mishima K, Okawa M, Hozumi S, Hishi- kawa Y. Supplementary administration of artifi- cial bright light and melatonin as potent treat- ment for disorganized circadianrest-activity and dysfunction alautonomic and neuroendocrine systems in institucionalized dementelderly per- sons. ChronobiolInt 2000 May; 17 (3): 419-32.
- 50. Wu YH, Sweeb DF. Disturbance and stra- tegiesforreactivations of thecircadianrhythmsys- tem in aging and Alzheimer´sdisease. Sleepmed 2007; 8: 623-36.
- 51. Jun Song Isaac, LingJieCheng, EeYuee Chan, Ying Lau, SiewTiangLau. Light therapyfor-
sleepdisturbances in olderadultswithdementia: a systematicreview, me-analysis and meta-regres- sion. Sleep Medicine, vol 90 February 2022, pages 153-166.
- 52. Hardeland, et al. Melatonin: a pleiotro- picregulatermoleculeProgress in neurobiology. 2011, 93, 350-384.
- 53. Cardinali D, Scacchi Bernasconi P. Chro- nophysiology of melatonin: therapeuticalimpli- cations. The open neuroendocrinologyjournal 2010, 3, 72-84.
- 54. Cardinali D, Brusco L, Liberczuk C, Furio
A. 2002b. Review. The use of melatonin in Al- zheimer´sdisease. Neuroendocrinollett 23, suppl 1: 20-23.
- 55. Cohen- Mansfield J, Garfinkel D, Lipson
S. 2000. Melatoninfortreatment of sundowning in elderlypersonswithdem. ArchGerontolGeriatr 31: 65-76.
- 56. Brusco L, Marquez M, Cadinali D. me- latonintreatmentstabilizeschronobiologic and cognitivesymptoms in Alzheimer´sdisease. Neu- roendocrinologyletters, vol 19 (1998) n° 3, pp
111-115.
- 57. Profenno L, et al. Pharmacologicalmana- gement of agitation in Alzheimer´sdiseaseDe- mentGeriatCogDisord (2004); 17 (1-2): 65-77.
- 58. Jufe G. 2017 Psicofarmacología práctica. Editorial Polemos.
- 59. Wiegand M, et al. Antidepressantsfortreat- ment of insomnia: a suitableapproach? Drugs, 2008; 68 (17): 2411-7.
- 60. PublicHealthAdvisory: deathswithantipsy- choticsinelderlypatientswithbehavioraldistur- bances. Food and drugsadministration 20025.
- 61. Rocca P, et al. Risperidone, olanzapine and quetiapine in thetreatment of behavioral and psychologicalsymptoms in patientswithA- lzheimer´sdisease; preliminaryfindingsfrom a naturalisticretrospectivestudy. PsychiatryClin- Neurosci (2007) 61 (6): 622-629.







No comments! Be the first commenter?