Modulación del manejo renal de ácido úrico por fármacos inhibidores de SGLT2
Resumen
En los últimos años, y a partir de lo hallado en ensayos clínicos a gran esca- la, se ha observado que los inhibidores SGLT2 reducen significativamente la uricemia. Sin embargo, los mecanismos farmacológicos se han comprendido más recientemente.
En un primer momento, los inhibidores de SGLT2, al provocar un aumento en la oferta de glucosa a nivel luminal en los túbulos proximales, llevarían a esta última a competir con el ácido úrico por su reabsorción renal mediada por una molécula clave: el transportador GLUT9.
Por otro lado, gracias a su efecto de disminución del peso corporal, el cual se asocia a un descenso en la resistencia a la insulina, estas drogas también se- rían capaces de aumentar la excreción a nivel renal de ácido úrico, al modificar los patrones de expresión de moléculas como URAT1 y ABCG2, cuya expresión se haya vinculada a los niveles de insulina presentes en el organismo.
Estos efectos en la uricemia, tanto tempranos como tardíos, agregan un be- neficio adicional a los sujetos con enfermedades cardio-reno-metabólicas y deben ser tenidos en cuenta a la hora de la toma de decisiones terapéuticas.
Palabras clave
Hiperuricemia – Ácido úrico – Diabetes mellitus tipo 2 – Gliflozinas.
Los fármacos inhibidores del cotransportador SGLT2, tam- bién conocidos como gliflozinas, son drogas que, si bien se diseñaron originalmente para el tratamiento de la diabetes mellitus, han demostrado con el paso del tiempo tener dis- tintos efectos adicionales a su principal objetivo: disminuir los niveles de glucosa en sangre mediante un aumento de su excreción renal.
Entre estos últimos, adquiere una gran relevancia el efec- to hipouricemiante de las gliflozinas, por ser el ácido úrico un compuesto que, no solamente se encuentra vinculado al desarrollo de gota, sino que también se considera como un factor de riesgo independiente para el desarrollo de enferme- dad renal crónica e hipertensión arterial, así como también aumenta el riesgo de sufrir eventos adversos cardiovasculares de importancia (MACE, por su sigla en inglés).
Este descenso en los niveles de ácido úrico mediado por los SGLT2i se debería principalmente a un aumento en la excreción a nivel renal de este metabolito, más que a un des- censo en la producción del mismo, y estaría presente tanto en pacientes con diabetes, como en aquellos que no padecen esta patología. A pesar de que se han postulado múltiples me- canismos a través de los cuales las gliflozinas provocarían este descenso en los niveles de ácido úrico del organismo, existen bastantes pruebas de que dicho efecto tendría lugar como consecuencia de la participación de mecanismos de acción tanto inmediatos, como tardíos.
El objetivo del presente trabajo fue brindar información per- tinente que permita comprender los mecanismos de acción propuestos para el efecto uricosúrico e hipouricemiante de los fármacos inhibidores de SGLT2, utilizando fundamentos obtenidos a partir de la realización de una amplia revisión sobre estos aspectos.
Métodos
Para la elaboración de este trabajo se llevó a cabo una revi- sión amplia en la literatura, de trabajos publicados entre los años 2010 y 2023. Además, se realizó una búsqueda espe- cífica en las directrices de diferentes sociedades científicas y libros acordes. La información reunida fue evaluada por título y resumen por un autor (J.F.M.), para luego ser desarrollada y revisada por todos los autores. Los autores declaran no tener conflictos de intereses, y no han recibido financiación para el desarrollo del mismo. En esta publicación médica no se des- criben datos de pacientes, por lo que no se requirió consen- timiento para el mismo. Los autores, además, describen que no se ha utilizado inteligencia artificial generativa en la redac- ción de este documento o en la confección de tablas-gráficos.
Ácido úrico e hiperuricemia
Se conoce como ácido úrico a un ácido orgánico débil, con un pKa de 5,75 que, a valores de pH fisiológicos, se presenta como urato monosódico. Debido a la pérdida en la capacidad de expresar a la enzima uricasa, el ácido úrico constituye el producto final del metabolismo de las purinas en los seres hu- manos, lo cual redunda en la presencia de mayores niveles de este metabolito en el organismo en comparación con ciertos animales como los murinos (5, 12).
Si bien se cree que estos mayores niveles representan una ventaja evolutiva, debido a los efectos antioxidantes del ácido úrico, se ha demostrado en múltiples estudios que los niveles elevados de este metabolito se asocian a la presencia de di- versas enfermedades (3,10). En este sentido, cabe remarcar que la hiperuricemia, la cual se considera como tal ante la presencia de niveles plasmáticos de ácido úrico mayores a 7 mg/dL, es un factor de riesgo independiente para el desarrollo y progresión tanto de enfermedad renal crónica (ERC), como de hipertensión arterial (HTA). De la misma manera, la eleva- ción en los niveles sanguíneos de urato se asocia a un riesgo más elevado de padecer eventos adversos cardiovasculares mayores (MACE).
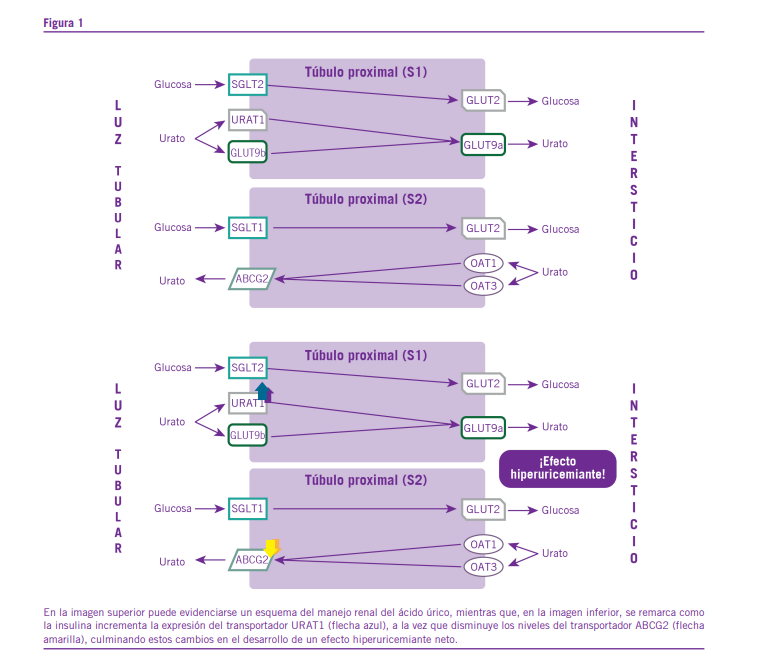
La excreción renal de ácido úrico es del 70% del mismo, lo que vuelve a esta última su principal vía de eliminación, así como también el principal factor determinante de sus niveles en circulación. El 30% restante de este compuesto se elimina por vía intestinal (12). El manejo renal del ácido úrico es comple- jo, e implica, no sólo un proceso de filtración glomerular, sino también procesos de reabsorción y de secreción a nivel tubular en los que participan múltiples moléculas presentes, principal- mente, en los túbulos proximales de las nefronas (ver Figura 1). Uno de los protagonistas en lo que respecta la reabsorción de ácido úrico a nivel renal es el transportador URAT1, el cual intercambia el ácido úrico presente en la luz tubular por monocarboxilatos. Es de gran importancia remarcar que la ex- presión de URAT1 en la membrana apical de las células tubu- lares proximales es directamente proporcional a los niveles de insulina en circulación. De esta manera, en los pacientes con diabetes de tipo 1, por ejemplo, debido a los bajos niveles de insulina que puede haber en el organismo antes del control
de la enfermedad, es posible que la expresión de URAT1 se encuentre disminuida, lo cual resultará en un aumento en la excreción de ácido úrico por vía renal y esto, en un descenso en los niveles plasmáticos de este compuesto (8).
En sentido contrario, en los pacientes con diabetes de tipo 2, como consecuencia de un estado de hiperinsulinemia se- cundario a la presencia de resistencia a la insulina, puede ocurrir que la expresión de URAT1 a nivel renal se encuentre aumentada, lo cual culminará en un incremento en la reab- sorción de ácido úrico, y en el desarrollo de un estado de hi- peruricemia. Cabe agregar que, en la membrana apical de las células tubulares de las regiones más proximales del túbulo proximal (S1), también están presentes los transportadores OAT4 y OAT10, los cuales contribuyen en menor medida con la reabsorción renal de ácido úrico (2).
De especial interés es la contribución al manejo renal de ácido úrico de la molécula conocida como GLUT9. Esta últi- ma es un miembro de los transportadores GLUT de clase 2, lo que indica una preferencia por la fructosa por sobre la glucosa como sustrato. No obstante, la molécula GLUT9 cuenta con la particularidad dentro de su grupo de preferir al ácido úrico como sustrato (6), para el cual presenta una Km de 0,6 mM. El transportador GLUT9 presenta dos variantes de empalme, conocidas como GLUT9b y GLUT9a, las cuales se expresan en las membranas apical y basolateral de las células epiteliales de los túbulos proximales, respectivamente (2,5,12,16,18). De esta manera, en condiciones fisiológicas, GLUT9b se en- carga, en conjunto con URAT1, OAT4 y OAT10 de mediar la reabsorción tubular de ácido úrico, mientras que GLUT9a participa en lo que es el pasaje de este metabolito desde el intracelular, hacia el espacio intersticial y, finalmente, hacia
la circulación sanguínea (15, 19).
El funcionamiento de GLUT9 es independiente de las con- centraciones de Na+ y de Cl-, pero no del voltaje de membra- na, siendo la reabsorción de ácido úrico más importante con potenciales más negativos (2, 5, 18). Esta última propiedad del transportador GLUT9 ha llevado a que también se conoz- ca a la molécula como URATv1, denominación que refleja el transporte electrogénico mediado por esta molécula.
Cabe agregar que, mediante la realización de estudios en los que se inactivó a GLUT9 y a URAT1 por separado, fue posible notar que la fracción de excreción de ácido úrico fue más eleva- da en ausencia del primero, de lo que se desprende que, si bien ambos transportadores ejercen efectos aditivos en lo que res- pecta a la reabsorción renal de urato, la relevancia de GLUT9 en la regulación de los niveles séricos de este metabolito es mayor que la de URAT1 (1, 18). De hecho, el principal locus vinculado a los niveles séricos de urato en humanos es el del gen SLC2A9, el cual codifica para el transportador GLUT9 (5). La reabsorción casi completa del ácido úrico filtrado a nivel de los túbulos proximales permite inferir que la secreción tu- bular de este compuesto debe contribuir en forma importante a la totalidad del metabolito que se termina eliminando por vía renal. Dicha secreción tiene lugar principalmente a nivel de la región más distal del túbulo proximal (S2), y es mediada por distintas moléculas como OAT1, OAT3 y ABCG2, entre otros transportadores (19).
En forma inversa a lo que ocurre con URAT1, la insulina tiende a reducir la expresión del transportador ABCG2 a nivel renal, lo cual también contribuye a este efecto anti-uricosú- rico de la hormona, al actuar dicho transportador como una molécula secretora de ácido úrico de alta capacidad. Estas modificaciones en la expresión de moléculas implicadas en el manejo renal del ácido úrico inducidas por la insulina po- drían explicar, al menos parcialmente, la asociación existente entre la alteración en los niveles de ácido úrico y los estados diabéticos (17).
Gliflozinas
Las gliflozinas, como la empagliflozina, la dapagliflozina y la canagliflozina, son fármacos antidiabéticos orales que ac- túan inhibiendo el funcionamiento del transportador SGLT2. Esta última molécula se expresa en la membrana apical de las células de la región más proximal del túbulo proximal, y media la reabsorción de glucosa en contra de su gradiente de concentración, utilizando para ello la energía generada mediante el transporte de sodio en la misma dirección.
Al impedir el normal funcionamiento del transportador SGLT2, estos fármacos ponen un freno a la reabsorción renal de glucosa, aumentando así sus niveles en la luz tubular y, finalmente, en la orina, lo cual, a su vez, se traduce en un descenso de la glucemia. Cabe aclarar que este efecto se da en forma independiente de los niveles de insulina y de su fun- cionamiento (14), pudiendo estar presente tanto en pacientes con hiperglucemia, como en aquellos que tengan niveles nor- males de glucosa en sangre, o incluso, niveles disminuidos.
Un último detalle para considerar con respecto al efecto hipoglucemiante de las gliflozinas es el hecho de que, si bien el transportador SGLT2 es la principal molécula encargada de la reabsorción renal de glucosa, entre un 10% y un 20% de
dicha reabsorción es mediada por el transportador SGLT1, el cual se expresa en las membranas apicales de las células de la región más distal del túbulo proximal.
Ahora bien, por más que volver a exponer el mecanismo de acción para el efecto hipoglucemiante de los SGLT2i parezca algo redundante, esto no puede dejar de hacerse si se desea comprender cómo estas drogas terminan generando un efecto hipouricemiante, dado que, al menos en parte, el aumento en la excreción de ácido úrico por orina se da en forma secunda- ria a la glucosuria generada por las gliflozinas.
Siguiendo con esto último, puede decirse que, al inhibir al transportador SGLT2, las gliflozinas generan un aumento en la disponibilidad de glucosa en la luz del túbulo proximal de las nefronas, sitio en el que tiene lugar, principalmente, el manejo renal de ácido úrico en los seres humanos. Lo más probable y, de hecho, lo que se propone en una gran cantidad de trabajos (3, 4, 9, 10, 12, 16, 19, 21, 25), es que, ante esta oferta excesiva de glucosa en la luz tubular, el transporta- dor GLUT9b, el cual, en condiciones fisiológicas participa en la reabsorción renal de ácido úrico, y no en la de glucosa (22), tienda a utilizar como sustrato a esta última molécula (Figura 2), actuando finalmente en forma similar a otros integrantes de su familia (6).
Si bien en distintos lugares de la bibliografía se postula que el aumento en la oferta de glucosa tubular estimula un intercambio de glucosa luminal por ácido úrico intracelular (2, 22), esto se contradice con el hecho de que los transpor- tadores GLUT pertenecen a la superfamilia de proteínas trans- portadoras de solutos SLC (solute carrier) con un arreglo MFS. Los transportadores de estas características, cuando están en reposo, presentan una apertura única hacia una de las ca- ras de la membrana, y una cavidad que van ocupando los sustratos. En cuanto dicha cavidad se llena, el transportador sufre un cambio conformacional que desliza la apertura hacia la cara opuesta de la membrana, cerrándose la primera (24). Teniendo en cuenta esta información, se vuelve más factible considerar que, lo que realmente ocurre al aumentar la gluco- sa en la luz tubular es una competencia entre esta última y el
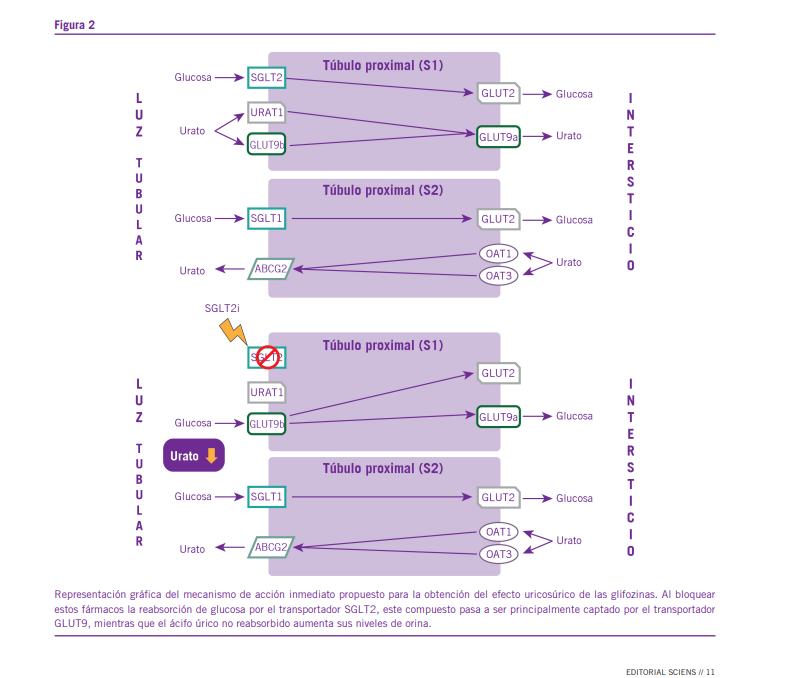
ácido úrico por su reabsorción por el transportador GLUT9b, la única molécula que puede utilizar a ambas sustancias como sustrato. De esta manera, el ácido úrico no absorbido a nivel de los túbulos proximales, acaba por excretarse por vía renal, siendo este el mecanismo por el que se consigue el efecto uricosúrico inmediato de las gliflozinas.
Por supuesto, la posibilidad de que éste sea el mecanis- mo por el cual los inhibidores de SGLT2 aumentan en forma aguda la fracción de excreción renal de ácido úrico se ve res- paldada por múltiples fundamentos. En primer lugar, cabe destacar que el efecto uricosúrico de las gliflozinas, es mayor que aquel obtenido con el uso de manitol, lo que denota que, independientemente de cualquier efecto osmótico que pueda conseguirse con los SGLT2i, estas drogas deben actuar en algún sitio adicional (2).
No obstante, el propio transportador SGLT2 no media el pasaje de ácido úrico a través de las membranas biológicas, ni tampoco las gliflozinas ejercen efecto alguno sobre las dis- tintas moléculas que se encargan del manejo tubular de urato, lo que permite inferir que el aumento en la excreción renal de este metabolito se debe, no a una acción directa de las drogas de este grupo, sino a modificaciones secundarias a la gluco- suria que estas últimas desencadenan (1, 2, 15).
Un tercer fundamento, que es probablemente el más con- vincente, es el hecho de que, con el aumento en la dosis de la gliflozina empleada, el perfil de tiempo para el incremento en la fracción de excreción de ácido úrico se correlaciona mejor con el perfil correspondiente al aumento en la fracción de excreción de la glucosa, que con la concentración plasmática de la droga elegida (1, 2, 21).
Por último, cabe agregar que pudo observarse que, median- te el silenciamiento del transportador SGLT1, cuya ausencia no es suficiente para modificar por sí sola la fracción de ex- creción de ácido úrico, se obtiene una potenciación, tanto del efecto glucosúrico, como del efecto uricosúrico de los inhibi- dores de SGLT2 (1).
Como se mencionó previamente, el efecto glucosúrico de los SGLT2i es independiente de los niveles séricos de gluco- sa, lo que permite que el mismo se dé tanto en personas con diabetes, como en aquellas que no padecen esta enfermedad. Tener en cuenta esta información reviste una gran importan- cia, dado que, de esta manera, se puede comprender que, al ser el efecto uricosúrico de las gliflozinas, al menos en parte, secundario a la elevación tubular de glucosa, el mismo tam- bién estará presente en pacientes con y sin diabetes (1, 8, 9, 11, 13, 21).
Ahora bien, más allá de generar un efecto uricosúrico in- mediato a través del mecanismo propuesto previamente, los
inhibidores de SGLT2 también son capaces de provocar, más a largo plazo, un descenso en el peso corporal de los pacien- tes, así como también una caída en la resistencia a la insulina (Tabla 1). Como fue comentado con anterioridad, la insulina es capaz de inducir la expresión del transportador URAT1, y de disminuir la del transportador ABCG2, por lo que el des- censo en los niveles de esta hormona terminaría llevando a una normalización en la expresión de estas proteínas y, por ende, a una caída en la reabsorción de ácido úrico, vinculada a un aumento de su excreción por vía renal, y a un descenso de sus niveles en circulación (1, 3, 9, 14, 15, 17, 20).
Se ha visto, incluso, que el efecto de descenso en los nive- les de ácido úrico en sangre luego de la administración de gli- flozinas está presente en murinos con enfermedad renal cróni- ca avanzada, situación en la que tanto la filtración glomerular de glucosa, como la de ácido úrico se encuentran disminuidas y, por lo tanto, también su competencia por GLUT9b. Estos hallazgos permitirían afirmar que el efecto hipouricemiante de estas drogas no solamente sería independiente de la presen- cia de diabetes, sino también de la función renal.
Uno de los mecanismos propuestos para la obtención del efecto hipouricemiante de los SGLT2i en la población men- cionada es el aumento en la excreción intestinal de ácido úrico, probablemente mediado por la molécula ABCG2, un transportador de secreción de urato de alta capacidad, cuya expresión se ha visto incrementada por el uso empagliflozina tanto a nivel del íleon, como a nivel renal en estudios realiza- dos en ratones con diabetes (11, 23).
Esto último sería muy interesante, no solo porque, como se mencionó previamente, el tracto intestinal es el segundo lugar en importancia en lo que respecta a la excreción de ácido úrico del organismo (12), sino también por el hecho de que el transportador ABCG2 es una de las moléculas cuya expresión es controlada por la insulina (15, 17). Será necesario realizar más estudios en el futuro para verificar la existencia y relevan- cia de este último mecanismo en seres humanos.
En concordancia con estas propuestas, cabe destacar que en un ensayo clínico realizado sobre una cohorte de 2313 pa- cientes con diabetes mellitus de tipo 2, entre los cuales había un subgrupo de pacientes con hiperuricemia, se evaluaron los efectos sobre los niveles de ácido úrico séricos de dos dosis diferentes de canagliflozina, en comparación con el uso de placebo. Los resultados de dicho ensayo mostraron que tanto los pacientes que habían recibido una dosis de 100 mg de canagliflozina, como los que habían recibido la dosis de 300 mg, los cuales contaban con valores de uricemia promedio de entre 5,3 y 5,4 mg/dl, habían conseguido un descenso del 13% en los niveles de ácido úrico sérico, en comparación con
Tabla 1
Gliflozinas y uricemia
| Corto plazo | Largo plazo | |
| Efectos | Uricosúricos | Antihiperuricemiantes – uricosúricos |
| Mecanismos propuestos | Competencia por la reabsorción por GLUT9 entre glucosa y uratos | Mejoría en la insulino-resistencia Disminución de la expresión de URAT1 Aumento de expresión de ABCG2 |
los valores obtenidos con el uso de placebo, en la semana 26 del estudio. Resultados similares se observaron con el sub- grupo de individuos con hiperuricemia, en los que los valores de uricemia promedio rondaban entre los 8,5 y los 8,6 mg/ dl (Tabla 2).
Además de esto, quedó registrado que, en el subgrupo po- blacional que también padecía hiperuricemia, el 23,5% de los pacientes que habían recibido la dosis de 100 mg pasaron a tener niveles normales de ácido úrico sérico, ocurriendo lo mismo con el 32,4% de los que utilizaron la dosis de 300 mg. Por el contrario, esto solamente ocurrió en el 3,1% de los participantes que recibieron placebo (27).
Con respecto a los efectos nefroprotectores de los inhibidores de SGLT2, es importante remarcar que, si bien en el pasado se creía que las complicaciones a largo plazo de la diabetes eran una consecuencia exclusiva de la hiperglucemia, hoy en día se sabe que existen otros mecanismos implicados en el desarrollo del daño de los distintos órganos diana de la enfermedad, por lo que se prefiere la adopción de un enfoque órgano-protector de tipo multifactorial. En este sentido, las gliflozinas constituyen una herramienta de gran ayuda, dado que las mismas son capa- ces de ejercer un efecto nefroprotector a través de mecanismos tanto renales, como extrarrenales (9).
En los riñones, las gliflozinas no solo aumentan la excreción de ácido úrico en la orina, sino que, al inhibir al transporta- dor SGLT2 a nivel de los túbulos proximales, aumentan el aporte distal de cloruro de sodio hacia la mácula densa, con lo cual atenúan la vasodilatación de la arteriola aferente y la vasoconstricción de la arteriola eferente, ambas típicas de los estados de hipertensión glomerular e hiperfiltración. Además, al oponerse a la hiperglucemia y el estrés oxidativo, los inhi- bidores de SGLT2 ponen un freno a la inflamación y la fibro- génesis a nivel de los túbulos renales. Por otro lado, a nivel extrarrenal, estos fármacos también son capaces de disminuir la presión arterial, tanto a través de su efecto de depleción del volumen intravascular, el cual es secundario a la glucosuria y la diuresis osmótica, como mediante la modulación por estos fármacos del sistema nervioso simpático y del sistema reni- na-angiotensina aldosterona.
En un estudio realizado en pacientes con diabetes mellitus de tipo 2 y una tasa de filtración glomerular de al menos 30 mL/min, en el cual, un grupo recibió una dosis diaria de em- pagliflozina, y el otro, placebo, pudo registrarse que, en un 12,7% de los pacientes del primer grupo, tuvo lugar un inicio o empeoramiento de la nefropatía diabética, mientras que, en el grupo placebo, este porcentaje fue del 18,8%. De for- ma similar, la duplicación de los niveles de creatinina sérica ocurrió en un 1,5% de los pacientes del primer grupo, y en un 2,6% de los pertenecientes al segundo grupo. Además, en el 0,3% de los integrantes del grupo que recibió empagliflozina fue necesario iniciar una terapia de reemplazo renal, mientras que, en el grupo placebo, esta medida tuvo que aplicarse en un 0,6% de los participantes. Teniendo en cuenta estos re- sultados, se vuelve fácil comprender que la incorporación de empagliflozina al tratamiento de los pacientes con diabetes mellitus de tipo 2 enlentece la progresión de la enfermedad renal, a la vez que reduce la incidencia de eventos renales clínicamente relevantes (26).
Una última cuestión a tener en cuenta es el hecho de que el ácido úrico suele estar aumentado en pacientes con insu- ficiencia cardíaca, debiéndose esto tanto a que la actividad de la xantino oxidasa se encuentra aumentada, como a que, al estar afectada la función renal y, al competir los diuréticos con el ácido úrico por su excreción a este nivel, la depuración de este metabolito se encuentra disminuída. La asociación de insuficiencia cardíaca e hiperuricemia no sólo es frecuen- te, sino que, cuanto mayores son los niveles de ácido úrico en sangre, peores son los resultados clínicos evidenciables, persistiendo estos hallazgos a pesar del manejo de la función renal, del uso y la dosis de diuréticos, y de los niveles de pép- tidos natriuréticos.
No hay que olvidar, además, que la hiperuricemia puede llevar a la aparición de gota, una afección que es frecuente en pacientes con insuficiencia cardíaca es difícil de manejar, y puede provocar y prolongar las hospitalizaciones, lo cual resal- ta la urgencia existente para el desarrollo de medidas terapéu- ticas que permitan manejar en forma simultánea los niveles de ácido úrico en el organismo y la insuficiencia cardíaca.
En un estudio realizado en pacientes con insuficiencia car- díaca con fracción de eyección reducida, entre los cuales ha- bía individuos con y sin diabetes mellitus (DAPA-HF), pudo observarse que la dapagliflozina presenta beneficios persis- tentes, en comparación con el placebo, en lo que respecta a las hospitalizaciones por insuficiencia cardíaca, y a la muerte por causa cardiovascular, y por cualquier causa, independien- temente de que los niveles de ácido úrico se midan en gru- pos, o como una variable continua, si bien el efecto es mayor cuanto más altos sean los niveles de uratos en circulación (4). Además, el uso de inhibidores de SGLT2 en reemplazo de los fármacos tradicionalmente utilizados para disminuir la uricemia permitiría prevenir el desarrollo de efectos adversos graves vinculados a estos últimos, como puede ser el síndro- me de Stevens-Johnson asociado al uso de alopurinol. De la misma manera, podría evitarse la producción de interaccio- nes farmacológicas, como las que pueden tener lugar con el empleo de fármacos como los AINEs, los cuales, en adición a esto, puede agravar el daño renal existente en estos pa- cientes. De más está decir que la reducción del número de Valores de uricemia antes y después del tratamiento con ambas dosis de canagliflozina en la cohorte general con diabetes tipo 2, y en el sub- grupo de pacientes con hiperuricemia. Información obtenida de (27).
| Antes del tratamiento | Después del tratamiento | |
| Cohorte general | 5,3 – 5,4 mg/dl | 4,6 – 4,7 mg/dl |
| Subgrupo con hiperuricemia | 8,5 – 8,6 mg/dl | 7,8 – 7,9 mg/dl |
fármacos mediante esta estrategia mejoraría la adherencia de los pacientes al tratamiento. Se ha observado que este efecto hipouricemiante de las gliflozinas en los pacientes con in- suficiencia cardíaca está presente con independencia de la coexistencia de diabetes mellitus (10).
Limitaciones
Parte de la información utilizada en la elaboración de esta revisión sistemática fue extraída de estudios realizados en animales, así como también de trabajos en los que se utiliza- ron ovocitos procedentes del anfibio Xenopus laevis.
Conclusiones
Los inhibidores del transportador SGLT2i, o gliflozinas, son fármacos que, si bien originalmente han sido diseñados para el control de la glucemia en la diabetes mellitus, con el paso del tiempo han demostrado tener múltiples efectos adiciona- les a otros niveles. Entre ellos, quizás uno de los más relevan- tes sea el descenso en los niveles de ácido úrico, no mediante una reducción en la producción de este metabolito, sino más
bien a través de un aumento en su excreción por vía renal. Para ello, los SGLT2i contarían, por un lado, con un meca-
nismo de acción inmediato, basado en la competencia entre la glucosa y el ácido úrico por el transportador GLUT9, la única molécula a nivel de las nefronas que tiene como sus- tratos a ambas sustancias. Por otro lado, más a largo plazo, también contribuiría a este efecto uricosúrico el descenso en la resistencia a la insulina mediado por las gliflozinas, el cual conduciría a una disminución en la expresión de URAT1, y a un aumento en la expresión de ABCG2, y estas últimas, a una elevación en la excreción de ácido úrico a nivel renal.
Los efectos glucosúrico y uricosúrico de las gliflozinas son independientes tanto de los niveles de glucosa en sangre, como de los niveles de ácido úrico en la misma, por lo que ambos estarán presentes tengan o no los pacientes diabetes y/o hiperuricemia. Esto último reviste una gran importancia, dado que permite que los inhibidores de SGLT2, nuevamente, sean de utilidad también fuera de la población para la que fueron originalmente elaborados, en este caso, para reducir los niveles elevados de ácido úrico, los cuales, como se men- cionó previamente, se asocian al desarrollo de daño, entre otros sitios, a nivel cardiovascular y renal.
Referencias bibliográficas
- 1. Novikov A, Fu Y, Huang W, Freeman B, Patel R, van Ginkel C, Koepsell H, Busslinger M, Onishi A, Nespoux J, Vallon V. SGLT2 inhibition and renal urate excretion: role of luminal glucose, GLUT9, and URAT1. Am J Physiol Renal Physiol. 2019 Jan 1;316(1):F173-F185. doi: 10.1152/ajprenal.00462.2018.
- 2. Chino Y, Samukawa Y, Sakai S, Nakai Y, Yamaguchi J, Nakanishi T, Tamai I. SGLT2 inhibitor lowers serum uric acid through alteration of uric acid transport activity in renal tubule by increased glycosuria. Biopharm Drug Dispos. 2014 Oct;35(7):391-404. doi: 10.1002/bdd.1909.
- 3. Yanai H, Adachi H, Hakoshima M, Katsuyama H. Molecular Biological and Clinical Understanding of the Pathophysiology and Treatments of Hyperuricemia and Its Association with Metabolic Syndrome, Cardiovascular Diseases and Chronic Kidney Disease. Int J Mol Sci. 2021 Aug 26;22(17):9221. doi: 10.3390/ijms22179221.
- 4. McDowell K, Welsh P, Docherty KF, Morrow DA, Jhund PS, de Boer RA, O’Meara E, Inzucchi SE, Køber L, Kosiborod MN, Martinez FA, Ponikowski P, Hammars- tedt A, Langkilde AM, Sjöstrand M, Lindholm D, Solomon SD, Sattar N, Sabatine MS, McMurray JJV. Dapagliflozin reduces uric acid concentration, an independent predictor of adverse outcomes in DAPA-HF. Eur J Heart Fail. 2022 Jun;24(6):1066-1076. doi: 10.1002/ejhf.2433.
- 5. So A, Thorens B. Uric acid transport and disease. J Clin Invest. 2010 Jun;120(6):1791-9. doi: 10.1172/JCI42344.
- 6. Holman GD. Structure, function and regulation of mammalian glu-cose transporters of the SLC2 family. Pflugers Arch. 2020 Sep;472(9):1155-1175. doi: 10.1007/s00424-020-02411-3.
- 7. Suijk DLS, van Baar MJB, van Bommel EJM, Iqbal Z, Krebber MM, Vallon V, Touw D, Hoorn EJ, Nieuwdorp M, Kramer MMH, Joles JA, Bjornstad P, van Raalte DH. SGLT2 In- hibition and Uric Acid Excre-tion in Patients with Type 2 Diabetes and Normal Kidney Function. Clin J Am Soc Nephrol. 2022 May;17(5):663-671. doi: 10.2215/CJN.11480821.
- 8. Lytvyn Y, Škrtić M, Yang GK, Yip PM, Perkins BA, Cherney DZ. Gly-cosuria-mediated urinary uric acid excretion in patients with uncom-plicated type 1 diabetes mellitus. Am J Physiol Renal Physiol. 2015 Jan 15;308(2):F77-83. doi: 10.1152/ajprenal.00555.2014.
- 9. Leoncini G, Russo E, Bussalino E, Barnini C, Viazzi F, Pontremoli R. SGLT2is and Renal Protection: From Biological Mechanisms to Real-World Clinical Benefits. Int J Mol Sci. 2021 Apr 23;22(9):4441. doi: 10.3390/ijms22094441.
- 10. Doehner W, Anker SD, Butler J, Zannad F, Filippatos G, Ferreira JP, Salsali A, Kaempfer C, Brueckmann M, Pocock SJ, Januzzi JL, Packer M. Uric acid and sodium-glucose cotransporter-2 inhibi-tion with empagliflozin in heart failure with reduced ejection fraction: the EMPEROR-reduced trial. Eur Heart J. 2022 Sep 21;43(36):3435-3446. doi: 10.1093/eurheartj/ehac320.
- 11. Iwata Y, Notsu S, Kawamura Y, Mitani W, Tamai S, Morimoto M, Yamato M. The effect of dapagliflozin on uric acid excretion and serum uric acid level in advanced CKD. Sci Rep. 2023 Mar 24;13(1):4849. doi: 10.1038/s41598-023-32072-y.
- 12. Kim GH, Jun JB. Altered Serum Uric Acid Levels in Kidney Disorders. Life (Basel). 2022 Nov 15;12(11):1891. doi: 10.3390/life12111891.
- 13. Leung N, Yip K, Pillinger MH, Toprover M. Lowering and Rais-ing Serum Urate Levels: Off-Label Effects of Commonly Used Med-ications. Mayo Clin Proc. 2022 Jul;97(7):1345-1362. doi: 10.1016/j.mayocp.2022.02.027.
- 14. Wang S, Yuan T, Song S, Duo Y, Zhao T, Gao J, Fu Y, Dong Y, Zhao W. Medium- and Long-Term Effects of Dapagliflozin on Se-rum Uric Acid Level in Patients with Type 2 Diabetes: A Real-World Study. J Pers Med. 2022 Dec 22;13(1):21. doi: 10.3390/jpm13010021.
- 15. Kochanowska A, Rusztyn P, Szczerkowska K, Surma S, Gąsecka A, Jaguszewski MJ, Szarpak Ł, Filipiak KJ. Sodium-Glu-cose Cotransporter 2 Inhibitors to Decrea- se the Uric Acid Concen-tration-A Novel Mechanism of Action. J Cardiovasc Dev Dis. 2023 Jun 22;10(7):268. doi: 10.3390/jcdd10070268.
- 16. Takata T, Isomoto H. Pleiotropic Effects of Sodium-Glucose Cotransporter-2 Inhibitors: Renoprotective Mechanisms beyond Glycemic Control. Int J Mol Sci. 2021 Apr 22;22(9):4374. doi: 10.3390/ijms22094374.
- 17. Toyoki D, Shibata S, Kuribayashi-Okuma E, Xu N, Ishizawa K, Hosoyamada M, Uchida S. Insulin stimulates uric acid reabsorp-tion via regulating urate transporter 1 and ATP-binding cassette sub-family G member 2. Am J Physiol Renal Physiol. 2017 Sep 1;313(3):F826-F834. doi: 10.1152/ajprenal.00012.2017.
- 18. Chen Y, Zhao Z, Li Y, Li L, Jiang Y, Cao Y, Zhou P, Wu T, Pang J. Characterizations of the Urate Transporter, GLUT9, and Its Potent Inhibitors by Patch-Clamp Technique. SLAS Discov. 2021 Mar;26(3):450-459. doi: 10.1177/2472555220949501.
- 19. Bailey CJ. Uric acid and the cardio-renal effects of SGLT2 in-hibitors. Diabetes Obes Metab. 2019 Jun;21(6):1291-1298. doi: 10.1111/dom.13670.
- 20. Chino Y, Kuwabara M, Hisatome I. Factors Influencing Change in Serum Uric Acid After Administration of the Sodium-Glu-cose Cotransporter 2 Inhibitor Luseo- gliflozin in Patients With Type 2 Diabetes Mellitus. J Clin Pharmacol. 2022 Mar;62(3):366-375. doi: 10.1002/jcph.1970.
- 21. Sánchez-Briales P, Marques Vidas M, López-Sánchez P, López-Illázquez MV, Martín-Testillano L, Vedat-Ali A, Portolés J. The Uricosuric Effect of SGLT2 Inhibitors Is Maintained in the Long Term in Patients with Chronic Kidney Disease and Type 2 Diabetes Mellitus. J Clin Med. 2024 Feb 27;13(5):1360. doi: 10.3390/jcm13051360.
- 22. Zhao Y, Xu L, Tian D, Xia P, Zheng H, Wang L, Chen L. Effects of sodium-glucose co-transporter 2 (SGLT2) inhibitors on serum uric acid level: A meta-analysis of randomized controlled trials. Diabetes Obes Metab. 2018 Feb;20(2):458-462. doi: 10.1111/dom.13101.
- 23. Lu YH, Chang YP, Li T, Han F, Li CJ, Li XY, Xue M, Cheng Y, Meng ZY, Han Z, Sun B, Chen LM. Empagliflozin Attenuates Hyperuricemia by Upregulation of ABCG2 via AMPK/AKT/CREB Signal-ing Pathway in Type 2 Diabetic Mice. Int J Biol Sci. 2020 Jan 1;16(3):529-542. doi: 10.7150/ijbs.33007.
- 24. Serra HA, Suárez Cordo C, Alvariñas J, Bragagnolo JC, Frechtel G, Cean P, Folino C, Dagum A, Salzberg S. 2017. Cellular drugs transporters. The journey of the oral antidiabetics agents through the organism. Revista de la Sociedad Argentina de Diabetes Vol. 51 N°4: 137-152. doi:
- 25. Vila SN, Serra HA. Efectos nefroprotectores y uricosúricos de las gliflozinas: Resultados de una revisión sistemática.
- 26. Wanner C, Inzucchi SE, Lachin JM, Fitchett D, von Eynatten M, Mattheus M, Johansen OE, Woerle HJ, Broedl UC, Zinman B; EMPA-REG OUTCOME Investigators. Empagliflozin and Progression of Kidney Disease in Type 2 Diabetes. N Engl J Med. 2016 Jul 28;375(4):323-34. doi: 10.1056/NEJMoa1515920.
- 27. Davies MJ, Trujillo A, Vijapurkar U, Damaraju CV, Meininger G. Effect of canagliflozin on serum uric acid in patients with type 2 diabetes mellitus. Diabetes Obes Metab. 2015 Apr;17(4):426-9. doi: 10.1111/dom.12439. Epub 2015 Feb 15. Erratum in: Diabetes Obes Metab. 2015 Jul;17(7):708. doi: 10.1111/dom.12497.







No comments! Be the first commenter?