Etoricoxib,unarevisióndesuscaracterísticasfarmacológicasy terapéuticas
Resumen
Los COXIB fueron desarrollados y comercializados a fines del siglo XX como respuesta a la necesidad de contar con AINE mejor tolerados a nivel digestivo. Sin embargo, pronto surgieron controversias respecto de su seguridad cardiovascu- lar lo que condujo a la suspensión de la comercialización de varios de ellos. El etoricoxib conservó su estatus comercial, pero con advertencias estrictas. Los metaanálisis posteriores de ensayos clínicos sobre seguridad y eficacia demostraron que el etoricoxib no era diferente a otros AINE cuando se em- pleaba a largo plazo. Siendo que es rápido, tolerado y efectivo puede ser uno de los mejores AINE en tratamientos cortos analgésicos y antiinflamatorios. Este artículo relata los hallaz- gos más salientes sobre seguridad y efectividad del etoricoxib con el objeto de que el médico tratante lo pueda prescribir racionalmente.
Palabras clave
Etoricoxib – COXIB – AINE – Dolor – Analgésicos.
Introducción
El dolor es uno de los motivos principales, sino el principal, de consulta médica (1). Sin embargo, la demanda de una rápi- da solución a esta manifestación es mucho más grande y con- duce inexorablemente al consumo, incluso sin esperar la pres- cripción, de antiinflamatorios no esteroides o AINE. Preparados con efecto AINE se conocen desde tiempos hipocráticos, pero su purificación y síntesis durante los siglos XIX y XX amplió su uso, sobre todo porque los analgésicos opioides, al causar far- macodependencia, resulta medicación restringida (2, 3).
Los AINE fueron la única medida terapéutica para el con- trol del dolor y la inflamación crónica propias de la artrosis y las enfermedades autoinmunes hasta el advenimiento de los corticoides y otras terapias más revolucionarias en la segunda mitad del siglo XX, que atacan no solo los síntomas, sino que modifican o retardan su evolución (3). Dentro de las principa- les causas de dolor crónico están la artrosis y las algias de co- lumna. Respecto de la artrosis el paracetamol aparece como terapia de primera elección, aunque muchas veces no es efi- caz (1,4). Respecto de la lumbalgia y otros dolores de colum-
Miceli MB, Serra HA. “Etoricoxib, una revisión de sus características farmacológicas y terapéuticas”. Analgesia y manejo del Dolor 2025;1:14-22. Puede consultar otros artículos publicados por los autores en la revista Analgesia y manejo del Dolor en sciens.com.ar
na los AINE se muestran efectivos pero el número necesario de pacientes a tratar resulta alto y la intolerancia digestiva es la principal limitante de su empleo (5). Esto demuestra que los resultados alcanzados hoy por hoy no son satisfactorios y es necesario seguir investigando nuevos fármacos.
La evolución AINE justamente ha implicado el desarrollo de una profusa cantidad de sustancias para mejorar el perfil de se- guridad y en especial subsanar la intolerancia digestiva. Y aun- que la velocidad evolutiva ha mermado en parte por la irrupción de la terapia biológica, los AINE son todavía necesarios como primera línea analgésica en dolores nociceptivos, en terapias antiinflamatorias cortas y como antifebriles a demanda.
Luego de la descripción del mecanismo de acción de los AINE como inhibidores de la enzima ciclooxigenasa o COX responsable de la síntesis de prostaglandinas (uno de los me- diadores no preformados de la fase aguda de la fiebre y la in- flamación) una nueva fase de tal evolución dio inicio y así, un mejor conocimiento molecular produjo los COXIB, inhibidores claramente diferenciales de la isoforma 2 de la COX (6, 7).
En efecto, los COXIB inhiben la COX-2 casi exclusivamente, a diferencia de otros AINE como los salicilatos, la indometa- cina o el piroxicam que bloquean ambas isoformas. Siendo la COX-2 la que aumenta masivamente tanto en cantidad como en actividad durante el proceso inflamatorio, los COXIB resul- tarían de elección porque no influyen sobre la producción de prostaglandinas derivadas de la COX-1 que serían responsa- bles de fenómenos homeostásicos como la gastroprotección entre otros (8).
Esto consagró un dogma donde la COX-1 era la isoenzima fisiológica y la COX-2 la isoenzima patológica. Puesto que la fisiopatología y las funciones COX no son lineales, tal dogma no es sostenible y, por ende, la inhibición selectiva o diferen- cial hacia tal o cual isoforma COX no es la clave para evitar aquellos efectos adversos y deletéreos que aparecen ante el uso, especialmente crónico, de cualquier AINE (8, 9). Justa- mente, hemos discutido en el artículo anterior (Serra HA, este número) los motivos por los cuales tanto los AINE selectivos como los no selectivos producen a largo plazo gastroenteropa- tía erosiva y aumento del riesgo de enfermedad cardiovascular isquémica, amén de efectos renales como la retención hídrica que, además de producir edemas de miembro inferior, deter- minan el fracaso de la terapia antihipertensiva.
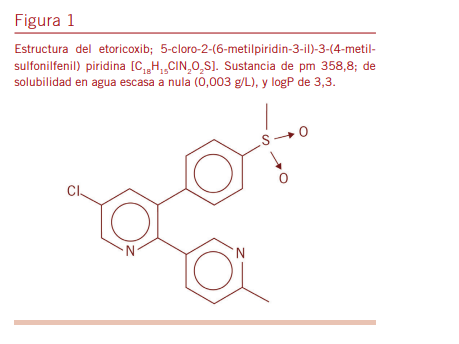
El etoricoxib (10-12) (Figura 1), es uno de los 2 COXIB que resistieron el embate del mencionado dogma sobre la fisiopa- tología COX y por ello, hoy día se encuentra comercializado. Dentro de los AINE disponibles goza de un perfil interesante que lo hace sumamente útil para ciertas indicaciones. Por ello, es objetivo de este trabajo analizar sus características farmaco- lógicas básicas y clínicas, y haciendo uso de la literatura dispo- nible, compararlo con otros AINE. La idea es concientizar sobre las ventajas y desventajas que este COXIB presenta y lograr un correcto uso terapéutico por parte de los profesionales de la salud en aquellas patologías hacia las que está dirigido.
El bolsillo lateral de la COX-2 como blan- co selectivo
Las COX son isoenzimas diméricas de las membranas del retículo endoplásmico y envoltorio nuclear ubicadas hacia su
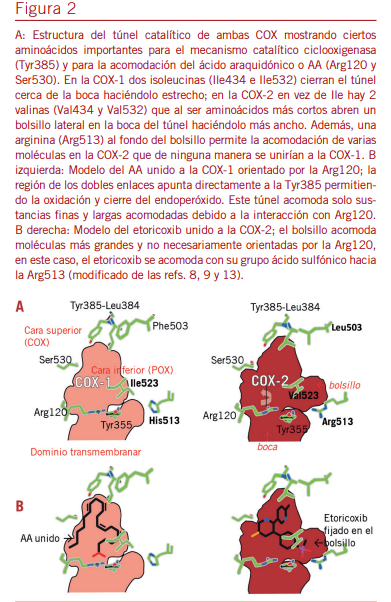
lumen (9) que catalizan el primer paso de la conversión del ácido araquidónico, AA o eicosatetraenoico (el ácido poliinsa- turado más abundante en los fosfolípidos de membrana) en prostaglandinas y tromboxanos (8, 9,1 3). Ambas isoformas fueron identificadas y clonadas en la última década de siglo pasado (14, 15) y guardan un 60-65% de homología espe- cialmente en lo que respecta a su región catalítica, un túnel de unos 0,25 nm formado por una mayoría de aminoácidos hi- drofóbicos que orientan y alojan el AA. Los aminoácidos clave tirosina Tyr385 (catalítico), arginina Arg120 (fijador) y serina Ser530 (limitante) están ubicados igual en ambas isoformas. En cambio, dos isoleucinas Ile434 e Ile532, aminoácidos hi- drofóbicos y voluminosos presentes en la región del cuello del túnel en la COX-1, son reemplazados en la COX-2 por dos valinas, aminoácidos más chicos que permiten la formación de un bolsillo lateral (8). En suma, el túnel de la COX-1 es fino y corto, mientras que el de la COX-2 en ancho y un poco más largo (Figura 2A).
Como hemos comentado en el artículo precedente (Serra HA, este número), las COX son enzimas bifuncionales, es de- cir exhiben doble actividad catalítica para transformar el AA en los endoperóxidos cíclicos, PGG2 y PGH2. El AA se posicio-
na en el túnel catalítico gracias a la Arg120 y allí el sitio COX
(en la pared superior del túnel) lo oxigena y lo cicla transfor- mándolo en la PGG2 por acción de la Tyr385; luego el sitio peroxidasa o POX (en la pared inferior) remueve el exceso de O2 formando la PGH2, un poco más estable, debido al grupo hemo (9).
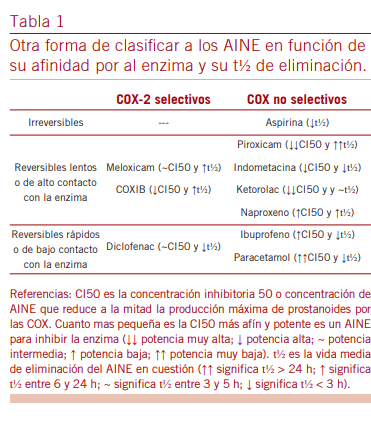
Los AINE son un remedo del AA, por consiguiente, son fal- sos sustratos inhibidores competitivos de las COX. Como el túnel de la COX-2 más amplio que el de la COX-1 permiti- ría el giro de ciertos AINE que pueden acomodarse mejor y esto explicaría la existencia de más moléculas selectivas o preferenciales por la COX-2 que por la COX-1 (13). Varios autores han tratado de caracterizar la cinética de inhibición de cada isoforma por los distintos AINE (9, 16) pero al ser determinaciones in vitro no tienen en cuenta la permanencia del fármaco en el organismo. Entonces, la inhibición in vivo dependerá tanto de la afinidad que el AINE exhibe por cada isoforma (cuantificada por la CI50 o concentración que inhibe el 50% de la capacidad formadora de prostaglandinas) como
de su vida media de eliminación (t½ elim) del organismo. Es decir que aquellos con alta afinidad y t½ elim larga quedan en contacto con las COX mucho tiempo, mientras que aquellos con baja afinidad o t½ elim pequeña no lo hacen. Un caso particular es la aspirina pues por su gran reactividad inactiva permanentemente a la enzima, al transferir su grupo aceti- lo a la Ser530 genera un impedimento estérico que no deja encajar al AA (17). En base a lo descripto, proponemos que los AINE además de su selectividad por cada COX pueden ser (Tabla 1): inhibidores irreversibles; inhibidores reversibles lentos o de alto contacto enzimático, e inhibidores COX rever- sibles rápidos o de bajo contacto.
El etoricoxib es uno de los AINE más selectivos por la COX- 2 con una CI50 de 100 a 1 en favor de la COX-2 es incluso superior a otros COXIB (10). El amplio bolsillo lateral de la COX-2 le permite acomodar su grupo sulfanílico y su tercer anillo, mientras que tal disposición espacial directamente no cabe en la COX-1 por lo que su unión a esta isoforma es casi nula (Figura 2B).
Acciones farmacológicas del etoricoxib una oportunidad terapéutica
El etoricoxib ejerce sus acciones antiinflamatorias, analgé-
sicas y antifebriles como resultado de la inhibición selectiva COX-2, enzima que se halla inducida al máximo por acción del cuadro inflamatorio. Debemos recordar que para todo AINE la acción antifebril y los efectos adversos cardiorrenales son directos, es decir derivados de la inhibición COX, pero que las acciones antiinflamatorias, analgésicas y otros efectos adversos dependen de mecanismos adicionales tales como el shunt del AA, la inhibición del estallido respiratorio, la activa- ción PPAR y la interacción con canales iónicos (18-21).
Como antiinflamatorio, el etoricoxib es uno de los mejores AINE, pues posee alta potencia y exhibe un perfil que hizo que las agencias de control de medicamento lo hayan apro- bado en para uso crónico bajo estricta supervisión médica en artrosis, artritis reumatoidea y espondilitis anquilosante (12, 22). Es de destacar que tal selección se basa no solo en la seguridad gástrica, sino que en estas afecciones el etoricoxib es protector del cartílago (23) e inhibe adicionalmente el es- tallido respiratorio, al parecer por intervenir sobre los PPAR, pudiendo actuar sinérgicamente con otros tratamientos como agentes biológicos o glucocorticoides. Fuera de esas tres indi- caciones, p ej., situaciones de inflamación aguda tales como traumatismos, discopatías, crisis gotosa o en deportología el etoricoxib solo debe ser usado en tratamientos cortos (no más de una semana) o a demanda (esporádico).
Como analgésico rápido por vía oral, el etoricoxib es equiva- lente al ketorolac tanto en potencia como en inicio de acción ya que la dosis y el tmax de ambos están dentro del mismo rango, pero a diferencia del ketorolac tiene una t½ elim mayor por lo que se administra en una única toma diaria (24, 25) (ver Tabla 1). Por ello, puede ser usado tranquilamente como analgésico postquirúrgico o en odontología. Aquí debemos destacar que la indicación a demanda es la más común, pero en los procesos dolorosos agudos un tratamiento de tres días consecutivos suele ser suficiente para abortarlo. Dentro de los mecanismos adicionales analgésicos que exhibiría este fár- maco se describe el shunt del AA hacia los hidroperoxiácidos (12-HPETE) en la médula y a lo largo de las vías espinotála- micas como posible el responsable ya que genera hiperpola- rización neuronal K+ dependiente y potencia los mecanismos opioides endógenos (19).
Distintos metaanálisis muestran que los AINE COX-2 se- lectivos son equivalentes a los no selectivos en el alivio sintomático de la inflamación y el dolor en afecciones crónicas como artrosis o artritis reumatoidea pero mejores en cuanto a tolerabilidad gástrica sobre todo en los primeros meses de tratamiento. No obstante, cuando los tratamientos deben prolongarse aparecen sustanciales diferencias en cuanto a la seguridad general, la tolerabilidad gastrointestinal y el riesgo de enfermedad cardiovascular entre los todos AINE sin importar su selectividad COX. Esto determina el optar por uno u otro AINE en función de las comorbilidades de los pacientes para lograr un balance entre una mejor calidad de vida y los costos en salud que estas patologías imponen. En lo que respecta al etoricoxib, el metaanálisis de Chen y colaboradores (26) efectuado sobre 93 ensayos clínicos con diferentes AINE incluyó unos 4700 pacientes provenientes de 7 ensayos clínicos aleatorizados con este COXIB vs. placebo u otros AINE; tal análisis mostró que el uso de etoricoxib durante 3 meses en dosis de 60 a 120 mg/día fue superior al placebo e igualmente eficaz al naproxeno, diclofenac o ibuprofeno
en pacientes con artrosis y artritis reumatoidea.
En sintonía, el metaanálisis de red de da Costa y colabora- dores (27) sobre 76 ensayos clínicos aleatorizados efectuados con diferentes AINES incluyó unos 3950 pacientes también de 7 estudios (3 incluidos en el metaanálisis anterior) trata- dos con etoricoxib, y concluyó que el COXIB en dosis de 60 mg/día durante 3-4 meses es tan eficaz como el diclofenac en dosis de 150 mg/día para el tratamiento del dolor en pacientes con artrosis de cadera y de rodilla.
Por último, la conclusión de otro metaanálisis de red del grupo de da Costa (28) sobre 192 ensayos clínicos aleatorizados que incluían AINE tópicos y orales y opioides orales empleados para el control del dolor en artrosis de cadera y rodilla, fue que el etoricoxib en dosis de 60 mg/día y el diclofenac en dosis de 150 mg/día por vía oral serían los AINE más eficaces, pero no serían los más apropiados en presencia de otras patologías concomitantes o para uso diario a muy largo plazo dado el leve aumento del riesgo de efectos adversos asociado a ambas drogas; adicionalmente otra conclusión del metaanálisis fue que el beneficio clínico del tratamiento con opioides no es mayor al riesgo que puede generar su uso, lo que implica atribuir como mejor alternativa analgésica en la artrosis a los AINE mencionados.
Es importante señalar que, aunque haya cierta igualdad en cuanto a efectividad (no así en cuanto a potencia), el diclo- fenac y otros AINE deben administrarse por lo menos dos o tres veces por día para obtener un mejor efecto analgésico y mejorar la rigidez propia de la artrosis, cosa que no ocurre con etoricoxib puesto que requiere solo una toma. Lamentable- mente, el número de ensayos efectuados con este COXIB (lo que deriva también en un uso poblacional más limitado) y la falta de comparación con otros AINE de amplio uso en artrosis del adulto mayor como meloxicam o paracetamol impide obtener una mejor estimación del efecto de etoricoxib frente a todos los AINE utilizados en esta patología o sobre la evolución de la propia enfermedad.
En artritis gotosa aguda el metaanálisis de Zhang y colaboradores (29) incluyó 851 pacientes de 6 ensayos clínicos aleatorizados comparativos contra diclofenac e indometacina. Tras 5-8 días de tratamiento con etoricoxib fue superior al tratamiento con los dos otros AINE en cuanto efectividad analgésica medida por una escala visual analógica (diferencia de medias: -0,46; IC95: -0,51 a -0,41; p < 0,00001), pero no en cuanto a signos de inflamación (edema y rigidez). Como se indicará en el punto siguiente, el etoricoxib fue mejor tolerado que los otros AINE, esto demuestra la solidez del fármaco como analgésico-antiinflamatorio en tratamientos cortos y a demanda.
La seguridad del etoricoxib, que hacer y que no
Seguridad gastrointestinal
Los efectos adversos gastrointestinales pueden ocurrir en
cualquier parte del tubo digestivo y suelen diferenciarse de
acuerdo con el tiempo de aparición en, agudos gastroduodenales debidos a una falta de citoprotección, y crónicos gastroentéricos debidos a la presencia de microtrombos en la circulación capilar mucosa (30). De acuerdo con esto, en pacientes sin antecedentes gastrointestinales el uso de un COXIB, solo o junto con inhibidores de la bomba de protones, no produce manifestaciones agudas porque no afecta la citoprotección. Y así lo demostró el metaanálisis de Zhang y colaboradores (29) en artritis gotosa aguda cuyas tasas no corregidas de eventos gastrointestinales fueron menores con etoricoxib que con diclofenac o indometacina (0,05 vs. 0,13; RR: 0,42; IC95: 0,27-0,66; p < 0,0002). No obstante, a largo plazo podrían aparecer erosiones en la mucosa intestinal sin o con sangrado oculto por materia fecal y anemia hipocrómica crónica. El programa MEDAL (Multinational Etoricoxib and Diclofenac Arthritis Long-term) (31,32) fue diseñado en tres ensayos para demostrar la no inferioridad de etoricoxib frente a diclofenac y estudiar la seguridad digestiva y cardiovascular de ambas drogas cuando son empleadas a largo plazo en pacientes con artrosis y artritis reumatoidea. Para este programa fueron enrolados y aleatorizados un total de 34701 pacientes mayores de 50 años (correspondiendo unos 17412 al grupo etoricoxib y 17289 al grupo diclofenac). Los resultados de seguridad gastrointestinal mostraron que las tasas de eventos en el tubo digestivo superior (perforación, sangrado, obstrucción, úlcera) fueron menores con etoricoxib que con diclofenac (0,67 vs. 0,97 cada 100 pacientes-año respectivamente; cociente de riesgo o HR: 0,69; IC95 0,57-0,83 p < 0,00001) aunque las tasas de eventos complicados fueron similares con ambos AINE (0,30 vs. 0,32). Sin embargo, las tasas de eventos en el tubo digestivo inferior, si bien menores, fueron iguales para ambas drogas (0,32 vs. 0,38 cada 100 pacientes-año; HR: 0,84; IC95: 0,63-1,13; ns). Ajustando las covariables se demuestra que la edad > 65 años y los antecedentes de lesión intestinal previa son factores de riesgo independientes para el desarrollo de estas manifestaciones. Esto refuerza el concepto que a largo plazo cualquier AINE
puede causar daño intestinal. El metaanálisis de Feng y colaboradores (33) sobre seguridad gastrointestinal a corto y largo plazo de etoricoxib incluyó
unos 26000 pacientes con artrosis o artritis reumatoidea provenientes de 9 ensayos clínicos aleatorizados que compararon etoricoxib contra placebo o algunos AINE. La duración usual de la mayoría fue de 3 meses, aunque en 3 de ellos el segui- miento fue de un año o más y en todos ellos los pacientes que lo necesitaban podían recibir aspirina a bajas dosis. Este metaanálisis se centró en la comparación de etoricoxib y pla- cebo (riesgo relativo o RR: 0,99; IC95 0,75-1,31: ns), etori- coxib y diclofenac (RR: 0,67; IC95 0,59-0,76; p < 0,00001), y etoricoxib y naproxeno, (RR: 0,59; IC95 0,48-0,72; p < 0,00001). Según estos resultados, el riesgo de ocurrencia de manifestaciones gastrointestinales fue similar entre etoricoxib y el placebo, y significativamente menor para etoricoxib cuan- do se lo compara con los otros dos AINE.
En suma, aunque el etoricoxib exhibe una excelente tolera- bilidad digestiva (sobre todo en el aparato digestivo superior y en tratamientos cortos), todo profesional tratante deberá estar advertido sobre los antecedentes y comorbilidades que presenten los pacientes, pues la patología ulcerosa previa, la infección por H pylori, el uso simultáneo de glucocorticoides, la edad de los pacientes superior a 65 años y el alcoholismo pueden potenciar la aparición de manifestaciones gastrointes- tinales severas y/o complicadas (34, 35).
Seguridad renal y cardiovascular
Ya hemos descripto en el artículo precedente (Serra HA, este número) que el consumo crónico de AINE tanto selecti- vos como no selectivos suele producir retención hídrica y ede- mas debido a la interferencia con el funcionalismo renal, pero también incrementar levemente la presión arterial y reducir la eficacia antihipertensiva de b bloqueantes, diuréticos o vaso- dilatadores directos (22,36). Aunque el aumento es leve, es también sostenido, lo que puede aumentar el riesgo de pa- decer fenómenos tromboembólicos o enfermedad isquémica. Debe recordarse los COXIB carecen de efectos antiagregantes por lo que pueden aumentar tal riesgo aún más, tal como in- formaron los metaanálisis de Kearney y McGettigan (37, 38). Sin embargo, específicamente para etoricoxib, estos metaaná- lisis no fueron concluyentes.
La razón por la cual los estudios clínicos con etoricoxib pro- porcionan datos limitados radicaría en que no fueron diseñados con el poder estadístico necesario para evaluar los potenciales riesgos cardiovasculares. Tal fue la conclusión del metaanálisis de Aldington y colaboradores (39) que analizó 2919 pacien- tes provenientes de 5 ensayos clínicos aleatorizados de por lo menos 6 semanas de duración que comparaban etoricoxib vs. placebo. Registraron 7 eventos tromboembólicos cardiovascu- lares en 1441 pacientes tratados con etoricoxib (0,5%) y solo uno en 906 pacientes que recibieron placebo (0,1%). El odds ratio u OR calculado para el riesgo de eventos cardiovasculares con etoricoxib fue 1,49; IC95: 0,42-5,31. Si bien este OR no es significativo, está mostrando una tendencia menos favorable para el COXIB ya que es mayor que 1 (estaría indicando que el riesgo de enfermedad isquémica es de 0,4 a 5 veces superior con él). La importancia de esta comparación es que permitió ver el riesgo cardiovascular puro del COXIB.
El metaanálisis de Chen y colaboradores (26) señaló que la
seguridad cardiovascular del etoricoxib fue similar al naproxe- no y que el RR para padecer infarto de miocardio al compararlo con diclofenac fue 1,58; IC95 0,06-38,66. En este caso tam- bién el RR no es significativo y muestra la tendencia menos favorable para el COXIB. Aquí resulta interesante comparar los
valores de riesgo cardiovascular obtenidos en este (RR: 1,58) y en el anterior (OR: 1,49) metaanálisis puesto que pareciera que frente al etoricoxib, el diclofenac sería similar al placebo (es decir, pareciera que carece de riesgo cardiovascular, cosa que los metaanálisis de Kearney y McGettigan no mostraron). El programa MEDAL (31) mostró resultados un poco más benignos; durante el tratamiento a 18 meses, 320 pacien- tes del grupo etoricoxib y 323 del grupo diclofenac padecie- ron efectos adversos trombóticos, las tasas correspondientes fueron prácticamente iguales (1,24 y 1,30 por 100 pacien- tes-año respectivamente; así su HR: 0,95; IC95 0,81-1,11; fue no significativo). Este estudio calculó la diferencia abso- luta en las tasas de eventos entre tratamientos (–0,07 eventos por 100 pacientes-año; IC95: –0,26 a 0,13) lo que permitió estimar mejor el riesgo de daño: sobre la base de su IC95 el etoricoxib podría asociarse con una disminución neta de 1,3 eventos por cada 1000 pacientes tratados durante un año en
comparación con diclofenac.
En suma, por todo lo indicado, el médico tratante no de- bería temer la posibilidad de mayor riesgo cardiovascular con etoricoxib en pacientes sin comorbilidades y haciendo una co- rrecta prescripción; pero debe evitar su uso crónico en pacien- tes de riesgo como los que presentan insuficiencia cardíaca e hipertensión arterial moderada a severa, pues cualquier AINE puede causar retención hídrica y al hacerlo agravar estos cua- dros. Debe considerar también que la población anciana es un grupo de riesgo de padecer insuficiencia renal funcional por consumo de AINE, pues pueden estar padeciendo varias comorbilidades que afectan al riñón a la vez que se deshidra- tan fácilmente (en estos casos convendría elegir un AINE de t½ inferior a 4 h -que no es el caso del etoricoxib- y rehidratar siempre). Finalmente, debe considerar que los AINE ácidos pueden causar hiperuricemia o bien uricosuria por lo que el exceso de urato en orinas ácidas puede precipitar y causar nefropatía obstructiva.
Efectos adversos reportados en la información para la prescripción
Este es un resumen de las reacciones adversas medicamen- tosas (RAM) o efectos adversos aparecidos durante el uso de etoricoxib (22). Esta información deriva de los ensayos clíni- cos realizados durante las etapas de investigación clínica, de los estudios post comercialización de fase IV y de los reportes de farmacovigilancia. El figurar en el folleto interior de envase indica que están reconocidos por las agencias regulatorias y es obligatoria su actualización.
El efecto adverso reportado más frecuente (≥ 10%) fue dolor abdominal; le siguieron los frecuentes (de < 10% a ≥ 1%) constipación o diarrea, epigastralgias, ardor de estóma- go, reflujo, náuseas, vómitos, edemas de miembro inferior, hipertensión, palpitaciones, equimosis, cefalea, mareos, as- tenia, broncoespasmo, síndrome pseudogripal y elevación de las transaminasas; los poco frecuentes (de < 1% a ≥ 0,1%) reacciones alérgicas, vértigo, acúfenos, ansiedad, calambres, insuficiencia renal y anemia por sangrado gastrointestinal, y los raros o infrecuentes (< 0,1%) anafilaxia, reacciones cutá- neas tipo Stevens Johnson y discrasias sanguíneas.
Se reportaron casos de sobredosificación aguda (dosis su- periores a 500 mg/vez) con sintomatología gastrointestinal inespecífica sin repercusión clínica evidente.
Interacciones medicamentosas
Antiácidos (22): Las sales de aluminio o magnesio no afec- tan significativamente la farmacocinética del etoricoxib.
Anticoagulantes orales cumarínicos (ACO) (22, 40): La admi- nistración de 120 mg diarios de etoricoxib a pacientes bajo tratamiento crónico con warfarina produjo a un aumento del RIN con el consiguiente mayor riesgo de hemorragia. Esta in- teracción se produce por un aumento brusco de la fracción libre del ACO al ser desplazado masivamente de la albúmina por cualquier AINE ácido (incluido el etoricoxib). Por lo tanto, debe ajustarse la dosis del ACO y supervisar estrechamente el RIN si se emplease etoricoxib en estos pacientes, especial- mente al iniciar su tratamiento o al modificar su dosis.
Anticonceptivos orales y terapia de reemplazo estrogénica (TRE) (22, 41): La administración simultánea de 60 mg de etoricoxib y un anticonceptivo oral (conteniendo 35 μg de eti- nilestradiol y 0,5-1 mg de noretisterona) durante 21 días au- mentó el área bajo la curva en estado estacionario (AUC) del estrógeno un 37%. Asimismo, la administración de 120 mg de etoricoxib y el mismo anticonceptivo en forma simultánea o separados por 12 h aumentó el AUC del etinilestradiol un 50- 60%. Por otra parte, la administración de 120 mg de etorico- xib junto con estrógenos conjugados (0,625 mg) durante 28 días aumentó el AUC de sus componentes (17-b-estradiol un 22%, estrona un 41% y equilina un 76%). Esta interacción se debe a que el etoricoxib inhibe la actividad de las sulfotransfe- rasas (en especial la SULT1E1) responsables del metabolismo de los estrógenos. Debe tenerse en muy cuenta este fenómeno y evitar el empleo de anticonceptivos orales conteniendo etini- lestradiol junto con etoricoxib (o viceversa) ya que un aumento de la exposición estrogénica puede aumentar la incidencia de tromboembolismo venoso, generar migraña y causar reten- ción hídrica, y adicionalmente, estas manifestaciones pueden agravarse por el tratamiento crónico con etoricoxib. Tampoco debería usarse etoricoxib en pacientes bajo TRE a fin de evitar los acontecimientos adversos relatados.
Aspirina y otros AINE (22, 33): El etoricoxib puede utilizarse simultáneamente con aspirina a dosis antiagregantes (80-100 mg/día), de hecho, en los ensayos clínicos sobre seguridad y eficacia de etoricoxib se permitía en aquellos pacientes en la que era necesaria la terapia antiagregante. No obstante, el médico debe saber que este uso conjunto puede favorecer la aparición de daño gastroduodenal u otras complicaciones gas- trointestinales que usualmente no se observan si se emplea etoricoxib solo. Por ello, no se recomienda la administración simultánea de etoricoxib con otros AINE o con aspirina a dosis mayores que las antiagregantes.
Ciclosporina y tacrolimus (22): A pesar de que esta interac- ción no fue comprobada con etoricoxib, la administración con- junta de ciclosporina o tacrolimus con cualquier AINE puede aumentar el efecto nefrotóxico de estos inmunosupresores. Cuando se administre de forma conjunta etoricoxib (sobre todo en forma crónica) y alguno de estos fármacos, se debe supervisar estrictamente la función renal de estos pacientes, y de ser necesario, no usar el COXIB.
Diuréticos tiazídicos, inhibidores de la enzima convertidora de angiotensina (IECA) y antagonistas de la angiotensina II (ARA2) (22, 36): Los AINE pueden reducir el efecto de estos agentes antihipertensivos. Asimismo, en individuos con función renal
menoscabada, adultos mayores (70 años o más) o deshidra- tados la administración conjunta de IECA o ARA2 con AINE puede provocar mayor deterioro de la función renal (incluso insuficiencia renal aguda) que suele ser reversible. Lo dicho debe tomarse en consideración a fin de evitar el uso crónico de etoricoxib en estas personas; de no ser posible, evaluar la función renal al inicio de tratamiento y en forma periódica durante este, y tener al individuo hidratado y bajo estricta supervisión médica.
Litio (18, 22): Todo AINE disminuye la excreción renal de li- tio y aumenta la litemia (con riesgo de intoxicación aguda por litio); por ello, debe evitarse el uso de etoricoxib en pacientes que están recibiendo el catión. En caso de empleo necesario, se debe supervisar estrechamente la litemia (y ajustar corres- pondientemente la dosis de litio) durante la duración del tra- tamiento conjunto.
Metotrexato (22, 42): Dos estudios investigaron los efectos de las dosis de 60, 90 o 120 mg de etoricoxib, administradas una vez al día durante siete días, en pacientes con artritis reu- matoide que estaban recibiendo adicionalmente una dosis se- manal de 7,5-20 mg de metotrexato. Las dosis de 60 y 90 mg de etoricoxib no mostraron ningún efecto sobre las concentra- ciones plasmáticas de antifólico o sobre su eliminación renal. Pero en un estudio con dosis de 120 mg se vio un aumento de las concentraciones plasmáticas de metotrexato y una re- ducción de su clearance renal (28 y 13% respectivamente). Por consiguiente, cuando se administre de forma simultánea metotrexato y etoricoxib, especialmente a dosis más altas, se recomienda supervisar adecuadamente al paciente en busca de toxicidad relacionada con metotrexato.
Prednisona/prednisolona y otros glucocorticoides (43): El riesgo de aparición de manifestaciones gastrointestinales au- menta 2,5 a 3 veces si se usan AINE y glucocorticoides simul- táneamente que si se usan solos. Por consiguiente, si bien el etoricoxib exhibe menores efectos agudos a nivel gastrointes- tinal superior, su uso con glucocorticoides debe ser estricta- mente supervisado por si aparecen tales manifestaciones.
Interacciones a nivel del metabolismo del etoricoxib (22, 25): La vía metabólica principal del etoricoxib es su oxidación por el CYP3A4 y en menor medida por los CYP2D6, 2C9, 2C19 y 1A2 (aunque la contribución de cada uno no se estudió cuantitativamente in vivo). Así, los azoles antifúngicos (keto- conazol, voriconazol y miconazol) potentes inhibidores CYP, incrementan el AUC de etoricoxib, interacción que carece de importancia clínica. Por otro lado, la rifampicina, gran in- ductor CYP, produjo una disminución de las concentraciones plasmáticas del COXIB un 65%, interacción que es relevante porque obliga a aumentar la dosis de etoricoxib para obtener un efecto terapéutico aceptable. El efecto de otros inhibidores o inductores CYP sobre la farmacocinética del etoricoxib no ha sido estudiado. Estudios in vitro mostraron que el etoricoxib no inhibe los CYP1A2, 2C9, 2C19, 2D6, 2E1 o 3A4, y un estudio realizado en voluntarios sanos señaló que la adminis- tración diaria de 120 mg de etoricoxib no modifica la activi- dad hepática del CYP3A4. De todo lo antedicho surge como recomendación no usar el etoricoxib junto a inductores CYP como rifampicina, fenobarbital, carbamazepina, fenitoína o hierba de San Juan so pena de perder efecto antiinflamatorio y/o analgésico.
Uso clínico del etoricoxib, como prescri- birlo racionalmente y como sugieren su uso las agencias regulatorias
Indicaciones y dosis
Por prospecto (on label) (22) es la forma en que las agen- cias regulatorias del medicamento en los distintos países aceptan y avalan la prescripción y uso de un fármaco conteni- do en una especialidad medicinal. En general, hay una armo- nización internacional para la prescripción de los productos farmacéuticos entre los países del primer mundo y que son aceptados por la mayoría de los demás. Fuera de prospecto (off label) son usos empíricos de un fármaco contenido en una especialidad medicinal no aceptados totalmente por las autoridades sanitarias de los países.
On label, el etoricoxib se indica en adultos y adolescentes
a partir de 16 años para el alivio sintomático de la artrosis, la artritis reumatoide, la espondilitis anquilosante solo o asocia- dos a otras medidas terapéuticas de rigor. También se indica el dolor e inflamación asociados a la artritis gotosa aguda y el dolor moderado asociado a cirugía dental.
Para la artrosis la dosis usual es de 30-60 mg en una única toma diaria. Para la artritis reumatoide y la espondilitis an- quilosante la dosis usual es de 60-90 mg en una única toma diaria. En estos casos la duración del tratamiento no tiene un límite preciso, aunque el tiempo máximo de los ensayos fue 18 meses. Si con las dosis máximas mencionadas no se logra el beneficio esperado, deberá considerarse otra opción tera- péutica puesto que el riesgo cardiovascular puede aumentar con la duración del tratamiento.
En la artritis gotosa aguda (crisis gotosa aguda) la dosis re- comendada es 120 mg en una toma diaria por 7-8 días junto con otras medidas de rigor. En el dolor postoperatorio odon- tológico la dosis recomendada es 90 mg en una toma diaria durante no más de 3 días, aunque algunos pacientes podrían necesitar adicionalmente otro analgésico durante este tiempo. En otras situaciones de dolor agudo, únicamente debe utili- zarse etoricoxib a demanda durante el episodio.
Las dosis superiores a las recomendadas para cada indi- cación no han demostrado una eficacia adicional o no han sido lo suficientemente estudiadas. Por lo tanto, nunca debe- rá prescribirse el etoricoxib en dosis mayores a las máximas recomendadas.
Off label, el etoricoxib suele emplearse para el control del dolor agudo nociceptivo originado en lesiones deportivas, traumatológicas y quirúrgicas, en dosis de 30-90 mg en una única toma diaria sea a demanda o por períodos de 7 días.
Aparte de los usos anteriores, el etoricoxib fue estudiado como analgésico en dismenorrea comparándolo con naproxe- no, ibuprofeno y ácido mefenámico. Estos AINE de venta libre resultan el tratamiento clásico, pero deben ser administrados 3 a 4 veces por día. Han sido efectuados varios ensayos clíni- cos aleatorizados comparativos con bajo número de pacientes y algunos de calidad dudosa (44-47); sin embargo, parece que todavía no fueron suficientes para avalar esta indicación on label. La dosis de etoricoxib empleada fue 120 mg una vez por día y la duración de los tratamientos osciló entre 3 días y 2 meses según los protocolos. Los resultados mostraron la
superioridad del COXIB en el control de los síntomas (anal- gesia más sostenida) seguridad (mejor tolerancia digestiva) y adherencia al tratamiento (mayor comodidad al recibir una única toma diaria). Si se indica etoricoxib para dismenorrea el profesional prescriptor deberá advertir a las pacientes que no consuman concomitantemente medicamentos con estrógenos (ver interacciones medicamentosas).
Contraindicaciones
Hipersensibilidad al etoricoxib. Úlcera péptica o hemorra- gia gastrointestinal activas. Asma o alergia a la aspirina. Em- barazo y lactancia. Insuficiencia hepática grave (puntuación
≥ 10 en la escala de Child-Pugh). Insuficiencia renal severa (clearance de creatinina < 30 mL/min). Menores de 16 años. Enteropatía inflamatoria. Insuficiencia cardíaca congestiva (clase II a IV según la NYHA). Hipertensión persistente ma- yor a 140/90 mm Hg o no controlada. Cardiopatía isquémica, arteriopatía periférica o enfermedad cerebrovascular activas.
Uso en poblaciones especiales según prospecto
Pacientes de edad avanzada: La farmacocinética en la pobla- ción de edad avanzada (65 años y mayores) es similar a la de adultos jóvenes, por lo que no es necesario ajustar las dosis de etoricoxib en estos pacientes. Sin embargo, se deben tener presente las comorbilidades y el estado de hidratación de esta población al decidir usar etoricoxib.
Sexo: La farmacocinética del etoricoxib es similar en va- rones y en mujeres; por lo tanto, no es necesario ajustar las dosis de etoricoxib.
Insuficiencia hepática (48): Los pacientes con disfunción hepática leve (puntuación de 5-6 en la escala de ChildPu- gh) que recibieron una dosis diaria de 60 mg de etoricoxib presentaron un AUC aproximadamente un 16 % superior a la de los voluntarios sanos a los que se les administró la misma dosis. Los pacientes con disfunción hepática moderada (pun- tuación de 7-9 en la escala de Child-Pugh) que recibieron una dosis de 60 mg de etoricoxib cada dos días presentaron un AUC semejante a la de los voluntarios a los que se les admi- nistraron 60 mg de etoricoxib una vez al día. No se ha estudia- do la dosis de 30 mg de etoricoxib una vez al día en pacientes con disfunción hepática moderada. No se dispone de datos clínicos ni farmacocinéticos en pacientes con disfunción he- pática grave (puntuación de ≥ 10 en la escala de ChildPugh). En estos casos se recomienda, si la insuficiencia es leve, no ajustar la dosis; si la insuficiencia es moderada, aumentar el intervalo entre dosis al doble; pero si la insuficiencia es grave, su uso está contraindicado.
Insuficiencia renal: La farmacocinética de una dosis única de 120 mg de etoricoxib en pacientes con insuficiencia renal mo- derada o grave no difirió significativamente de la de voluntarios sanos, por lo que no es necesario ajustar las dosis de etoricoxib en estos enfermos. El etoricoxib no se elimina por hemodiálisis por lo tanto está contraindicado en pacientes anúricos.
Embarazo: No existen datos clínicos sobre la exposición de etoricoxib durante el embarazo por lo que se desconocen los riesgos potenciales para el ser humano durante el mismo. Los estudios en animales de experimentación han mostrado toxi- cidad reproductiva y cambios de la fertilidad. El etoricoxib, al igual que otros AINE inhiben la síntesis de prostaglandinas,
puede causar inercia uterina y oclusión prematura del con- ducto arterioso durante el último trimestre de embarazo. Por ello, el etoricoxib está contraindicado durante el embarazo; si una mujer queda embarazada bajo tratamiento con este fár- maco, debe interrumpir inmediatamente dicho tratamiento.
Lactancia: Se desconoce si el etoricoxib se excreta por leche materna, pero sí lo hace en animales de experimentación en lactancia. Por este desconocimiento, se recomienda interrum- pir la lactancia durante el tratamiento con etoricoxib.
Población pediátrica: No se han estudiado la farmacocinéti- ca, la seguridad o la eficacia del etoricoxib en pacientes me- nores de 12 años. Por esta falta de información, el uso de etoricoxib está contraindicado en esta población.
Conclusiones
En este artículo hemos revisado los rasgos farmacológicos y clínico-terapéuticos salientes del AINE etoricoxib, un inhibidor altamente selectivo de la COX-2 o COXIB. Su CI50 y sus dosis lo colocan entre los AINE potentes. Como inhibidor COX-2, al ser empleado en tratamientos cortos resulta un muy buen anti- inflamatorio y analgésico con excelente tolerabilidad digestiva. Sin embargo, al ser usado en tratamientos prolongados pue- de propiciar la aparición de enteropatía ulcerosa y de fenó- menos tromboembólicos, especialmente en pacientes con co- morbilidades particulares y otros factores de riesgo. Por ello, la decisión de prescribir y aconsejar este u otro COXIB deberá basarse siempre en la valoración profesional de todos aquellos
riesgos inherentes al paciente que ha de recibirlo en concor- dancia con las advertencias y contraindicaciones que vienen sosteniéndose a lo largo de esta revisión respetando las dosis máximas definidas.
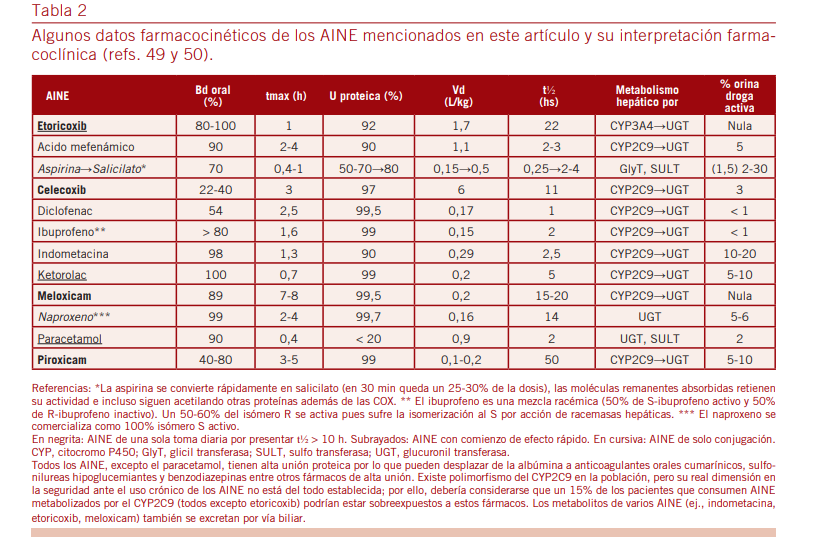
Una muy buena historia clínica farmacológica ayudará a inter- pretar los riesgos y cual puede ser la medicación concomitante que pueda recibir o no el enfermo. La Tabla 2 muestra los rasgos farmacocinéticos salientes de varios AINE y su interpretación clí- nica para un mejor uso comparativo de todos los incluidos en esta revisión; allí se muestra que el etoricoxib puede ser la mejor opción para tratamientos cortos, superior a los otros AINE dispo- nibles, por tolerabilidad, rapidez, eficacia y adherencia.
Y qué le depara el futuro al etoricoxib. La respuesta a esta pregunta es la ampliación de sus indicaciones a otros cuadros inflamatorios y la dismenorrea. Pero ojo, ya que el otro COXIB, el celecoxib, se emplea en patología tumoral y en algunas enfermedades neuropsiquiátricas donde la COX-2 está sobre- expresada (51-53) y el propio etoricoxib está siendo estudia- do en modelos tumorales (54, 55) creemos esta es su línea principal futura.
En definitiva, el etoricoxib es un excelente AINE para las indicaciones aprobadas y tal vez su rasgo más saliente es la comodidad posológica ya que se administra una vez por día. No es de venta libre y ello es una desventaja frente a otros AINE muy conocidos, fácilmente conseguibles por la pobla- ción en general y a la vez consolidados en la práctica por tiempo y costumbre.
Referencias bibliográfícas
- 1. Gatti D, Adami S. Coxibs: A significant therapeutic
opportunity. Acta Biomed 2010; 81: 217-24. - 2. Ozleyen A, Yilmaz YB, Donmez S, Atalay HN, Antika G, Tumer TB. Looking at NSAIDs from a historical
perspective and their current status in drug repurposing
for cancer treatment and prevention. J Cancer Res Clin
Oncol 2023: 149; 2095-113. doi: 10.1007/s00432-
022-04187-8. - 3. Buer JK. Origins and impact of the term “NSAID.”
Inflammopharmacology 2014; 22: 263-7. doi: 10.1007/
s10787-014-0211-2. - 4. atton M, Hochberg MC, Wells G. Acetaminophen for osteoarthritis. Cochrane Database Syst Rev 2006; 2006(1):
CD004257. doi: 10.1002/14651858.CD004257. - 5. Machado GC, Maher CG, Ferreira PH, Day RO, Pinheiro MB, Ferreira ML. Non-steroidal anti-inflammatory drugs
for spinal pain: A systematic review and meta-analysis.
Ann Rheum Dis 2017; 76: 1269-78. doi:10.1136/annrheumdis-2016-210597. - 6. Caiazzo E, Ialenti A, Cicala C. The relatively selective
cyclooxygenase-2 inhibitor nimesulide: What’s going on?
Eur J Pharmacol 2019; 848: 105-11. doi: 10.1016/j.
ejphar.2019.01.044. - 7. Talley JJ. Selective inhibitors of cyclooxygenase-2 (COX-2). Prog Med Chem 1999; 36: 201-34. doi:
10.1016/s0079-6468(08)70048-1. - 8. Flower RJ. The development of COX2 inhibitors.
Nat Rev Drug Discov 2003; 3: 179-91. doi:10.1038/
nrd1034. - 9. Smith WL, DeWitt DL, Garavito RM. Cyclooxygenases: Structural, cellular, and molecular biology. Annu Rev
Biochem 2000; 69:145-82. doi: 10.1146/annurev.biochem.69.1.145.- Riendeau D, Percival MD, Brideau C, Charleson S,
Dubé D, Ethier D, et al. Etoricoxib (MK-0663): Preclinical
profile and comparison with other agents that selectively
inhibit cyclooxygenase-2. J Pharmacol Exp Ther 2001;
296: 558-66.
- Matsumoto AK, Cavanaugh PF Jr. Etoricoxib. Drugs
Today (Barc) 2004; 40: 395-414.
- National Center for Biotechnology Information. PubChem Compound Summary for CID 123619, Etoricoxib.
https://pubchem.ncbi.nlm.nih.gov/compound/Etoricoxib.
Accessed June 30, 2024.
- Rayar AM, Lagarde N, Ferroud C, Zagury JF, Montes M, Sylla-Iyarreta Veitia M. Update on COX-2 selective
inhibitors: Chemical classification, side effects and their
use in cancers and neuronal diseases. Curr Top Med Chem
2017; 17: 2935-56. doi: 10.2174/156802661766617
0821124947.
- Picot D, Loll PJ, Garavito RM. The X-ray crystal
structure of the membrane protein prostaglandin H2
synthase-1. Nature 1994; 367(6460): 243-9. doi:
10.1038/367243a0.
- Kurumbail RG, Stevens AM, Gierse JK, McDonald
JJ, Stegeman RA, Pak JY, Gildehaus D, Miyashiro JM,
Penning TD, Seibert K, Isakson PC, Stallings WC. Structural basis for selective inhibition of cyclooxygenase-2 by
anti-inflammatory agents. Nature 1996; 384(6610): 644-
- Riendeau D, Percival MD, Brideau C, Charleson S,
- doi: 10.1038/384644a0. Erratum in: Nature 1997;
385(6616): 555.
- Gierse JK, Koboldt CM, Walker MC, Seibert K, Isakson PC. Kinetic basis for selective inhibition of cyclo-oxygenases. Biochem J 1999; 339: 607-14.
- Blobaum AL, Marnett LJ. Structural and functional
basis of cyclooxigenase inhibition. J Med Chem 2007; 50:
1425-41. doi: 10.1021/jm0613166.
- Grosser T, Ricciotti E, FitzGerald GA. Capítulo 42:
Farmacoterapia de la inflamación, fiebre, dolor y gota. En:
Brunton LL, Knollmann BC, eds. Goodman & Gilman Las
Bases Farmacológicas de la Terapéutica 14 ed. México
DF: McGraw Hill Education 2023.
- Christie MJ, Vaughan CW, Ingram SL. Opioids,
NSAIDs and 5-lipoxygenase inhibitors act synergistically
in brain via arachidonic acid metabolism. Inflamm Res
1999; 48:1-4. doi: 10.1007/s000110050367.
- Tegeder I, Pfeilschifter J, Gleisslinger G. Cyclooxygenase-independent actions of cyclooxygenase inhibitors. FASEB J 2001; 15: 2057-72. doi: 10.1096/fj.01-
0390rev.
- Puhl AC, Milton FA, Cvoro A, Sieglaff DH, Campos
JC, Bernardes A, et al. Mechanisms of peroxisome proliferator activated receptor g regulation by non-steroidal
anti-inflammatory drugs. Nucl Recept Signal 2015; 13:
e004. doi: 10.1621/nrs.13004.
- MK0663-AUS-2017-015150 Australian Product
Information: ARCOXIA®(etoricoxib). In: https://e-lactancia.org/media/papers/Etoricoxib-DS-MSD2017.pdf. Accessed June 30, 2024.
- Mastbergen SC, Jansen NW, Bijlsma JW, Lafeber
FP. Differential direct effects of cyclo-oxygenase-1/2 inhibition on proteoglycan turnover of human osteoarthritic
cartilage: An in vitro study. Arthritis Res Ther 2006; 8: R2.
doi: 10.1186/ar1846.
- Agrawal NG, Porras AG, Matthews CZ, Rose MJ, Woolf
EJ, Musser BJ, Dynder AL, Mazina KE, Lasseter KC, Hunt
TL, Schwartz JI, McCrea JB, Gottesdiener KM. Single- and
multiple-dose pharmacokinetics of etoricoxib, a selective
inhibitor of cyclooxygenase-2, in man. J Clin Pharmacol
2003; 43: 268-76. doi: 10.1177/0091270003251122.
- Takemoto JK, Reynolds JK, Remsberg CM, Vega-Villa KR, Davies NM. Clinical pharmacokinetic and pharmacodynamic profile of etoricoxib. Clin Pharmacokinet 2008;
47: 703-20. doi: 10.2165/00003088-200847110-
00002.
- Chen YF, Jobanputra P, Barton P, Bryan S, Fry-Smith A, Harris G, Taylor RS. Cyclooxygenase-2 selective
non-steroidal anti-inflammatory drugs (etodolac, meloxicam, celecoxib, rofecoxib, etoricoxib, valdecoxib and lumiracoxib) for osteoarthritis and rheumatoid arthritis: A
systematic review and economic evaluation. Health Technol Assess 2008; 12: 1-278, iii. doi: 10.3310/hta12110.
- da Costa BR, Reichenbach S, Keller N, Nartey L,
Wandel S, Jüni P, Trelle S. Effectiveness of non-steroidal anti-inflammatory drugs for the treatment of pain in
knee and hip osteoarthritis: A network meta-analysis.
Lancet 2017; 390: e21-e33. doi: 10.1016/S0140-
6736(17)31744-0.
- da Costa BR, Pereira TV, Saadat P, Rudnicki M,
Iskander SM, Bodmer NS, Bobos P, Gao L, Kiyomoto HD,
Montezuma T, Almeida MO, Cheng PS, Hincapié CA, Hari
R, Sutton AJ, Tugwell P, Hawker GA, Jüni P. Effectiveness and safety of non-steroidal anti-inflammatory drugs
and opioid treatment for knee and hip osteoarthritis: Network meta-analysis. Br Med J 2021; 375: n2321. doi:
10.1136/bmj.n2321.
- Zhang S, Zhang Y, Liu P, Zhang W, Ma JL, Wang J.
Efficacy and safety of etoricoxib compared with NSAIDs
in acute gout: A systematic review and a meta-analysis.
Clin Rheumatol 2016; 35: 151-8. doi: 10.1007/s10067-
015-2991-1.
- Wallace JL, Granger DN. Pathogenesis of NSAID
gastropathy: Are neutrophils the culprits? Trends Pharmacol Sci 1992; 13: 129-30. doi: 10.1016/0165-
6147(92)90046-9.
- Cannon CP, Curtis SP, FitzGerald GA, Krum H, Kaur
A, Bolognese JA, Reicin AS, Bombardier C, Weinblatt ME,
van der Heijde D, Erdmann E, Laine L; MEDAL Steering
Committee. Cardiovascular outcomes with etoricoxib and
diclofenac in patients with osteoarthritis and rheumatoid
arthritis in the Multinational Etoricoxib and Diclofenac
Arthritis Long-term (MEDAL) programme: A randomised
comparison. Lancet 2006; 368: 1771-81. doi: 10.1016/
S0140-6736(06)69666-9.
- Laine L, Curtis SP, Langman M, Jensen DM, Cryer B, Kaur A, Cannon CP. Lower gastrointestinal events
in a double-blind trial of the cyclo-oxygenase-2 selective
inhibitor etoricoxib and the traditional nonsteroidal anti-inflammatory drug diclofenac. Gastroenterology 2008; 135:
1517-25. doi: 10.1053/j.gastro.2008.07.067.
- Feng X, Tian M, Zhang W, Mei H. Gastrointestinal
safety of etoricoxib in osteoarthritis and rheumatoid arthritis: A meta-analysis. PLoS One 2018; 13: e0190798. doi:
10.1371/journal.pone.0190798.
- Dieppe P, Bartlett C, Davey P, et al. Balancing benefits and harms: The example of non-steroidal anti-inflammatory drugs. Br Med J 2004; 329: 31-4. doi: 10.1136/
bmj.329.7456.31.
- Wolfe MM, Lichtenstein DR, Singh G. Gastrointestinal toxicity of nonsteroidal antiinflammatory drugs.
N Eng J Med 1999; 340: 1888-99. doi: 10.1056/
NEJM199906173402407.
- Whelton A, Hamilton CW. Nonsteroidal anti-inflammatory drugs: Effects on kidney function. J Clin Pharmacol
1991; 31: 588-98. doi: 10.1002/j.1552-4604.1991.
tb03743.x.
- Kearny PM, Baigent C, Godwin J, Emberson H,
Halls JR, Patrono C. Do selective cyclo-oxygenase-2 inhibitors and traditional non-steriodal anti-inflammatory
drugs increase the risk of atherothrombosis? Meta-analysis
of randomised trials. Br Med J 2006; 332:1302-5. doi:
10.1136/bmj.332.7553.1302.
- McGettigan P, Henry D. Cardiovascular risk and
inhibition of cyclooxygenase: A systematic review of the
observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA 2006; 296: 1633-44. doi:
10.1001/jama.296.13.jrv60011.
- Aldington S, Shirtcliffe P, Weatherall M, Beasley R.
Systematic review and meta-analysis of the risk of major
cardiovascular events with etoricoxib therapy. N Z Med J
2005; 118: U1684.
- Iannantuono R, Serra HA, Zieher LM. Capítulo 1
Farmacocinética I: Absorción, distribución y metabolismo
de fármacos. En: Zieher LM, Iannatuono RF, Serra HA,
eds. Farmacología General y de la Neurotransmisión 3ra
ed. Buenos Aires: Ursino 2003; pp 1-24.
- Rodrigues D, Niosi M, Eng H, Healy C, Lazzaro S,
Yang Q, Cerny MA. Attempting to unmask the inhibition of
sulfotransferase 1E1 in 17a-ethinyl estradiol drug interactions. J Clin Pharmacol 2023; 63: 875-9. doi: 10.1002/
jcph.2235.
- Patanè M, Ciriaco M, Chimirri S, Ursini F, Naty S,
Grembiale RD, Gallelli L, De Sarro G, Russo E. Interactions among low dose of methotrexate and drugs used in
the treatment of rheumatoid arthritis. Adv Pharmacol Sci
2013; 2013:313858. doi: 10.1155/2013/313858.
- Serra HA, Roganovich JM, Rizzo LF. Glucocorticoides: Paradigma de medicina traslacional. De lo molecular
al uso clínico. Medicina (B Aires) 2012; 72: 158-70.
- Ranong CN, Sukcharoen N. Analgesic effect of etoricoxib in secondary dysmenorrhea: A randomized, double-blind, crossover, controlled trial. J Reprod Med 2007;
52: 1023-9.
- Yu Q, Zhu X, Zhang X, Zhang Y, Li X, Hua Q,
Chang Q, Zou Q, Di W, Yao Y, Yu W, Liu J, Mehta A,
Yan L. Etoricoxib in the treatment of primary dysmenorrhea in Chinese patients: A randomized controlled
trial. Curr Med Res Opin 2014; 30: 1863-70. doi:
10.1185/03007995.2014.925437.
- Nor Azlin MI, Maryasalwati I, Norzilawati MN, Mahdy
ZA, Jamil MA, Zainul Rashid MR. The efficacy of etoricoxib
vs mefenamic acid in the treatment of primary dysmenorrhoea: A randomised comparative trial. J Obstet Gynaecol
2008; 28: 424-6. doi: 10.1080/01443610802150051.
- Malmstrom K, Kotey P, Cichanowitz N, Daniels
S, Desjardins PJ. Analgesic efficacy of etoricoxib in primary dysmenorrhea: Results of a randomized, controlled trial. Gynecol Obstet Invest 2003; 56: 65-9. doi:
10.1159/000072735.
- Agrawal NG, Rose MJ, Matthews CZ, Woolf EJ,
Porras AG, Geer LA, Larson PJ, Cote J, Dilzer SC, Lasseter KC, Alam I, Petty KJ, Gottesdiener KM. Pharmacokinetics of etoricoxib in patients with hepatic impairment. J Clin Pharmacol 2003; 43: 1136-48. doi:
10.1177/0091270003257219.
- Rodrigues AD. Impact of CYP2C9 genotype on pharmacokinetics: Are all cyclooxygenase inhibitors the same?
Drug Metab Dispos 2005; 33: 1567-75. doi: 10.1124/
dmd.105.006452.
- Antiinflamatorios no esteroides y específicos. En Litter M. Farmacología Experimental y Clínica 7ma ed. Buenos Aires: Editorial El Ateneo 1986; pp 1303-36.
- Steinbach G, Lynch PM, Phillips RK, Wallace MH,
Hawk E, Gordon GB, Wakabayashi N, Saunders B, Shen
Y, Fujimura T, Su LK, Levin B, Godio L, Patterson S, Rodriguez-Bigas MA, Jester SL, King KL, Schumacher M,
Abbruzzese J, DuBois RN, Hittelman WN, Zimmerman
S, Sherman JW, Kelloff G. The effect of celecoxib, a cyclooxygenase-2 inhibitor, in familial adenomatous polyposis. N Engl J Med 2000; 342: 1946-52. doi: 10.1056/
NEJM200006293422603.
- Veettil SK, Nathisuwan S, Ching SM, Jinatongthai
P, Lim KG, Kew ST, Chaiyakunapruk N. Efficacy and safety of celecoxib on the incidence of recurrent colorectal
adenomas: A systematic review and meta-analysis. Cancer Manag Res 2019; 11: 561-71. doi: 10.2147/CMAR.
S180261.
- Sethi R, Gómez-Coronado N, Walker AJ, Robertson
OD, Agustini B, Berk M, Dodd S. Neurobiology and Therapeutic Potential of Cyclooxygenase-2 (COX-2) Inhibitors
for Inflammation in Neuropsychiatric Disorders. Front Psychiatry 2019; 10: 605. doi: 10.3389/fpsyt.2019.00605.
- Tanwar L, Piplani H, Sanyal S. Anti-proliferative and
apoptotic effects of etoricoxib, a selective COX-2 inhibitor,
on 1,2-dimethylhydrazine dihydrochloride-induced colon
carcinogenesis. Asian Pac J Cancer Prev 2010; 11: 1329-
33.
- Jain S, Ghanghas P, Rana C, Sanyal SN. Role
of GSK-3β in regulation of canonical Wnt/β-catenin
signaling and PI3-K/Akt oncogenic pathway in colon cancer. Cancer Invest 2017; 350: 473-83. doi:
10.1080/07357907.2017.1337783







No comments! Be the first commenter?