La microbiota intestinal desempeña un papel fundamental en la regulación de la salud cardiovascular a través de la producción de metabolitos clave como los ácidos grasos de cadena corta (SCFAs), el trimetilamina-N-óxido (TMAO), los ácidos biliares secundarios, los lipopolisacáridos (LPS) y las vita- minas esenciales. Este artículo analiza cómo estos compuestos, modulados por la microbiota, influyen en procesos inflamatorios, metabólicos y vascula- res asociados con el desarrollo de enfermedades cardiovasculares. Además, se exploran las consecuencias de la disbiosis intestinal y las posibles inter- venciones terapéuticas basadas en prebióticos, probióticos y modificaciones dietéticas para restaurar el equilibrio microbiano. Este enfoque integrador subraya la relevancia de la microbiota como un objetivo terapéutico emergen- te en la prevención y manejo de enfermedades cardiovasculares..
Palabras clave
Microbiota intestinal – Salud cardiovascular – Ácidos grasos de cadena corta (SCFAs) – Trimetilamina-N-óxido (TMAO) – Ácidos biliares secundarios – Lipopolisacáridos (LPS) – Vitaminas – Disbiosis – Estrategias terapéuticas.
Objetivos de la revisión
El propósito de esta revisión es analizar de manera exhaus- tiva la evidencia disponible sobre el papel de la microbiota intestinal en la fisiopatología cardiovascular, destacando los mecanismos moleculares implicados y las estrategias terapéu- ticas emergentes. Este enfoque pretende equipar a cardiólo- gos y clínicos con herramientas para integrar este conocimien- to en la práctica diaria y mejorar los resultados en pacientes con riesgo cardiovascular.
La relación entre la microbiota intestinal y la salud cardio- vascular ha emergido como un campo de investigación prome- tedor en los últimos años. La microbiota intestinal, compues- ta por billones de microorganismos que residen en el tracto gastrointestinal humano, desempeña un papel relevante en la regulación de procesos metabólicos, inmunológicos y en- dócrinos. Investigaciones recientes han demostrado que las alteraciones en la composición y función de la microbiota in- testinal, conocidas como disbiosis, pueden influir significa- tivamente en la aparición y progresión de enfermedades car- diovasculares (ECV), incluyendo aterosclerosis, hipertensión e insuficiencia cardíaca. Estas influencias se ejercen princi- palmente a través de la producción de metabolitos bioactivos, como el trimetilamina-N-óxido (TMAO), y la modulación de procesos inflamatorios y metabólicos (1).
La idea de que los microorganismos intestinales influyen en la salud no es nueva. A principios del siglo XX, Élie Met- chnikoff, pionero en la microbiología, postuló que las bacte- rias intestinales podrían afectar el envejecimiento y sugirió el consumo de productos fermentados como yogur para mejorar la salud y prolongar la vida. No obstante, no fue hasta las últimas décadas, con el desarrollo de tecnologías avanzadas como la metagenómica, que se comenzó a entender la com- pleja interacción entre la microbiota intestinal y la salud car- diovascular (2).
El descubrimiento de metabolitos específicos, como el TMAO, marcó un avance significativo en el campo. Este compuesto, derivado de la interacción de la microbiota con nutrientes como la colina y la carnitina, se ha asociado con un mayor riesgo de eventos cardiovasculares, como infarto de miocardio e insuficiencia cardíaca. Estudios han identificado que niveles elevados de TMAO pueden incrementar en un 60 % el riesgo de eventos cardiovasculares graves (3).
Las ECV son la principal causa de muerte a nivel mundial, representando aproximadamente el 32% de todas las muertes según la Organización Mundial de la Salud (OMS). Entre las patologías más relevantes se encuentra la aterosclerosis, que afecta al 10-15% de los adultos mayores de 40 años, y la insuficiencia cardíaca, cuya prevalencia aumenta con el enve- jecimiento poblacional (4).
La evidencia sugiere que la microbiota intestinal desem- peña un papel central en la regulación de factores de riesgo cardiovascular, tales como el metabolismo de lípidos, la inflamación sistémica y el estrés oxidativo (5). La microbiota intestinal está predominantemente constituida por bacterias de los filos Firmicutes y Bacteroidetes, con menores propor- ciones de los filos Actinobacteria y Proteobacteria, y su com- posición está modulada por factores como la dieta, la edad, el uso de medicamentos y el estado general de salud (3). En un contexto más amplio, el microbioma incluye no sólo a estos microorganismos, sino también a sus genes y productos meta- bólicos, destacando su función como un ecosistema funcional integral. Entre sus funciones esenciales, destacan su papel en el metabolismo, la inmunomodulación y la producción de metabolitos bioactivos. En términos metabólicos, lleva a cabo la digestión de fibras y compuestos no digeribles, generando ácidos grasos de cadena corta (SCFAs) como el butirato, el acetato y el propionato, fundamentales para la salud meta- bólica. En el ámbito inmunológico, modula la respuesta del sistema inmune, equilibrando la tolerancia frente a antígenos inofensivos y la defensa contra patógenos. Además, genera TMAO y ácidos biliares secundarios, que participan en proce- sos metabólicos e inflamatorios (1).
La interacción entre la microbiota intestinal y el sistema cardiovascular, conocida como el eje intestino-corazón, se establece mediante una comunicación bidireccional media- da por metabolitos microbianos. Estos compuestos influyen en procesos como la inflamación sistémica, el metabolismo lipídico y la regulación de la presión arterial, consolidando su impacto en la salud cardiovascular (2). La inflamación sisté-
mica, por ejemplo, puede ser exacerbada por la disbiosis in- testinal, un desequilibrio en la composición y/o función de la microbiota que compromete la integridad de la barrera intesti- nal, permitiendo la translocación bacteriana hacia el torrente sanguíneo. Este proceso activa respuestas inflamatorias que afectan negativamente la función cardiovascular. En el ámbi- to del metabolismo lipídico y la regulación de la presión arte- rial, los SCFAs y el TMAO juegan roles clave. Mientras que los SCFAs mejoran la función vascular mediante la activación de receptores específicos y mecanismos epigenéticos, el TMAO se ha asociado con alteraciones en el transporte de lípidos y un mayor riesgo de formación de placas ateroscleróticas, lo cual se asocia con un aumento en la incidencia de eventos cardiovasculares adversos (6). En la hipertensión, los SCFAs contribuyen a la regulación de la presión arterial, mientras que la disbiosis intestinal puede desempeñar un papel facili- tador en su desarrollo (7). En el caso de la insuficiencia car- díaca, la alteración de la microbiota exacerba la inflamación sistémica y el estrés oxidativo, acelerando la progresión de la enfermedad y deteriorando la función cardíaca (3).
La relación entre la microbiota intestinal y las enfermedades cardiovasculares subraya la importancia de explorar estrategias terapéuticas dirigidas a restablecer y mantener un equilibrio microbiano saludable. Estas intervenciones, que incluyen mo- dificaciones dietéticas, el uso de prebióticos y probióticos, y potencialmente la manipulación farmacológica de metabolitos específicos, representan un enfoque innovador y prometedor en la prevención y el manejo de enfermedades cardiovasculares.
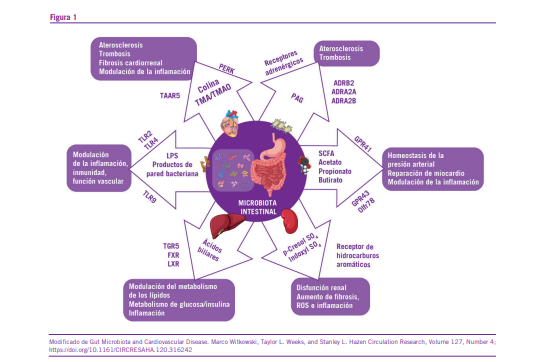
Fundamentos moleculares de la microbiota intestinal y su interacción con la patología cardiovascular
Como mencionamos, la microbiota intestinal juega un pa- pel fundamental en la regulación de procesos metabólicos, inflamatorios y endocrinos en el organismo. Su impacto en la salud cardiovascular se manifiesta principalmente a través de metabolitos bioactivos generados por la interacción entre los microorganismos intestinales y la dieta del huésped. Estos metabolitos, dependiendo de sus características y del entorno fisiológico, pueden actuar como moduladores de la homeosta- sis o como desencadenantes de patologías cardiovasculares, subrayando la dualidad de su influencia en el sistema cardio- vascular (3) (Figura 1).
Entre los metabolitos clave, los SCFAs, como el butirato, el propionato y el acetato, destacan por sus efectos beneficiosos. Producidos durante la fermentación de fibras dietéticas, los SCFAs modulan la inflamación, mejoran la función endotelial y regulan la presión arterial al interactuar con receptores es- pecíficos y mecanismos epigenéticos. Su producción depende en gran medida de una dieta rica en fibras fermentables y de un microbioma equilibrado.
En contraste, el TMAO, derivado de la oxidación hepática de la trimetilamina producida por la microbiota a partir de nu- trientes como la colina y la carnitina, se asocia con un mayor riesgo de aterosclerosis y disfunción vascular. Este metabolito promueve la acumulación de colesterol en las arterias, activa vías proinflamatorias y exacerba el daño endotelial, consoli- dándose como un mediador clave en la patogénesis de ECV.
Los ácidos biliares secundarios, formados por la transfor- mación bacteriana de los ácidos biliares primarios, tienen una función dual. A través de la activación de receptores como FXR y TGR5, estos compuestos pueden mejorar la sensibi- lidad a la insulina, regular el metabolismo lipídico y ejercer efectos antiinflamatorios. Sin embargo, en situaciones de dis- biosis, su producción desregulada puede contribuir al estrés oxidativo y a la inflamación crónica, aumentando el riesgo cardiovascular.
Los lipopolisacáridos (LPS), componentes de la membrana de bacterias Gramnegativas, representan otro metabolito con relevancia cardiovascular. Su translocación al torrente sanguí- neo en condiciones de una barrera intestinal comprometida induce inflamación sistémica, estrés oxidativo y disfunción endotelial. Estos efectos agravan la progresión de ateroscle- rosis y otras enfermedades cardiovasculares, reforzando la importancia de mantener una barrera intestinal íntegra para limitar su impacto negativo.
Compuestos como los fenoles y aminas también tienen un papel significativo en la interacción microbiota-salud cardiovas- cular. Algunos, como los polifenoles dietéticos metabolizados en el intestino, poseen propiedades antioxidantes y antiinflama- torias que benefician la función endotelial y reducen el estrés oxidativo. En contraste, metabolitos como el p-cresol y el indo- xilsulfato, derivados del metabolismo proteico, están vinculados con inflamación crónica, daño vascular y fibrosis miocárdica.
Las poliaminas, como la espermidina, destacan entre los metabolitos con potencial protector cardiovascular. Estas mo- léculas, involucradas en procesos de regeneración y homeos- tasis celular, tienen propiedades antioxidantes y antiinflama-
torias que contribuyen a la salud vascular y metabólica.
Por último, vitaminas y cofactores producidos o modulados por la microbiota, como la vitamina K2 y las del complejo B, desempeñan un rol crucial en la prevención de calcificación arterial y en la regulación del metabolismo cardiovascular. La disbiosis puede limitar su producción, subrayando la nece- sidad de un microbioma equilibrado para mantener niveles adecuados de estos compuestos esenciales.
Ácidos Grasos de Cadena Corta (SCFAs)
Los SCFAs son metabolitos clave producidos por la micro- biota intestinal que representan una conexión esencial entre la dieta, la microbiota y la salud humana, destacando su im- pacto en la fisiología intestinal y cardiovascular.
Los principales precursores para su síntesis incluyen fibras dietéticas como celulosa, hemicelulosa, inulina y fructooligo- sacáridos, además de almidones resistentes que escapan a la digestión en el intestino delgado y son fermentados en el colon. En menor proporción, los residuos proteicos también generan SCFAs, aunque acompañados de subproductos como amoníaco y compuestos sulfurados. Bacterias específicas participan en su producción: el acetato, producido mayormente por bacterias del filo Bacteroidetes y ciertas especies de Clostridia; el propiona- to, sintetizado por Bacteroides, Veillonella y Propionibacterium; y el butirato, generado principalmente por Faecalibacterium prausnitzii, Roseburia y Eubacterium rectale (7).
Diversos factores influyen en su producción, incluyendo la composición y diversidad de la microbiota intestinal, la dieta y el estado de salud del huésped. Las dietas ricas en fibras fermentables favorecen su síntesis, mientras que alimentos ricos en grasas y ultraprocesados, sumado a la falta de acti- vidad física se asocian con una producción reducida de estos metabolitos (1).
Tras su síntesis, los SCFAs son absorbidos en el colon a través de transportadores específicos como los cotranspor- tadores de monocarboxilatos (MCT1) y los transportadores de ácidos carboxílicos acoplados a sodio (SMCT1). Una vez en circulación, tienen funciones metabólicas específicas: el acetato constituye el 60% de los SCFAs totales, circula sis- témicamente y actúa como precursor en la síntesis de lípi- dos; el propionato, que representa el 25%, es metabolizado principalmente en el hígado donde participa en la gluconeo- génesis; y el butirato, que corresponde al 15%, es utilizado preferentemente como fuente energética por los colonocitos, fortaleciendo la barrera intestinal y promoviendo su renova- ción celular (2).
A nivel intestinal, los SCFAs juegan un papel importante en la permeabilidad, ya que el butirato refuerza la barrera intestinal al promover la expresión de proteínas como oclu- dina y claudina, reduciendo la translocación de endotoxinas bacterianas al torrente sanguíneo, y evitando el aumento de la permeabilidad paracelular, conocida como “leaky gut”. Esto tiene un impacto cardiovascular significativo, ya que dismi- nuye la inflamación sistémica y protege contra la disfunción vascular asociada (3).
En cuanto a sus funciones metabólicas, los SCFAs actúan regulando la gluconeogénesis hepática, la sensibilidad a la insulina y el metabolismo lipídico (3). Y en el contexto cardio- vascular, los SCFAs desempeñan un papel protector a través de múltiples mecanismos. Reducen la inflamación sistémica,
mejoran la función endotelial al mantener la integridad de la barrera vascular y regulan la presión arterial promoviendo la vasodilatación y el equilibrio hemodinámico (8).
Uno de los mecanismos principales a través de los cuales actúan los SCFAs es su interacción con receptores acoplados a proteínas G (GPRs), incluidos GPR41, GPR43 y GPR109A. El GPR43, activado por el propionato, regula la inflamación al reducir la producción de citoquinas proinflamatorias como IL-6 y TNF-a, además de participar en el metabolismo lipídico en los adipocitos. Por su parte, el GPR41 modula la presión arterial mediante la relajación del músculo liso vascular, pro- movida también especialmente por el propionato (7).
Desde el punto de vista inmunológico, el butirato, al acti- var GPR109A, estimula la diferenciación de células T regula- doras (Treg), fundamentales para la tolerancia inmunológica, además de suprimir la producción de citoquinas proinflama- torias como TNF-a, IL-6 e IFN-g. Estos efectos antiinflama- torios contribuyen a mitigar la inflamación crónica, un factor clave en el desarrollo de enfermedades cardiovasculares (2). El butirato, en particular, desempeña además un rol protec- tor en la función endotelial, ya que reduce el estrés oxida- tivo al estimular la producción de antioxidantes endógenos y mejora la integridad de la barrera vascular, previniendo la translocación de LPS y otras moléculas proinflamatorias. Los SCFAs también modulan el sistema nervioso autónomo, influyendo en la actividad simpática y el equilibrio hemodi- námico (7).
Otro mecanismo fundamental mediante el cual el butirato ejerce su acción es la regulación epigenética, ya que es un potente inhibidor de las deacetilasas de histonas (HDACs), enzimas que modulan la compactación de la cromatina y, en consecuencia, la expresión génica. Al inhibir las HDACs, el butirato favorece la acetilación, lo que potencia la trans- cripción de genes antiinflamatorios y protectores. Este me- canismo es clave para regular procesos relacionados con la inflamación, la reparación celular y el metabolismo ener- gético (3).
La evidencia científica refuerza el papel de los SCFAs en la salud cardiovascular. Estudios preclínicos han demostrado que la suplementación con SCFAs o con prebióticos que esti- mulan su producción mejora la función cardiovascular, reduce la inflamación sistémica y disminuye la presión arterial. En estudios clínicos, concentraciones elevadas de SCFAs en la circulación se han asociado con menor inflamación sistémica y mejor función endotelial en pacientes con riesgo cardiovas- cular (3). Un ensayo clínico mostró que dietas ricas en fibras fermentables, que aumentan la producción de SCFAs, se aso- ciaron con una reducción significativa de la presión arterial y los niveles de colesterol LDL (1). Asimismo, un estudio publi- cado en Circulation Research destacó que la suplementación con butirato mejora la función cardíaca y reduce la inflama- ción en pacientes con insuficiencia cardíaca (3).
En resumen, los SCFAs desempeñan un papel multifacético en la protección cardiovascular al influir en la inflamación, la función endotelial, la presión arterial y el metabolismo lipídi- co y glucémico. Su capacidad para actuar en múltiples fren- tes los posiciona como dianas terapéuticas prometedoras en la prevención y el manejo de ECV, resaltando la importancia de una dieta rica en fibras y una microbiota equilibrada para maximizar sus beneficios.
Estrategias para modular los SCFAs y sus implicaciones tera- péuticas
La modulación de los SCFAs se perfila como una estrategia innovadora y prometedora en la prevención y manejo de enfer- medades cardiovasculares. Estas intervenciones, que abarcan desde modificaciones dietéticas hasta el uso de suplementos específicos, tienen como objetivo incrementar la producción y acción de estos metabolitos clave, optimizando su impacto positivo en la salud cardiovascular.
Un enfoque fundamental para aumentar su producción es el incremento de fibras fermentables en la dieta. Estas fibras, como la inulina y los fructooligosacáridos, actúan como sus- tratos para la microbiota intestinal, que las fermenta para pro- ducir butirato, propionato y acetato. Fuentes dietéticas como frutas, vegetales y granos integrales son particularmente ricas en estas fibras. Evidencia clínica ha demostrado que dietas ricas en fibras fermentables no sólo aumentan significativa- mente los niveles de SCFAs, sino que también mejoran mar- cadores inflamatorios como IL-6 y TNF-a y parámetros meta- bólicos asociados al riesgo cardiovascular (2).
Los prebióticos, compuestos no digeribles que estimulan se- lectivamente el crecimiento de microorganismos beneficiosos, son otra herramienta valiosa para potenciar la producción de SCFAs. Al favorecer el crecimiento de bacterias productoras de SCFAs como Faecalibacterium prausnitzii y Roseburia, los prebióticos promueven un entorno intestinal que apoya la sín- tesis de estos metabolitos. En un ensayo controlado, la suple- mentación con prebióticos incrementó los niveles de SCFAs en el colon y redujo la inflamación sistémica en pacientes con síndrome metabólico, subrayando su relevancia en la mejora de la salud cardiovascular (7).
Por su parte, los probióticos, microorganismos vivos que
benefician la salud del huésped cuando se administran en cantidades adecuadas, también han mostrado su capacidad para mejorar la fermentación de carbohidratos no digeribles y, en consecuencia, aumentar la producción de SCFAs. Espe- cies como Lactobacillus y Bifidobacterium son particularmente efectivas en este proceso. Un estudio en humanos encontró que la suplementación con probióticos incrementó los niveles de butirato en el colon y redujo la inflamación asociada a ECV (3). La combinación de prebióticos y probióticos en forma de “sinbióticos” (neologismo creado para traducir la palabra synbiotic en inglés) maximiza aún más la producción de SC- FAs al actuar sinérgicamente sobre la composición y funcio- nalidad de la microbiota intestinal. Un metaanálisis reciente destacó que los “sinbióticos” son más efectivos que los pre- bióticos o probióticos administrados por separado, logrando un incremento significativo en los niveles de SCFAs y redu- ciendo la inflamación sistémica, lo que refuerza su potencial
en la mejora de la salud cardiovascular (3).
La suplementación directa con SCFAs, especialmente con butirato, ha sido explorada como una estrategia para abordar la inflamación y mejorar la función endotelial. Estudios pre- clínicos en modelos animales han mostrado resultados pro- metedores, incluyendo la reducción de inflamación vascular y mejoras en la integridad de la barrera endotelial. Sin embargo, los datos en humanos son limitados y se requiere más investi- gación para determinar su seguridad y eficacia (2).
En términos clínicos, estas estrategias tienen aplicaciones tanto en la prevención como en el manejo complementario
farmacología cardiovascular 62 | Marzo de 2025
de enfermedades cardiovasculares. En la prevención prima- ria, dietas ricas en fibras fermentables y el uso de prebió- ticos pueden disminuir factores de riesgo como la inflama- ción sistémica, el estrés oxidativo y la disbiosis intestinal. En pacientes con afecciones establecidas, como aterosclerosis o insuficiencia cardíaca, los probióticos y sinbióticos pueden complementar las terapias convencionales al reducir la infla- mación crónica, mejorar la función endotelial y optimizar el perfil metabólico.
Trimetilamina-N-óxido (TMAO)
El TMAO es un metabolito derivado de la interacción entre la microbiota intestinal y el hígado, cuya relevancia ha sido ampliamente estudiada debido a su estrecha asociación con el riesgo cardiovascular. Su formación se inicia con la conversión de compuestos dietéticos como la colina, la L-carnitina y la fosfatidilcolina en trimetilamina (TMA) por bacterias intestina- les, incluyendo especies como Clostridium, Escherichia coli y Desulfovibrio. Posteriormente, la TMA es transportada al híga- do, donde la enzima flavina monooxigenasa 3 (FMO3) cataliza su conversión en TMAO, estableciendo un vínculo directo entre la dieta, la microbiota intestinal y la salud cardiovascular.
El TMAO ejerce efectos adversos a través de diversos me- canismos. Promueve la formación de placas ateroscleróticas al alterar el transporte inverso del colesterol, favoreciendo su acumulación en macrófagos y su transformación en células espumosas. Además, estimula la expresión de moléculas de adhesión en células endoteliales, facilitando la infiltración de monocitos y la inflamación vascular, lo que incrementa el riesgo de aterosclerosis (7). Asimismo, afecta la función endotelial mediante la activación de vías de estrés oxidativo que generan especies reactivas de oxígeno (ROS), junto con la promoción de inflamación endotelial, comprometiendo la capacidad de las células vasculares para mantener su funcio- nalidad normal (2).
En el ámbito metabólico, el TMAO altera significativamente el metabolismo de los lípidos al aumentar la síntesis hepática de colesterol y disminuir su eliminación a través de ácidos biliares, lo que fomenta su acumulación en el organismo (3). Estos efectos se agravan por su capacidad para intensificar la inflamación sistémica mediante la estimulación de citoquinas proinflamatorias como IL-1b y TNF-a, además de potenciar el daño celular y vascular a través del incremento de ROS (4).
La influencia del TMAO también se extiende al desarrollo y progresión de la insuficiencia cardíaca. Niveles elevados de este metabolito están asociados con fibrosis miocárdica, pro- vocando cambios estructurales que comprometen la función cardíaca. Estudios clínicos han demostrado que concentracio- nes elevadas de TMAO en sangre están correlacionadas con un peor pronóstico y un mayor riesgo de mortalidad en pacien- tes con insuficiencia cardíaca (5). Además, se ha sugerido que el TMAO puede contribuir a la regulación de la presión arterial a través de mecanismos inflamatorios y metabólicos, reforzando su papel como un factor de riesgo significativo en el contexto de la hipertensión (2).
La evidencia clínica respalda estas observaciones. Un estu- dio publicado en Nature Communications reveló que niveles elevados de TMAO se asocian con un mayor riesgo de eventos cardiovasculares mayores, como infarto de miocardio y acci- dente cerebrovascular (3). Intervenciones dietéticas dirigidas,
como la reducción del consumo de alimentos ricos en colina y carnitina, han demostrado ser eficaces para disminuir los niveles de TMAO, al tiempo que mejoran los marcadores de salud cardiovascular (4).
Dada su influencia negativa en la salud carciovascular, el TMAO se ha convertido en un objetivo clave para estrategias terapéuticas dirigidas a modificar su producción y reducir su impacto en la salud cardiovascular. Estas estrategias incluyen cambios en la dieta, como limitar el consumo de carnes rojas, huevos y productos lácteos, fuentes principales de colina y carnitina, junto con el aumento de fibras fermentables que estimulan el crecimiento de bacterias beneficiosas y despla- zan a las productoras de TMA en el intestino. Estudios han confirmado que dietas vegetarianas y veganas están asociadas con niveles significativamente más bajos de TMAO, mientras que dietas ricas en fibras mejoran no solo estos niveles, sino también los marcadores inflamatorios relacionados con la sa- lud cardiovascular (2, 7).
La modulación de la microbiota intestinal mediante el uso de probióticos, prebióticos y “sinbióticos” también muestra un gran potencial. Especies como Lactobacillus y Bifidobacte- rium han demostrado su capacidad para reducir la producción de TMA, mientras que los prebióticos, como la inulina, favore- cen el crecimiento de bacterias beneficiosas. Un metaanálisis reciente concluyó que el uso combinado de prebióticos y pro- bióticos es más efectivo para disminuir los niveles de TMAO y reducir la inflamación sistémica que cualquiera de estos enfoques de forma individual (3).
Además, se están explorando enfoques farmacológicos, como el uso de inhibidores de la producción de TMA. Compuestos como la 3,3-dimetil-1-butanol (DMB) han mostrado eficacia en modelos preclínicos al reducir significativamente los niveles de TMAO y atenuar la progresión de la aterosclerosis (1). De mane- ra complementaria, se investiga la modulación de la FMO3 en el hígado como un objetivo prometedor, aunque su aplicación clínica aún se encuentra en etapas iniciales.
Por último, la suplementación con compuestos bioactivos, como los polifenoles presentes en té verde, frutos rojos y vino tinto, ha demostrado mitigar los efectos adversos del TMAO al modular la microbiota intestinal y reducir el estrés oxidativo. También, los ácidos grasos omega-3, como el EPA y el DHA, poseen propiedades antiinflamatorias que pueden contrarres- tar los efectos proaterogénicos del TMAO, aunque su influen- cia directa sobre los niveles de este metabolito requiere más investigación (8).
El TMAO emerge como un mediador clave en la conexión entre la microbiota intestinal y las ECV. Su impacto en la inflamación, el metabolismo lipídico, la disfunción endote- lial y la fibrosis miocárdica refuerzan su papel central en la patogénesis cardiovascular. Las estrategias para modular su producción y mitigar sus efectos, ya sea mediante cambios dietéticos, intervenciones microbiológicas o enfoques farma- cológicos, ofrecen un enfoque prometedor tanto para la pre- vención como para el manejo de estas enfermedades.
Ácidos biliares secundarios
Los ácidos biliares secundarios (AB2), derivados de la transformación bacteriana de los ácidos biliares primarios, desempeñan un papel esencial no sólo en la digestión y ab- sorción de grasas, sino también en la regulación de procesos
metabólicos e inflamatorios relacionados con la salud cardio- vascular. Los ácidos biliares primarios, como el ácido cólico y el quenodesoxicólico, son sintetizados en el hígado a partir del colesterol y liberados hacia el intestino delgado, donde actúan en la emulsificación de grasas. En el colon, bacterias intestinales como Clostridium y Bacteroides transforman es- tos compuestos en AB2, como el ácido desoxicólico (DCA) y el ácido litocólico (LCA), mediante procesos de deshidroxilación, deshidratación y oxidación (8).
Estos metabolitos actúan principalmente a través de recep- tores nucleares y acoplados a proteínas G, destacándose el re- ceptor FXR (farnesoid X receptor) y el TGR5. El FXR regula la síntesis de ácidos biliares, el metabolismo del colesterol y la gluconeogénesis hepática, y su activación por AB2 contribuye a la reducción de los niveles de colesterol LDL, protegiendo de la aterosclerosis (8). Por su parte, el receptor TGR5 mejora la sensibilidad a la insulina, regula la secreción de hormonas intestinales y aumenta la energía mitocondrial, favoreciendo un mejor control glucémico. Ambos receptores desempeñan un papel crucial en la modulación de la inflamación sistémi- ca, ya que su activación inhibe la producción de citoquinas proinflamatorias como IL-1b y TNF-a, lo que contribuye a la prevención de ECV. Algunos AB2, como el ácido litocólico, tienen efectos antioxidantes al estimular la producción de antioxidantes endógenos, lo que reduce el estrés oxidativo y protege las células endoteliales. Estas propiedades explican su impacto positivo en la salud cardiovascular al mejorar la in- tegridad endotelial y contrarrestar la inflamación crónica (3). La modulación de los AB2 mediante estrategias dirigidas a la microbiota intestinal y los receptores mencionados ofrece enfoques terapéuticos prometedores. La promoción de una microbiota intestinal equilibrada a través del uso de prebió- ticos y probióticos favorece una conversión controlada de ácidos biliares primarios en secundarios. Ensayos preclínicos han demostrado que los probióticos pueden modificar la com- posición de los AB2, reduciendo su impacto negativo en la
inflamación cardiovascular (1).
Por otro lado, se están investigando compuestos farmacoló- gicos diseñados para activar FXR y TGR5 como herramientas terapéuticas en el manejo de la dislipidemia y la resistencia a la insulina. Los estudios clínicos preliminares sugieren que los agonistas de FXR no sólo reducen la inflamación vascular, sino que también mejoran significativamente el perfil lipídi- co, mostrando un potencial considerable para integrarse en el tratamiento de ECV (3).
Estas estrategias ofrecen beneficios tanto en la prevención primaria como en el manejo complementario de ECV. Promo- ver una microbiota intestinal saludable mediante dietas ricas en fibras y prebióticos puede optimizar la producción de áci- dos biliares secundarios, reduciendo el riesgo de dislipidemia y otros factores metabólicos. Asimismo, en pacientes con re- sistencia a la insulina o dislipidemia, intervenciones dirigidas a los receptores FXR y TGR5 pueden combinarse con trata- mientos convencionales para mejorar el control metabólico y reducir el riesgo cardiovascular.
Lipopolisacáridos (LPS)
Los LPS, componentes de la membrana externa de bacte- rias Gramnegativas, desempeñan un papel crucial en procesos inflamatorios y en el desarrollo de ECV. Aunque normalmente
se encuentran confinados al lumen intestinal, su transloca- ción al torrente sanguíneo a través de una barrera intestinal comprometida puede desencadenar inflamación sistémica y disfunción vascular, contribuyendo significativamente a la pa- togénesis de diversas afecciones cardiovasculares.
Uno de los mecanismos principales mediante los cuales los LPS afectan la salud cardiovascular es precisamente a través de la inflamación sistémica. Su presencia en la circulación, conocida como endotoxemia metabólica, activa el receptor tipo Toll 4 (TLR4) en las células inmunes, estimulando la li- beración de citoquinas proinflamatorias como IL-1b, TNF-a e IL-6. Este proceso inflamatorio crónico se ha relacionado con un mayor riesgo de aterosclerosis y eventos cardiovasculares adversos (2). Además, los LPS inducen estrés oxidativo al ge- nerar ROS y reducir la biodisponibilidad de óxido nítrico (NO), lo que altera la función endotelial y contribuye al desarrollo de rigidez arterial y daño vascular, como se ha demostrado en modelos animales (3). La implicación de los LPS en el desarrollo de aterosclerosis es igualmente significativa. Pro- mueven la acumulación de lípidos en macrófagos, facilitando la formación de células espumosas y el avance de las placas ateroscleróticas. Estudios en humanos han vinculado niveles elevados de LPS con una progresión acelerada de estas placas en pacientes con ECV (7).
Frente a estos efectos perjudiciales, las estrategias terapéu- ticas nutricionales se centran en dos aspectos principales: re- forzar la barrera intestinal y neutralizar los efectos de los LPS. El primero es fundamental para prevenir la translocación de los LPS al torrente sanguíneo. En este contexto, dietas ricas en fibras fermentables, han mostrado eficacia en estimular la producción de SCFAs, favoreciendo las uniones estrechas entre las células epiteliales intestinales. Ensayos clínicos han demostrado que este enfoque reduce significativamente los niveles de endotoxinas circulantes, particularmente en pa- cientes con obesidad metabólica (1, 2). Asimismo, la suple- mentación con probióticos, como Lactobacillus y Bifidobacte- rium, mejora la integridad de la barrera intestinal y disminuye la traslocación de LPS. Estos beneficios se han corroborado en ensayos clínicos donde los probióticos redujeron los nive- les de LPS en sangre y mejoraron los marcadores inflamato- rios (1,2). La segunda estrategia clave es la neutralización de los efectos de los LPS. Modificar la señalización del re- ceptor TLR4 mediante inhibidores o moléculas bloqueadoras ha mostrado potencial en estudios preclínicos para mitigar la activación de vías inflamatorias y proteger contra la disfun- ción endotelial inducida por LPS (2). Además, compuestos antioxidantes como los polifenoles, junto con los ácidos gra- sos omega-3, pueden contrarrestar el estrés oxidativo causado por los LPS, mejorando la función vascular. Estudios clínicos han respaldado que estos antioxidantes reducen el daño vas- cular asociado con la inflamación generada por LPS (7).
Desde una perspectiva terapéutica, la prevención primaria
de ECV puede beneficiarse significativamente de intervencio- nes dietéticas que incluyan fibras fermentables y probióticos para prevenir la endotoxemia metabólica. En el manejo com- plementario de condiciones como la disfunción endotelial o la aterosclerosis, estrategias dirigidas a reducir la exposición a LPS mediante probióticos, antioxidantes o moduladores de TLR4 pueden integrarse efectivamente con los tratamientos convencionales, mejorando los resultados clínicos.
farmacología cardiovascular 62 | Marzo de 2025
Fenoles y Aminas
Los fenoles y las aminas, compuestos bioactivos derivados del metabolismo microbiano intestinal, presentan efectos contrastantes sobre la salud cardiovascular. Si bien algunos tienen propiedades antioxidantes beneficiosas, como los po- lifenoles dietéticos metabolizados por bacterias intestinales, otros, como el p-cresol y el indoxilsulfato, están estrechamen- te vinculados con inflamación crónica, estrés oxidativo y un mayor riesgo de ECV.
Los fenoles incluyen metabolitos generados a partir de po- lifenoles dietéticos presentes en frutas, verduras, té, café y vino, como el ácido gálico, las catequinas y la quercetina. Además, abarcan compuestos como el fenol y el p-cresol, pro- venientes del metabolismo bacteriano de proteínas. Por su parte, las aminas, como la cadaverina, la histamina, el indol y el indoxilsulfato, son productos de la descomposición de aminoácidos por géneros bacterianos como Clostridium, Bac- teroides y Proteus. Estos últimos han sido identificados como factores clave en la patogénesis de diversas afecciones cardio- vasculares debido a su capacidad para inducir inflamación y estrés oxidativo. El indoxilsulfato, en particular, estimula la li- beración de citoquinas proinflamatorias como IL-1b y TNF-a, exacerbando la inflamación crónica. Estudios han demostrado que niveles elevados de este metabolito están asociados con inflamación sistémica y daño vascular en pacientes con in- suficiencia renal y ECV (8). Además, tanto el indoxilsulfato como el p-cresol generan ROS, lo que reduce la biodisponibi- lidad de NO y altera la función endotelial. Estas alteraciones, demostradas en estudios preclínicos, contribuyen a la disfun- ción endotelial y al daño oxidativo vascular (7).
La inflamación y el estrés oxidativo asociados con estos compuestos facilitan el desarrollo de aterosclerosis, promo- viendo la formación y progresión de placas. Un metaanálisis reveló que los niveles elevados de indoxilsulfato están rela- cionados con un mayor grosor de la íntima-media carotídea, un marcador temprano de aterosclerosis (1). Además, este metabolito activa fibroblastos cardíacos, provocando cambios estructurales que resultan en fibrosis miocárdica, lo que afec- ta la función del miocardio y está asociado con un peor pro- nóstico en pacientes con insuficiencia cardíaca (4).
La modulación de la dieta es una de las estrategias más efectivas para controlar los efectos perjudiciales de los fenoles y las aminas. Incrementar la ingesta de polifenoles dietéticos ofrece efectos antioxidantes y antiinflamatorios. Estudios han demostrado que el consumo de polifenoles disminuye el es- trés oxidativo relacionado con ECV (8). Por otro lado, reducir la ingesta de proteínas animales, que aumenta la producción de compuestos como el p-cresol y el indoxilsulfato, también puede ser beneficioso. Dietas basadas en plantas han demos- trado reducir significativamente los niveles plasmáticos de estos metabolitos (7).
El uso de prebióticos, como la inulina, representa otra estra- tegia prometedora. Estos compuestos fomentan el crecimien- to de bacterias beneficiosas que desplazan a las productoras de metabolitos tóxicos. Ensayos clínicos han mostrado que los prebióticos reducen los niveles de indoxilsulfato y mejoran los marcadores inflamatorios (1). Asimismo, la suplementación con probióticos, como Bifidobacterium longum, ha demostra- do su capacidad para modular la producción de metabolitos nocivos, mejorando la función endotelial en estudios preclíni-
cos (2). En casos específicos, los fármacos quelantes como el sevelamer, se utilizan para eliminar compuestos tóxicos como el indoxilsulfato, particularmente en pacientes con insuficien- cia renal y riesgo cardiovascular. Ensayos clínicos han mostra- do que estos agentes disminuyen la inflamación sistémica y mejoran la función endotelial (2).
En términos de implicaciones terapéuticas, las estrategias de prevención primaria, como dietas ricas en polifenoles y bajas en proteínas animales, ofrecen una vía eficaz para reducir la pro- ducción de metabolitos tóxicos y proteger contra la inflamación crónica y el estrés oxidativo. En pacientes con condiciones es- tablecidas como insuficiencia cardíaca, aterosclerosis o insufi- ciencia renal, intervenciones dirigidas a disminuir los niveles de indoxilsulfato y p-cresol pueden complementar los tratamientos convencionales, mejorando los resultados cardiovasculares.
Vitaminas
La microbiota intestinal desempeña un papel fundamental en la producción de vitaminas y cofactores esenciales para la salud cardiovascular. Entre éstas, se destacan la vitamina K2, el ácido fólico y la biotina, cuyas funciones abarcan desde la regulación de la calcificación arterial hasta el metabolismo de lípidos y carbohidratos. La disbiosis intestinal puede com- prometer significativamente la síntesis de estas moléculas, aumentando el riesgo de enfermedades metabólicas y cardio- vasculares.
La vitamina K2, o menaquinona, es producida por bacterias como Bacteroides, Escherichia y Enterococcus, mediante la transformación de la vitamina K1 dietética en el colon. Su función principal es regular la calcificación arterial median- te la activación de la proteína Gla de la matriz (MGP), que inhibe la deposición de calcio en las arterias, previniendo la aterosclerosis y mejorando la elasticidad vascular. Sin embar- go, condiciones inflamatorias intestinales pueden reducir la producción de menaquinonas, incrementando el riesgo de cal- cificación arterial y otras complicaciones cardiovasculares (7). Dentro de las vitaminas del complejo B, el ácido fólico (B9) y la biotina (B7) también destacan por su influencia car- diovascular. El ácido fólico, sintetizado por bacterias como Lactobacillus y Bifidobacterium en el intestino delgado, es crucial para reducir los niveles de homocisteína, un factor de riesgo independiente para aterosclerosis y eventos cardiovas- culares. Además, participa en procesos de metilación y sín- tesis de ADN. En casos de disbiosis, la disminución de estas bacterias eleva los niveles de homocisteína, exacerbando el riesgo cardiovascular (7). Por su parte, la biotina, producida por Bacteroides fragilis y Escherichia coli en el colon, regula el metabolismo de lípidos y carbohidratos, mejorando el perfil
lipídico y reduciendo el riesgo de aterosclerosis.
Aunque la microbiota no produce directamente la vitamina D, influye significativamente en su metabolismo al regular la expresión del receptor de vitamina D (VDR) en el intestino. Esta interacción mejora la función endotelial y reduce la in- flamación sistémica, protegiendo contra hipertensión y ate- rosclerosis. Sin embargo, la disbiosis disminuye la activación del VDR, reduciendo la efectividad de la vitamina D en la homeostasis del calcio y en la regulación de la inflamación cardiovascular (3).
Entre los cofactores relacionados con la microbiota, el áci- do nicotínico (niacina) y el ácido pantoténico (B5) son esen-
ciales para la función cardiovascular. La niacina, sintetizada por géneros como Propionibacterium y Bacteroides, mejora el perfil lipídico al aumentar los niveles de colesterol HDL y re- ducir los de triglicéridos y LDL. Una microbiota desequilibrada puede disminuir su disponibilidad, afectando negativamente la bioenergética celular y el metabolismo cardiovascular (4). Por otro lado, el ácido pantoténico, producido por bacterias como Lactobacillus plantarum, es indispensable para la síntesis de coenzima A, esencial en el metabolismo de ácidos grasos y el suministro energético al corazón. La pérdida de Lactobacillus debido a disbiosis compromete la producción de este cofactor, afectando el metabolismo cardíaco bajo condiciones de estrés. Las estrategias para optimizar la producción de vitaminas y cofactores incluyen la modulación de la microbiota intestinal. Una dieta rica en prebióticos, como inulina y fructooligosa- cáridos, fomenta el crecimiento de bacterias beneficiosas pro- ductoras de vitaminas del complejo B y K2. Ensayos clínicos han demostrado que los prebióticos aumentan la síntesis de ácido fólico y biotina, contribuyendo a la salud cardiovascular
(3). Asimismo, la suplementación con probióticos, como Lac- tobacillus y Bifidobacterium, no sólo estimula la producción de estas vitaminas, sino que también mejora la regulación del VDR. Estudios en humanos han mostrado que los probió- ticos elevan los niveles plasmáticos de vitaminas y reducen los marcadores inflamatorios (7). En casos de disbiosis se- vera, estrategias avanzadas como trasplantes fecales o el uso de antibióticos selectivos pueden restablecer las poblaciones bacterianas productoras de vitaminas.
Conclusiones
La relación entre la microbiota intestinal y la salud cardio- vascular revela de qué manera los metabolitos microbianos influyen profundamente en los procesos fisiopatológicos del sistema cardiovascular. Este campo emergente amplía la com- prensión de las causas de las enfermedades cardiovasculares y abre la puerta a nuevos enfoques terapéuticos centrados en el equilibrio microbiano.
Los hallazgos actuales destacan tanto los efectos protecto- res como los perjudiciales de los metabolitos microbianos. Por un lado, los ácidos grasos de cadena corta y los ácidos biliares secundarios tienen un impacto positivo al regular el metabo-
lismo lipídico y glucémico, modular la inflamación y mejorar la función endotelial. Por otro, compuestos como el TMAO y los lipopolisacáridos están estrechamente relacionados con inflamación crónica, estrés oxidativo, disfunción endotelial y aterosclerosis, subrayando el impacto negativo que tiene la disbiosis intestinal en la salud cardiovascular.
Asimismo, vitaminas como la K2 y las del complejo B, junto con cofactores como la niacina y el ácido pantoténico, son esenciales en procesos metabólicos y vasculares. Estas moléculas contribuyen a prevenir la calcificación arterial y a mantener una función endotelial saludable. Sin embargo, una microbiota desequilibrada puede limitar su producción, exa- cerbando los riesgos metabólicos y cardiovasculares.
La disbiosis intestinal emerge como un factor central en la patogénesis de enfermedades cardiovasculares, al potenciar los efectos perjudiciales de ciertos metabolitos y limitar la sín- tesis de compuestos protectores. Esta alteración del equilibrio microbiano no sólo agrava condiciones preexistentes, sino que también incrementa el riesgo de desarrollar nuevas patologías cardiovasculares.
Frente a estos desafíos, las estrategias terapéuticas se cen- tran en promover un microbioma saludable y en modular los efectos de los metabolitos microbianos. Dietas ricas en fibras fermentables y la incorporación de prebióticos y probióticos específicos han demostrado ser herramientas efectivas para estimular la producción de compuestos protectores y reducir los metabolitos nocivos.
Además, las terapias dirigidas a modular la microbiota, como el uso de “sinbióticos” y estrategias avanzadas para res- taurar un equilibrio microbiano en casos de disbiosis severa, ofrecen un enfoque prometedor para la prevención y el trata- miento de estas afecciones. La integración de estas interven- ciones con terapias cardiovasculares tradicionales tiene el po- tencial de mejorar significativamente los resultados clínicos, reforzando el impacto de un enfoque personalizado.
Un microbioma intestinal equilibrado es fundamental para la prevención y manejo de enfermedades cardiovasculares. Las estrategias basadas en la modulación del microbioma, complementadas con tratamientos convencionales, represen- tan un camino prometedor hacia la mejora de la salud cardio- vascular y el bienestar general.
Referencias bibliográficas
- 1. Zhou W, Cheng Y, Zhu P, Nasser M, Zhang X, Zhao M. Implication of Gut Microbiota in Cardiovascular Diseases. Oxid Med Cell Longev. 2020; 2020:5394096. Disponible en: https://consensus.app/papers/implication-of-gut-microbiota-in-cardiovascular-diseases-zhou-zhou/cc55e0513ebb53eb918fdaf81cf62c81.
- 2. Tang W, Kitai T, Hazen S. Gut Microbiota in Cardiovascular Health and Disease. Circ Res. 2017;120:1183-96. Disponible en: https://consensus.app/papers/gut-microbio- ta-in-cardiovascular-health-and-disease-tang kitai/29507e3818f7573198853a0d49e0eb15.
- 3. Witkowski M, Weeks TL, Hazen S. Gut Microbiota and Cardiovascular Disease. Circ Res. 2020; 127:553-70. Disponible en: https://consensus.app/papers/gut-microbio- ta-and-cardiovascular-disease-witkowski-weeks/23727f2676595ffcb84a635dba2b766b.
- 4. Miele L, Giorgio V, Alberelli M, De Candia E, Gasbarrini A, Grieco A. Impact of Gut Microbiota on Obesity, Diabetes, and Cardiovascular Disease Risk. Curr Cardiol Rep. 2015; 17:1-7. Disponible en: https://consensus.app/papers/impact-of-gut-microbiota-on-obesity-diabetes-and-miele-giorgio/d39021e8972f54c4abe4e65ece7b745d.
- 5. Mutalub Y, Abdulwahab M, Mohammed A, Yahkub AM, Al-Mhanna SB, Yusof W, et al. Gut Microbiota Modulation as a Novel Therapeutic Strategy in Cardiometabolic Diseases. Foods. 2022; 11:2575. Disponible en: https://consensus.app/papers/gut-microbiota-modulation-as-a-novel-therapeutic-strategy-mutalub-abdulwahab/e6a728c1b- 13b5a488b1e5fa66ae705ec.
- 6. Jie Z, Xia H, Zhong S, et al. The gut microbiome in atherosclerotic cardiovascular disease. Nat Commun. 2017;8:845. Disponible en: https://consensus.app/papers/ the-gut-microbiota-in-atherosclerotic-cardiovascular-jie-xia/150fa109f6b95096b2fda5ab67f1c566.
- 7. Qian B, Zhang K, Li Y, Sun K. Update on gut microbiota in cardiovascular diseases. Front Cell Infect Microbiol. 2022; 12:1059349. Disponible en: https://consensus.app/ papers/update-on-gut-microbiota-in-cardiovascular-diseases-qian-zhang/9a313e357468591ebf1291c521d6b071.
- 8. Peng J, Xiao X, Hu M, Zhang X. Interaction between gut microbiome and cardiovascular disease. Life Sci. 2018;214:153-157. Disponible en: https://consensus.app/papers/ interaction-between-gut-microbiome-and-cardiovascular-peng-xiao/42c7784d2fa356ac83221907314b4d92.







No comments! Be the first commenter?