Utilidad coadyuvante potencial de los ácidos eicosapentanoico (EPA) y docosahexanoico (DHA), y de la citicolina en la enfermedad por coronavirus
Resumen
La enfermedad por el virus SARS-CoV-2 ha generado una pandemia desde su aparición a comienzo del año 2020 y actual- mente la sociedad humana asiste a una etapa de “peripandemia” en que se pueden observar nuevos contagios, aquellos sujetos con recontagios y grupos de personas con secuelas de la enfermedad en sistemas sistemas corporales. El sistema nervioso central es uno de los lugares donde el virus ejerce un impacto negativo desde la primoinfección y los cuadros signosintomatológicos por el impacto viral son heterogéneos y aun no se cuenta con factores de riesgo o marcadores para predecir las secuelas. Dentro de las hipótesis, y sobre la base de investigaciones llevadas a cabo intrapandemia, la tormenta de citocinas que genera el COVID es uno de los mecanismos fisiopatológicos con mayor significación en la generación de dicho impacto negativo. Dado no existe una farmacoterapia para prevenir o disminuir las alteraciones neurocognitivas descriptas debidas al COVID, existen reportes que postulan la utilidad potencial de ciertas sustancias como coadyuvantes en el tratamiento sistémico de la enfermedad. En el presente artículo se describirá la potencial utilidad del ácido eicosapentanoico, del ácido docosahexanoico y de la citicolina, sustancias que no son nuevas y se utilizaban o habían sido estudiadas para otros cuadros, en el deterioro neurocognitivo debido al COVID.
Palabras clave
COVID – Ácido eicosapentanoico – Ácido docosahexanoico – Citiloina – Deterioro neurocognitivo.
Mazzoglio y Nabar MJ, Muñiz MM, Algieri AD. “Utilidad coadyuvante potencial de los ácidos eicosapentanoico (EPA) y docosahexanoico (DHA), y de la citicolina en la enferme- dad por coronavirus”. Psicofarmacología 2023;132:4-12.
Puede consultar otros artículos publicados por los autores en la revista Psicofarmacología en sciens.com.ar
Introducción
El coronavirus pertenece al género de la familia coronaviri- dae y al oden nidovirales, un tipo de virus que tiene un ARN monocatenario el cual presenta una membrana de bicapa lipídica que contiene proteína transmembrana y proteína de la envoltura rodeando a la nucleocápside. Este virus ingresa a las células por el receptor de a enzima convertidora de angiotensina 2 (ACE2).
La primera línea de defensa del cuerpo es la expresión de interferones tipo 1 (IFN-a e IFN-b) los cuales activan el sis- tema inmunológico adaptativo lu ego de la presentación del virus por las células dendríticas a los linfocitos T. Las células T citotóxicas CD8+ son esenciales para destruirlo, mientras
que las T CD4+ se dividen en auxiliares (Th1, Th2, Th17) y reguladoras (Tregs).
El SARS-CoV-2 genera un boqueo de la primera línea de defensa impidiendo la expresión de los interferones, y la proli- feración descontrolada desencadena gran afluencia de neutró- filos y macrófagos que promueven una liberación exacerbada de citocinas proinflamatorias.
La reciente pandemia de COVID-19 que ha comenzado en el primer trimestre de 2020, y que actualmente el mundo se encuentra en un momento de peripandemia, está causada por el virus SARS-CoV-2. Este agente etiológico ha provocado un cambio significativo en la cotidianeidad de los humanos (mu- chos de los cuales se mantienen y seguramente continúen) así como la muerte de muchas personas, de distintas edades y con factores de riesgo dispares.
El fallecimiento de los pacientes infectados se atribuyó al fenómeno denominado “tormenta de citocinas” o “síndrome de liberación de citocinas” o “síndrome de sobreactivación de macrófagos” (Mehta et al., 2020). Los eventos moleculares que la precipitan no se han dilucidado debido a la naturaleza compleja de síndrome (Tisoncik et al., 2012).
Artículos de investigación recientes han sugerido que los nutrientes específicos como las vitaminas B6, B12, C, D, E y folatos, como oligoelementos incluidos el zinc, el hierro, el selenio, el magnesio y el cobre, podrían desempeñar un papel clave en el manejo de la tormenta de citocinas (Calder et al., 2020; Grant et al., 2020; Muscogiuri et al., 2020).
El objetivo del presente artículo es actualizar sobre el conocimiento científico de ciertos nutrientes, los ácidos eicosapentanoico (EPA) y docosahexanoico (DHA), así como de la citicolina, sobre la tormenta de citocinas y su posible implicancia clínica en la infección por coronavirus.
Desarrollo
Bases fisiopatológicas del impacto deterio- ro neurocognitivo debido al COVID
La fisiopatología del SARS-CoV-2 es multifactorial y se han propuesto 3 mecanismos del impacto a nivel cerebral.
Uno es el de “neurotropismo y capacidad directa” por el que el virus ingresa en las neuronas y células de la glia y genera una disfunción y daño neuronal. El virus ingresa al sistema nervioso central por la barrera hematoencefálica y/o por el mecanismo de trasmisión axonal desde neuronas del epitelio olfatorio como fuera publicado por Meinhardt y cols luego de estudiar cerebros postmortem donde hallaron ARN y proteínas del SARS-CoV-2 en regiones de la nasofaringe y cortezas olfatorias cerebrales. Tanto este equipo de investigación como el encabezado por Alomari et al sugirieron que el virus seguiría las estructuras y vías neuroanatómicas hasta los centros respiratorio y cardiovascular del bubo raquídeo (Meinhardt et al., 2021; Alomari et al, 2020) y participar en el colapso respiratorio del tronco (Gandhi et al., 2020).
En segundo lugar, se ubican las “consecuencias negativas secundarias a la respuesta inflamatoria” llamada tormenta de citocinas por la respuesta excesiva que genera el COVID en el sistema inmunitario alterado del huésped. Aquí se han descripto dentro de su perfil sistémico muchas citocinas im- plicadas que aumentan su concentración como la IL-6, IL-7, TNF, las quimiocinas inflamatorias como las CCL2, CCL3 y CXCL10 y la forma soluble de la cadena del receptor de IL-
2. Dicho perfil de citocinas es similar al de la activación de macrófagos, por lo cual se planteó que la desregulación de los fagocitos mononucleares está implicado en la hiperinflación asociada al COVID (Merad y Martin, 2020). Se planteó que la regulación de esta cascada inflamatoria estaría mediada por una vía de la acetilcolina liberada por el parasimpático con acción en macrófagos tisulares (Tracey, 2002), y Anoop sugirió que la desregulación de la cascada genera que el virus se extienda hasta el núcleo del tracto solitario y cause una trasmisión defectuosa de dicha vía colinérgica con función antiinflamatoria y del eje hipotálamo-pituitario suprarrenal (Ur y Verma, 2020). El equipo encabezado por Mazza et al. (2021) estudió prospectivamente a 3 meses a un grupo de infectados y hallaron que casi el 80% tenía un desempeño deficiente en al menos un dominio cognitivo, con funciones ejecutivas y coordinación visuomotora deterioradas en el 50- 57%; y documentaron un denominado índice de inmunoin- flamación sistémica (surge de la fórmula de plaquetas por neutrófilos sobre los linfocitos) asociado con la respuesta in- munitaria e inflamación sistémica. Los hallazgos se asocian con el impacto post-COVID o consecuencias postagudas del mismo que provocan una inflamación sistémica a largo plazo con impacto neurocognitivo y emocional.
El tercer mecanismo propuesto es la “isquemia global secundaria a la insuficiencia respiratoria” la cual fuera descripta a partir de investigaciones de García-Grimshaw et al. (2022) y Frontera et al. (2021). El primer grupo de investigación realizó un seguimiento a 6 meses de pacientes que habían sido ingresados por neumonía grave, de los cuales el 54% presentaban deterioro cognitivo, y hallaron que los valores bajos en el índice de PaO2/FiO2 se asociaba con el rendimiento cognitivo, mientras que el componente tromboinflamatorio no tenía un impacto estadístico. Para esta investigación la hipoxemia tenía un papel principal en la activación del deterioro cognitivo. El segundo grupo, encabezado por Frontera et al, también realizo un estudio prospectivo por igual tiempo de pacientes con neumonía por COVID y que habían presentado alteraciones neurológicas comparados con un grupo que no las habían presentado. Si bien describieron la implicancia estadística de las alteraciones neurológicas en las actividades de la vida diaria y en la probabilidad de reanudar actividades laborales, no hallaron relación entre la depresión y las puntuaciones obtenidas en pruebas cognitivas por lo cual sugirieron que la depresión per se, y solamente, no es la causa del deterior cognitivo.
El impacto en la neurocognición por parte del COVID-19 es muy prevalente, tanto en la etapa aguda como a largo plazo y con un deterioro que puede ser persistente a largo plazo en ambos casos. Los reportes documentaron que el deterioro neurocognitivo oscila entre el 15 y 80%, especialmente en los circuitos atencionales y las funciones ejecutivas, que afectan distintos tipos de redes mnésicas y pueden afectar otras fun- ciones como las visuoespaciales o del lenguaje (Daroische et al., 2021). Estos valores de frecuencia del cuadro, ya desde con deterioros neurocognitivos leves a graves, se observan des- de las 4-6 semanas después del inicio de los síntomas de la enfermedad (Jaywant et al., 2021) y, en muchos casos puede constituir un síndrome de COVID largo o “long-COVID” como fuera postulado por Elisa Perego el 20 de mayo de 2020.
También se ha reportado la “niebla mental” por el COVID,
término que refiere a la sensación de bradipsiquia, confusión, dificultades de focalización y distracción, lo cual no es un diagnóstico médico. Este cuadro fue asociado con algunos factores de riesgo como el sexo femenino, los problemas res- piratorios al inicio, y el ingreso a unidades de cuidados inten- sivos (Asadi-Pooya et al., 2021).
En todos los casos se asoció al descripto síndrome de “tor- menta de citocinas” como la base fisiopatológica de los mis- mos mediante la cual la hiperinflamación realiza una estimu- lación patológica de la respuesta autoinmune.
Utilidad coadyuvante potencial de las sus- tancias plateadas
Se han descripto distintos componentes dietarios, así como de suplementos nutricionales con acciones potenciales frente a las infecciones virales. Se dividen según el mecanismo de acción: aquellos que atacan la replicación viral, los que au- mentan la respuesta inmune o aquellos que contrarrestan la respuesta inmunitaria anulada.
Los que atacan la replicación viral son nutrientes con acti- vidad antiviral que frenan o disminuyen la capacidad de re- plicación, entre los que se describen el zinc, jenjibre, hinojo, jugos cítricos, miel y los probióticos. Entre los nutrientes que impulsan el sistema inmune mediante la mejora en la res- puesta de células inmunitarias se encuentran las vitaminas C, E, A, los ácidos grasos omega 3, jenjibre, hinojo, las fibras y probióticos. Del grupo de nutrientes que contrarrestan la res- puesta inmunitaria anulada, son aquellos que contrarrestan el balance de la tormenta de citocinas cuando la respuesta inmune está saturada, se encuentran las vitaminas C y D, el selenio, jenjibre, la dieta cetogénica y la miel.
El ya mencionado “síndrome de tormenta de citocinas” es una alteración en las citocinas (reguladoras, proinflamatorias y antiinflamatorias) que genera una estimulación patológica en la respuesta innata y adaptativa (mediada por Th17 y Th1). El COVID-19 se une a la enzima convertidora de angiotensina 2 (ACE-2) y provoca la cascada de los procesos moleculares que resultan en la hiperinflamación. En su fisiopatología se destaca el papel de la interleukina 6 (IL-6) la cual tiene un papel clave en la patogénesis del COVID-19 puesto aumenta significativamente en los pacientes con síntomas graves. Esta interleukina es bloqueada con el tocilizumab (anticuerpo monoclonal) y es un objetivo terapéutico en infecciones por SARS-CoV (Liu et al., 2020), además de reducir la expresión de citocinas proinflamatorias adicionales (IL-1ß, IL-38) con efectos beneficiosos (Conti et al., 2020).
Las secuelas neuropsiquiátricas postCOVID se presentan más frecuentemente en personas que cursan o hayan cursado una enfermedad por COVID grave y en mujeres. Es considera- do como una enfermedad vascular pese a que el virus no tiene una completa permeabilidad para atravesar la barrera hema- toencefálica con facilidad, y genera la denominada “niebla mental” descripta. La clínica de este cuadro incluye alteracio- nes neurocognitivas, cefalea, confusión, desorientación, an- siedad, trastornos del estado del ánimo y asociación con epi- sodios de ictus. La etiología de estas secuelas se asocia con las citocinas producto de la tormenta descripta y pequeños ic- tus. Desde la neuropsicología, se han descripto trastornos en la memoria semántica de la memoria episódica, los trastornos disejecutivos y las alteraciones atencionales, especialmente en la atención focalizada y la sostenida; estas alteraciones presentan un patrón de tipo subcortical.
Hoy en día, no existe un tratamiento farmacológico apro-
bado para los síntomas neurocognitivos posteriores al COVID, aunque por sus características el tratamiento podría incluir la estimulación cognitiva, la rehabilitación del lenguaje y el abordaje por terapistas ocupacionales, según el caso por caso. El tratamiento deberá ser multidisciplinario, y frente a la alta prevalencia de trastornos cognitivos a corto y largo plazo exis- ten moléculas con otros usos e indicaciones que podrían ejer- cer un rol positivo en este cuadro atento a la fisiopatología de este, los cuales se describirán a continuación.
Ácido eicosapentanoico (EPA) y ácido do- cosahexanoico (DHA)
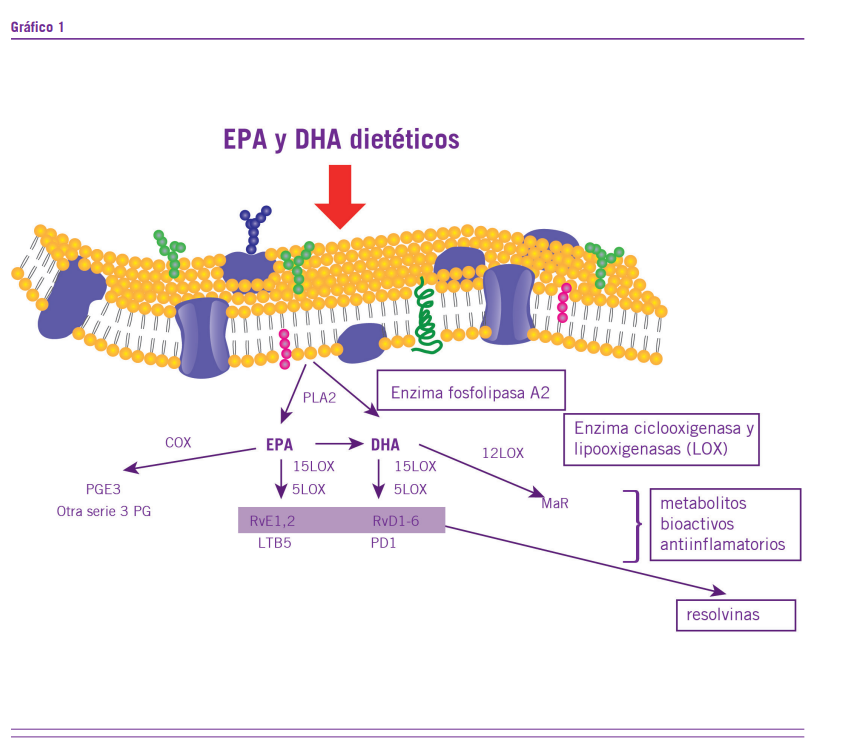
Los ácidos grasos poliinsaturados de cadena larga como EPA (ácido eicosapentaenoico) y DHA (ácido docosahexaenoi- co) se destacan por influir directamente en la respuesta inmu- nológica a infecciones virales (Calder et al., 2020; Messina et al., 2020). Estos, están regulados por la ingesta dietética y/o suplementaria del individuo, y pueden modular la respuesta inmune en distintas vías (Calder, 2007, 2013; Zivkovic et al., 2011; Maskrey et al., 2013; Tao, 2015; Allam-Ndoul et al., 2017), así como afectar a los inmunomoduladores complejos y limitantes de la tormenta de citocinas como las IL-6 e IL-1b. Se han descripto vías para el metabolismo del DHA y el EPA las cuales producen metabolitos antiinflamatorios. El EPA genera metabolitos como la PG53 y otras PG, mediante la cocloxigenasa; los RvE1,2 (resolvina 1,2) y LTB5 mediante
las lipooxigenasas 15 y 5 (15LOX, 5LOX) y genera el DHA que va a producir la RvD1-6 (resolvinas D1-6) y PD1 por medio de las LOX descriptas, así como MaR a través de la 12LOX. Todos los metabolitos mencionados son bioactivos antiinflamatorios que reducirán a las IL6, IL1 o el TNF que son clave en la tor- menta de citocinas (Gráfico 1).
Las enzimas dependientes de la polimerasa tienen propie- dades antiinflamatorias puesto mejoran los niveles tisulares de DHA y EPA, así como sus metabolitos antiinflamatorios (Kiss et al., 2015; Curtin et al., 2020). Los niveles tisulares de DHA y EPA se logran mediante la incorporación de éstos a os fosfolípidos de membrana con un proceso que es dosis y tiempo-dependiente, aunque la incorporación de EPA ocurre más rápido (Calder, 2013). Así, se genera un efecto antiinfla- matorio del EPA y DHA que está asociado con la disminución
del ácido araquidónico (ARA) en fosfolípidos de la membrana. Dentro de los metabolitos antiinflamatorios que sinergizan las propiedades se encuentra el 17-hDHA (metabolito DHA) que reduce la secreción de IL-6 en las células B humanas con un efecto reductor de triglicéridos (Yanai et al., 2018; Zhou et al., 2019; Abdelhamid et al., 2020); dicha disminución de triglicéridos se asoció con un menor riesgo de “tormenta de citocinas” (Mehta et al., 2020).
Tanto el EPA como el DHA pueden disminuir la secreción de citocinas inflamatorias in vitro y en estudios con animales (Gutiérrez et al., 2019). En estudios de investigación se obje- tivó que la pre-suplementación con DHA (400 mM) disminuyó significativamente la liberación de IL-6 e IP-10 en células in- fectadas con rinovirus (Saedisomeolia et al., 2009), así como un estudio controlado y aleatorizado con suplementación a dosis altas (1,5 g/día de EPA y 1,0 g/día de DHA) pudieron re-
ducir los niveles de IL-6 e IL-1b (Tan et al., 2018) (Gráfico 2). La obesidad es un factor predisponente para desarrollar peores resultados y/o complicaciones, conlleva niveles más altos de ácidos grasos dentro de los que muchos son proinfla-
matorios (Bistrian et al., 2020).
Cantidades menores a 1 g/d de EPA y DHA (ingesta dieté- tica sustancial de pescado de agua fría) pueden tener efectos antiinflamatorios leves, mientras que cantidades mayores a 4-6 g/d de EPA y DHA (ingesta suplementaria) tienen efectos más potentes y beneficiosos sobre la secreción de citocinas y la respuesta inflamatoria. La Oficina de Suplementos Die- tarios dependiente del Instituto Nacional de Salud (NIH) pu- blicó que una ingesta diaria de EPA + DHA de hasta 3,0 g/d es segura, mientras que la Autoridad Europea de Seguridad en Alimentos (EFSA, European Food Safety Authority 2012) determinó que el consumo a largo plazo de suplementos de EPA y DHA en dosis combinadas de hasta aproximadamente 5 g/día es seguro para el público en general.
Las resolvinas derivadas del EPA y DHA tienen un papel importante durante la sepsis. Pontes-Arruda y cols. (2006) investigaron el efecto de la dieta enteral enriquecida con EPA
+ GLA + antioxidantes durante 28 días en la sepsis grave o durante el shock séptico que requerían ventilación mecánica y observaron que contribuía a mejorar los resultados clínicos en los pacientes internados en la unidad de cuidados intensi- vos, con tasas de mortalidad más bajas. Hosny et al. (2013) evaluaron la eficacia y seguridad del EPA y DHA en dosis altas (9 g/d junto a otros nutrientes) en los pacientes con sepsis en etapa temprana durante 7 días y observaron que tenían nive- les más bajos de IL-6 y procalcitonina, una menor duración del tiempo de ventilación mecánica y un menor desarrollo a sepsis grave.
Los ensayos con suplementación de EPA y DHA, con o sin antioxidantes, en pacientes con distress respiratorio demostra- ron resultados favorables en múltiples desenlaces: inflamato- rios, respiratorios y clínicos. El metaanálisis de Pontes-Arruda et al. (2008) informaron una reducción en los días sin venti- lación, menores fallas orgánicas, menor duración de estada en unidad de cuidados intensivos y menor mortalidad. Cochrane (Dushianthan et al., 2019) concluyó una mejora significativa en oxigenación de la sangre y reducción en la necesidad de ventilación, fallos orgánicos, estada en unidad de cuidados intensivos y de la mortalidad a los 28 días.
La suplementación con EPA y DHA podría tener implicacio- nes importantes en pacientes con COVID-19 críticamente en- fermos, lo cual fue corroborado por varias investigaciones que se centraron en sus propiedades antiinflamatorias y de me- tabolitos, que ayudan en la tormenta de citocinas, mejoran- do la inflamación, la lesión pulmonar y los síntomas de tipo neuropsiquiátrico (Dushianthan et al, 2019; Bistrian, 2020; Messina et al, 2020; Calder et al, 2020; Torrinhas et al., 2020]. Torrinhas et al. (2020) concluyó que las propiedades inmunomoduladoras pueden cambiar resultados clínicos de pacientes infectados y sugirieron una prescripción basada en el peso corporal (0,2 g/kg de peso corporal/día) y considerar la combinación con una ingesta baja de ácido acetilsalicílico vía oral, para desencadenar la síntesis de resolvina. El uso del ácido acetilsalicílico fue postulado como posible potenciador de los efectos del EPA y DHA para prevenir la aparición de la inflamación e incluso resolverla (Ramkumar, 2017; Serhan, 2014).
Ahmed y Eikazzaz (2021) describieron que los medicamen- tos como la fenformina y el ácido docosahexaenoico (DHA) compiten con el virus del COVID-19 por la unión de la enzima convertidora de angiotensina 2 (ACE2) e inhiben la actividad de IL-6, por lo que evitan la tormenta de citocinas. Asimismo, describieron que los resultados revelaron cinco fitoquímicos con altas afinidades de unión y mejores interacciones con los sitios activos de IL-6 como el galato de epigalocatequina (EGCG), bromelina, luteolina, vitexina e isovitexina. El ácido docosahexaenoico (DHA) tiene una afinidad de unión e inte- racciones moderadas con los sitios activos de IL-6 y una alta afinidad de unión con las mejores interacciones con los sitios activos de ACE2.
El grupo encabezado por van de Rest y colaboradores (2008) investigaron el efecto de EPA y de DHA en el rendimiento cog- nitivo a través de un estudio doble ciego, controlado contra placebo, en 302 participantes mayores de 65 años a los que se les indicó 1,800 mg/d EPA+DHA, 400 mg/d EPA+DHA, o placebo por 26 semanas y no observaron un efecto significa- tivo en las pruebas cognitivas implementadas. Pero Quinn y cols. (2010) realizaron un estudio aleatorizado, doble ciego, controlado contra placebo sobre el suplemento de DHA en personas con deterioro neurocognitive leve y moderado, con dosis de DHA de 2 g/d en término de 18 meses y concluyeron que el suplemento de DHA no detenía el deterioro cognitivo, pero tenía efectos sobre la funcionalidad de los pacientes.
El comité de expertos encabezado por Troesch y cols. (2020)
concluyó que “los efectos de DHA y de EPA son aún inconsis- tentes debido al rango de dosis evaluados, el tiempo y dura- ción, así como la ingesta nutricional base de los sujetos” pero aclararon que se requieren estudios con diseños de investiga- ción más específicos para generar conclusiones sin sesgos y estrategias individuales de acción terapéutica”.
Clare Morris y cols. (2003) concluyeron que el consumo de ácidos grasos poliinsaturados de cadena larga se asociaría con menor deterioro cognitivo asociado con la edad. Van de Rest y cols (2016) examinaron la asociación entre ácidos grasos de cadena larga sobre dominios cognitivos (memoria episódica, de trabajo y semántica, velocidad de procesamiento y habili- dades visuoespaciales) luego de casi 5 años y publicaron que los resultados sugirieron efectos protectores en el deterioro cognitive multidominio, sin ubicar datos relevantes en rela-
![]()
Gráfico 2
Efectos del suplemento de DHA y EPA en la producción de citocinas.
| Autores | Tipo | Suplemento | Sujetos | Sujetos | |||
| Ramon et al. (2012) | in vitro | a50nM 17-hDHA | Células B CD19+ | ↓ IL-6 44%a | |||
| b100nM 17-hDHA | ↓ IL-10 49%a; 54%a | ||||||
| Allam-Ndoul et al. (2017) | in vitro | a10mM DHA | Células monocíticas de leucemia aguda de línea THP-1 | ↓ IL-6 12%a | ↓ TNF 6%a | ||
| b50mM DHA | ↓ IL-6 19%b | ↓ TNF 12%b | |||||
| c750mM DHA | ↓ IL-6 30%c | ↓ TNF 15%c | |||||
| d10mM EPA | ↓ IL-6 6%d | ||||||
| e50mM EPA | ↓ IL-6 13%e | ||||||
| f750mM EPA | ↓ IL-6 24%f | ↓ TNF 18%f | |||||
| Saedisomeolia et al. (2009) | in vitro | a200mM DHA | Células epiteliales respiratorias (calu-3) con RV-43 | ↓ IL-6 16%b | |||
| b400mM DHA | w↓ IL-10 28%b | ||||||
| c200mM EPA | |||||||
| d400mM EPA | |||||||
| Células epiteliales respiratorias (calu-3) con RV-1B | ↓ IL-6 13%a | ||||||
| ↓ IL-6 29%b | |||||||
| ↓ IL-10 24%b | |||||||
| Tan et al. (2018) | RCT | a1,5 g/d DHA por 4 semanas | Plasma de pacientes con úlceras venosas crónicas de MMII | ↓ IL-6 12%a | ↓ IL-1b 29%a | ↓ TNF-a 12%a | |
| b1,5 g/d DHA por 8 semanas | ↓ IL-6 22%b | ↓ IL-1b 44%a | ↓ TNF-a 23%b | ||||
| Vedin et al. (2008) | RCT | 1,7 g/d DHA y 0,6 g/d EPA | Leucocitos de la sangre de pacientes con demencia | ↓ IL-6 43% ↓ IL-1b 35% | |||
| Kiecolt-Glacer et al. (2012) | RCT | a2,5 g/d n-3 PUFAs | Suero de adultos sanos | ↓ IL-6a,b | |||
| b1,25 g/d n-3 PUFAs | ↓ TNF-aa,b | ||||||
| Zhou et al. (2019) | RCT | a3,6 g/d EPA + DHA | Células mononucleares periféricas | ↓ TG 20%a | ↓ IL-6 37%a | ↓ TNF-a | |
| b1,8 g/d EPA + DHA | ↓ TG 13%b | ||||||
| Muldoom et al. (2016) | RCT | 0,4 g/d DHA y 1 g/d EPA | Suero de adultos sanos | IL-6 | |||
Modificado de Szabó et al., 2020.
ción con el APOE e4.
Diversos estudios de investigación con EPA + DHA indica- ron un beneficio en la mortalidad de etiología cardiovascular y una correlación inversa con estos episodios cardiovasculares y puntualizaron que, sumado al rol antioxidante y antiinfla- matorio, los ácidos de cadena larga regularían la homeostasis plaquetaria con un menor riesgo de trombosis, útil en la tera- pia para COVID19.
Citicolina
La citicolina (su nombre químico citidina 5’-difosfocolina) es un 5´nucleótido de pirimida y una sustancia natural que actúa como precursor en la síntesis de la lecitina (fosfatidil- colina) y otros fosfolípidos de membrana, que incrementa la sín- tesis de la acetilcolina y la actividad agonista colinérgica directa. Es un intermediario en la biosíntesis de la fosfatidilcolina que tiene acciones neuroprotectoras por las cuales disminuye el daño celular estructural causado por la isquemia, dichas acciones incluyen: la prevención de la liberación de ácidos grasos, la estimulación de la síntesis de fosfatidilcolia, la pre- servación de los niveles de cardiolipina y esfingomielina, el aumento de la síntesis de glutatión, la restauración de la ac-
tividad de la bomba Na/K ATPasa y efectos antiapoptóticos.
La cicitolina puede ser de forma endógena como donante de colina para biosíntesis de Ach y fosfolípidos de membrana neuronal o por un suplemento dietético que mejora integridad estructural y funcional de la membrana y su reparación.
La citicolina protege la integridad de las membranas, tiene un efecto antioxidante, una acción vasoactiva y antiagregan- te, actividad antiapoptótica y prodopaminérgicra, además de estimular la liberación de la hormona de crecimiento puesto aumenta la liberación de factor de liberación de dicha hormo- na (este efecto tiene un significado clínico incierto hasta el momento).
Dado estas funciones, genera:
- Activación en la síntesis de fosfolípidos estructurales de la membrana neuronal.
- Incremento del metabolismo cerebral.
- Incremento en los niveles de concentración de dopamina y noradrenalina.
- Reabsorción del edema cerebral.
La citicolina ha sido investigada y propuesta para un uso terapéutico en neuropsiquiatría como el ictus isquémico (des- de su función neuroprotectora), la demencia multiinfarto, las demencias tipo Alzheimer y Parkinson, los traumatismos craneales y discinesias tardías. Estas aplicaciones en la clínica surgieron de los mecanismos complejos que involucran una actividad estabilizadora de membrana, antirradicales libres y antiapoptótica, así como publicaciones de evidencias clínicas de mejoría en el pronóstico funcional de accidentes cerebro-vasculares agudos y de resultados funcionales en las alteraciones motoras, neurocognitivas y psiquiátricas en los TEC, y debido a su perfil clínico y farmacocinético se describieron en estrategias combinadas junto con los trombolíticos, factores de crecimiento, levodopa (para las bradicinesias).
Alvarez et al. (1999) reportaron que la citicolina mejoró el rendimiento cognitivo en pacientes con demencia tipo Alzhei- mer con apolipoporteína E4 (APOE E4) y que esta mejora en la cognición fue más pronunciada en pacientes con deterioro neurocognitivo leve. Objetivaron un aumento en la velocidad del flujo sanguíneo cerebral mediante doppler transcraneal así como en la velocidad diastólica de la arteria cerebral media izquierda (p <0,05); y demostraron un aumento en el porcen- taje de la actividad bioeléctrica cerebral de tipo alfa (en elec- trodos occipitales) y theta (en electrodos del lado izquierdo), acompañado de una disminución en la actividad delta relativa particularmente acentuada en el lóbulo temporal izquierdo. Este grupo publicó que el tratamiento con citicolina tendió a reducir los niveles séricos de IL-1 beta e IL6 luego de 4 semanas de administración y no provocó reacciones adver- sas clínicas ni alteraciones en los parámetros biológicos ni hematológicos. Concluyeron que una dosis de 1000 mg/d de citicolina fueron bien tolerados, que mejoraban el rendimien- to cognitivo, la perfusión sanguínea cerebral y el patrón de actividad bioeléctrica cerebral en los pacientes con deterioro mental leve y/o portadores del alelo E4 del APOE.
Previamente el estudio de Franco-Maside et al. (1994) reportó que la citicolina disminuyó significativamente la am- plitud espectral en la banda theta en los electrodos frontales y temporales, y que no modificó los parámetros de potencia relativa (delta, theta, alfa, beta) en comparación con los re- gistros basales. En los pacientes con deterioro neurocogni- tivo tendió a aumentar la potencia alfa relativa en los elec- trodos posteriores (parietoocipitales) y detectaron una mejora significativa en el rendimiento mental después de 1 mes de tratamiento, los datos de actividad eléctrica cerebral se co- rrelacionaron con parámetros cognitivos. Hipotetizaron que los cambios bioeléctricos inducidos serían el resultado de la actividad inmunogénica y/o neurotrófica del fármaco en las proximidades del microambiente vascular.
El estudio de Carabelos et al. (1996) utilizó la administra-
ción de 1000 mg/d de citicolina por vía oral durante un mes en pacientes con demencia tipo Alzheimer y registraron que el fármaco mejoró ligeramente el rendimiento mental, tendió a reducir la actividad theta en las regiones fronto-tempora- les, aumentó el ritmo alfa en las áreas occipitales y mejoró la perfusión cerebrovascular al aumentar la velocidad del flujo sanguíneo y reducir los índices de pulsatilidad y resistencia. Agregado a esto, objetivaron que disminuyó los niveles de his- tamina e interleucinas 1 y 6 en la sangre y el suero, respecti- vamente, con un aumento del TNF plasmático.
Fernández-Novoa et al. (1994) estudiaron el rol de la his- tamina en pacientes con demencia tipo Alzheimer de inicio temprano y de inicio tardío en tratamiento con citicolina (1000 mg vía oral por 30 días) dado que ésta regula células inmunes y se encuentra alterada en esta patología (elevada en cerebro, suero y líquido cefalorraquídeo). La citicolina redujo al doble los niveles basales de histamina en sangre tanto en personas con demencia tipo Alzheimer de inicio temprano como del tardío, dicha reducción fue observada a las 2 horas posteriores de la administración y progresó gradualmente durante los 30 días de tratamiento. De esta forma confirmaron los efectos inmunogénicos potenciales y también que un exceso de histamina podría influir en algunos eventos etiopatogénicos en la DTA.
Por último, Gruber et al. (2015) realizaron un estudio con
resonancia magnética funcional en consumidores crónicos de marihuana para evaluar el impacto en la impulsividad y variables neurocognitivas. En el grupo con citicolina se demostró un mayor porcentaje de mejorías en relación con el placebo durante la interferencia de la prueba de Stroop. Mediante la resonancia magnética funcional y durante la interferencia se reveló un aumento de la activación en los tratados con citicolina, mientras que en os que recibieron placebo la activación se desplazó anatómicamente hacia zonas rostrales y permaneció en el cíngulo posterior y medio. Durante la nominación de colores se objetivó un cambio de la activación del cíngulo posterior y medio a la corteza genual en tratados con citicolina, mientras que en los controles persistió la activación posterior, pero con mayor intensidad.
Conclusiones
Los ácidos eicosapentanoico y docosahexanoico parecen tener un efecto beneficioso potencial en el manejo de la “tor- menta de citocinas” de pacientes con COVID-19. También la citicolina podría tener un efecto positivo para la disrup- ción neurocognitiva asociada al cuadro, especialmente por su acción en circuitos atencionales. El uso de estas moléculas podría considerarse como una terapia farmacológica de apoyo y una estrategia para minimizar el impacto y evolución de la infección por SARS-Cov-2 en el sistema nervioso central.
Al día de hoy no se han publicado fármacos para esta dolencia, y dado los mecanismos etiopatogénicos descriptos en el cuadro, estas moléculas podrían intervenir positivamente. Se requiere de estudios clínicos controlados y aleatorizados que puedan confirmar estas propuestas con un diseño metodológico y cantidad de intervinientes acordes, además de tener en cuenta estrategias no farmacológicas que sinergicen los tratamientos.
Bibliografía
- Abdelhamid, A. S., Brown, T. J., Brainard, J. S., Biswas, P., Thorpe, G. C., Moore, H. J., et al. (2020). Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease. Cochrane Database Syst. 3(3):CD003177.
- Ahmed AKA, Eikazzaz M (2021). Natural phytochemicals, Phenformin, and Docosahexae- noic acid (DHA) as a Novel Inhibitors of IL-6 and ACE2 receptors, a Therapeutic Strategy for tar- geting COVID-19 Cell Entry and Cytokine Storm. An insilico Approach. Resear Square https://doi. org/10.21203/rs.3.rs-918251/v1.
- Allam-Ndoul, B., Guenard, F., Barbier, O., and Vohl, M. C. (2017). A study of the differential effects of eicosapentaenoic acid (EPA) and do- cosahexaenoic acid (DHA) on gene expression profiles of stimulated Thp-1 macrophages. Nu- trients 9(5):424.
- Alomari SO, Abou-Mrad Z, Bydon A (2020). COVID-19 and the central nervous system. Clin Neurol Neurosurg; 198:106116.
- Alvarez XA, Mouzo R, Pichel V, Perez P, Laredo M, Fernández-Novoa L, Corzo L, Zas R, Alcaraz M, Secades J, Lozano R, Cacabelos R (1999). Double-blind placebo-controlled study with citi- coline in APOE genotyped Alzheimer’s disease patients. Effects on cognitive performance, bra- in bioelectrical activity and cerebral perfusion.
Methods Find Exp Clin Pharmacol, 21(9):633- 644.
- Asadi-Pooya AA, Akbari A, Emami A, Lotfi M, Rostamihosseinkhani M et al. Cong COVID sín- drome-associated brain fog. J Med Virol 2021 Oct 21.
- Bistrian BR (2020). Parenteral Fish-Oil Emul- sions in Critically Ill COVID-19 Emulsions. Jour- nal of Parenteral and Enteral Nutrit 44(7):1168.
- Calder, P. C. (2007). Immunomodulation by omega-3 fatty acids. Prostaglandins Leukot. Es- sent. Fatty Acids 77, 327–335.
- Calder, P. C. (2013). n-3 fatty acids, inflam- mation and immunity: new mechanisms to exp- lain old actions. Proc. Nutr. Soc. 72, 326–336.
- Calder, P. C., Carr, A. C., Gombart, A. F., and Eggersdorfer, M. (2020). Optimal nutritional status for a well-functioning immune system is an important factor to protect against viral infec- tions. Nutrients 12:1181.
- Carabelos R, Caamaño J, Gómez MJ, Fer- nández-Novoa L, Franco-Maside A, Alvarez XA (1996). Therapeutic effects of CDP-choline in Alzheimer’s disease. Cognition, brain mapping, cerebrovascular hemodynamics, and immune factors. Ann N Y Acad Sci, 777:399-403.
- Conti, P., Ronconi, G., Caraffa, A., Gallenga,
C. E., Ross, R., Frydas, I., et al. (2020). Induc- tion of pro-inflammatory cytokines (IL-1 and IL-6) and lung inflammation by Coronavirus-19
(COVI-19 or SARSCoV-2): anti-inflammatory strategies. J. Biol. Regul. Homeost. Agents. doi: 10.23812/CONTI-E.
- Curtin, N., Banyai, K., Thaventhiran, J., Le- Quesne, J., Helyes, Z., and Bai, P. (2020). Repo- sitioning PARP inhibitors for SARS-CoV-2 infec- tion (COVID-19); a new multi-pronged therapy for ARDS? Br. J. Pharmacol. 177(16):3635- 3645.
- Daroische R, Hemminghyth MS, Eilertsen TH, Breitve MH, Chwiszczuk LJ. Cognitive impair- ment after COVID-19 A review on objetive test data (2021). Front Neurol; 12:699582.
- Dushianthan, A., Cusack, R., Burgess, V. A., Grocott, M. P., and Calder, P. C. (2019). Immu- nonutrition for acute respiratory distress syndro- me (ARDS) in adults. Cochrane Database Syst. Rev. 1(1):CD012041.
- EFSA (2012). EFSA Panel on Dietetic Pro- ducts, Nutrition and Allergies (NDA); Scientific Opinion Related to the Tolerable Upper Intake Level of Eicosapentaenoic acid (EPA), Doco- sahexaenoic Acid (DHA) and Docosapentaenoic Acid (DPA). P. European Food Safety Authority (Efsa), Italy. EFSA Journa).
- Fernández-Novoa L, Alvarez XA, Franco-Ma- side A, Caamaño J, Cacabelos R (1994). CDP-choline-induced blood histamine changes in Alzheimer’s disease. Methods Find Exp Clin Pharmacol, 16(4):279-284.
- Franco-Maside A, Caamaño J, Gómez MJ, Ca- cabelos R (1994). Brain mapping activity and mental performance after chronic treatment with CDP-choline in Alzheimer’s disease. Methods Find Exp Clin Pharmacol, 16(8):597-607.
- Frontera JA, Yang D, Lewis A, Patel P, Me- dicherla C et al. (2021) A prospective study of long-term outcomes among hospitalized CO- VID-19 patients with and without neurological complications. J Neurol Sci; 426:117486.
- Gandhi S, Srivastava AK, Ray U, Tripathi PP (2020). Is the collapse of the respiratory center in the brain responsable for respiratory break- down in COVID-19 patients? ACS Chem Neuros- ci;11(10):1379-1381.
- Garcia-Grimshaw M, Chirino-Perez A, Flo- res-Silva FD, Valdes-Ferrer SI, Vargas-Martinez MLA et al. (2022) Critical role of acute hipoxe- mia on the neurocognitive impairment after seve- re COVID-19 pneumonia: a multivariate causali- ty model análisis. Neurol Sci;43(4):2227-2229.
- Grant, W. B., Lahore, H., Mcdonnell, S. L., Baggerly, C. A., French, C. B., Aliano, J. L., et al. (2020). Evidence that vitamin D supple- mentation could reduce risk of influenza and COVID-19 infections and deaths. Nutrients 12, 988.
- Gruber SA, Sagar KA, Dahigren MK, Gonenc A, Conn NA, Winer JP, Penetar D, Lukas SE (2015). Citicoline treatmnt improves measures of impulsivity and task performance in chronic marijuana smorkers: a pilot BOLD fMRI study. Int J Neurol Neuroter; 2(3):1-8.
- Gutierrez, S., Svahn, S. L., and Johansson, M.
E. (2019). Effects of Omega-3 fatty acids on im- mune cells. Int. J. Mol. Sci. 20, 5028.
- Hosny M, Nahas R, Ali S, Abd Elshafei S, Khaled H (2013). Impact of oral omega-3 fatty acids supplementation in early sepsis on clinical outcome and immunomodulation, The Egyptian Journal of Critical Care Medicine 1 (3): 119-126
- Jayeant A, Vanderlind WM, Alexopoulos GS, Fridman CB, Perlis RH et al. (2021) Frequency and profile of objetive cognitive déficits in hospi- talized patients recovering from COVID-19. Neu- ropsychopharmacoology;46(13):2235-2240.
- Kiss, B., Szanto, M., Szklenar, M., Brunyansz- ki, A., Marosvolgyi, T., Sarosi, E., et al. (2015). Poly (ADP) ribose polymerase-1 ablation alters eicosanoid and docosanoid signaling and meta- bolism in a murine model of contact hypersensi- tivity. Mol. Med. Rep. 11, 2861–2867.
- Liu, B., Li, M., Zhou, Z., Guan, X., and Xiang,
Y. (2020). Can we use interleukin-6 (IL-6) blockade for coronavirus disease 2019 (CO- VID-19)-induced cytokine release syndrome (CRS)? J. Autoimmun.111:102452.
- Maskrey, B. H., Megson, I. L., Rossi, A. G., and Whitfield, P. D. (2013). Emerging importan- ce of omega-3 fatty acids in the innate immune response: molecular mechanisms and lipidomic strategies for their analysis.Mol. Nutr. Food Res. 57, 1390–1400.
- Mazza MG, Palladini M, De Lorenzo R, Mag-
naghi C, Poletti S et al. (2021) Persistent psy- chopathology and neurocognitive impairment in COVID-19 survivors. Effect of inflammatory bio- markers at three-month follow-up. Brain Behav Immun; 94:138-147.
- Mehta, P., Mcauley, D. F., Brown, M., San- chez, E., Tattersall, R. S., Manson, J. J., et al. (2020). COVID-19: consider cytokine storm sy- ndromes and immunosuppression. Lancet 395, 1033–1034.
- Meinhardt J, Radke J, Dittmayer C, Franz J, Thomas C, et al. (2021) Olfactory transmucosal SARS-CoV-2 invasion as a port of central ner- vous system entry in individual with COVID-19. Nat Neurosci;24(2):168-175.
- Merad M, Martin JC (2020) Pathological in- flammation in patients with COVID-19: a key role for monocytes and macrophages. Nat Rev Immunol; 20(6):355-362.
- Messina, G., Polito, R., Monda, V., Cipolloni, L., Di Nunno, N., Di Mizio, G., et al. (2020). Functional role of dietary intervention to improve the outcome of COVID-19: a hypothesis of work. Int. J. Mol. Sci. 21:3104.
- Morris MC, Evans DA, Bienias JL, Tangney CC, Bennett DA, Wilson RS, Aggarwal N, Schneider
J. (2003). Consumption of fish and n-3 fatty acids and risk of incident Alzheimer disease. Ar- chives of neurology. 60(7):940-6.
- Muscogiuri, G., Barrea, L., Savastano, S., and Colao, A. (2020). Nutritional recommendations for CoVID-19 quarantine. Eur. J. Clin. Nutr. 74, 850–851.
- Pontes-Arruda A, Aragao AM, Albuquerque JD (2006). Effects of enteral feeding with ei- cosapentaenoic acid, gamma-linolenic acid, and antioxidants in mechanically ventilated patients with severe sepsis and septic shock. Crit Care Med.; 34(9):2325-2333.
- Pontes-Arruda A, DeMichele S, Seth A, Singer P (2008). The Use of an Inflammation-Modu- lating Diet in Patients With Acute Lung Injury or Acute Respiratory Distress Syndrome: A Me- ta-Analysis of Outcome Data. Journal of Parental and Enteral Nutrition;32(6):596-605.
- Ramkumar J., Sharma N (2017). Low dose aspirin and omega-3 fatty acids in the pro-re- solving pathway of cardiovascular disorders. Car- diol. Angiol.: Int. J.; 6:1–12.
- Saedisomeolia, A., Wood, L. G., Garg, M. L., Gibson, P. G., and Wark, P. A. (2009). Anti-in- flammatory effects of long-chain n-3 PUFA in rhinovirus-infected cultured airway epithelial cells. Br. J. Nutr. 101, 533–540.
- Serhan C.N. (2014). Pro-resolving lipid media- tors are leads for resolution physiology. Nature; 510:92–101.
- Tan, A., Sullenbarger, B., Prakash, R., and Mcdaniel, J. C. (2018). Supplementation with eicosapentaenoic acid and docosahexaenoic acid reduces high level of circulating proinflam- matory cytokines in aging adults: a randomized, controlled study. Prostaglandins Leukot. Essent. Fatty Acids 132, 23–29.
- Tao, L. (2015). Oxidation of polyunsaturated fatty acids and its impact on food quality and human health. Adv. Food Technol. Nutr. Sci. 1, 135–137.
- Tisoncik, J. R., Korth, M. J., Simmons, C. P., Farrar, J., Martin, T. R., and Katze, M. G. (2012). Into the eye of the cytokine storm. Mi- crobiol. Mol. Biol. Rev. 76,16–32.
- Torrinhas R.S., Calder P., Waitzberg D.L. (2020) Letter to the Editor in relation to Bis- trian BR. Parenteral fish oil emulsions in critica- lly ill COVID-19 emulsions. J Parenter. Enteral Nutr.10.1002.
- Tracey KJ (2002) The inflammatory reflex. Na- ture;420(6917):853-9.
- Troesch, B.; Eggersdorfer, M.; Laviano, A.; Ro- lland, Y.; Smith, A.D.; Warnke, I.; Weimann, A.; Calder, P.C. (2020) Expert Opinion on Benefits of Long-Chain Omega-3 Fatty Acids (DHA and EPA) in Aging and Clinical Nutrition. Nutrients, 12, 2555.
- Ur A, Verma K (2020) Cytokine storm in CO- VID19: a neural hypothesis. ACS Chem Neuros- ci;11(13):1868-1870.
- van de Rest O, Geleijnse JM, Kok FJ, Van Sta- veren WA, Hoefnagels WH, Beekman AT, et al. (2008) Effect of fish-oil supplementation on mental well-being in older subjects: a randomi- zed, double-blind, placebo-controlled trial. Am J Clin Nutr.;88(3):706-13.
- van de Rest O, Wang Y, Barnes LL, Tangney C, Bennett DA, Morris MC. (2016). APOE epsilon4 and the associations of seafood and long-chain omega-3 fatty acids with cognitive decline. Neu- rology. 86(22):2063-70.
- Yanai, H., Masui, Y., Katsuyama, H., Ada- chi, H., Kawaguchi, A., Hakoshima, M., et al. (2018). An improvement of cardiovascular risk factors by Omega-3 polyunsaturated fatty acids.
J. Clin. Med. Res. 10, 281–289.
- Zhou, Q., Zhang, Z., Wang, P., Zhang, B., Chen, C., Zhang, C., et al. (2019). EPA+DHA,
but not ALA, improved lipids and inflammation status in hypercholesterolemic adults: a rando- mized, double-blind, placebo-controlled trial. Mol. Nutr. Food Res. 63, e1801157.
- Zivkovic, A. M., Telis, N., German, J. B., and Hammock, B. D. (2011). Dietary omega-3 fatty acids aid in the modulation of inflammation and metabolic health. Calif. Agric. 65, 106–111.







No comments! Be the first commenter?