Brolli, Vanesa – Chavez, Patricia – Furlong,
Mercedes – Luna, María José – Rioja, María
Resumen
El Síndrome de Intestino Irritable (SII) es uno de los trastornos de interacción cerebro-intestino más frecuentes del tubo digestivo, cuya prevalencia mundial es del 10 al 15%. De etiología multifactorial, presenta hipersensibilidad visceral, trastornos de motilidad y alteraciones del eje intestino-cerebro, factores psicosociales, infecciones y disbiosis intestinal, evidenciándose daño de la barrera intestinal, activación del sistema inmune local y sistémico e inflamación crónica. Un pilar del tratamiento es la modulación de la microbiota intestinal con probióticos, cuyo objetivo es impactar sobre su composición y/o funciones.
Objetivo
Examinar las recomendaciones de guías y consensos internacionales que avalen el uso de probióticos en SII.
Materiales y métodos
Estudio descriptivo y cualitativo, realizado entre Mayo y Octubre del 2023. Se incluyeron 12 Guías y/o Consensos Internacionales de Gastroenterología que identifican el uso de probióticos en pacientes adultos con SII.
Resultados
Bifidobacterium longum y Lactobacillus plantarum son las especies más recomendadas, representando el 75% de la muestra total. Así mismo, del primero, la cepa 35624 fue la
más recomendada, mejorando distensión abdominal y flatulencias.
Conclusiones
Bifidobacterium longum 35624 constituye el género, especie y cepa con mayor evidencia científica. Los probióticos son seguros; es necesario establecer género, especie y cepa específicas, así como la dosis y duración del tratamiento.
Introducción
El Síndrome de Intestino Irritable (SII) es uno de los trastornos de la interacción cerebro-intestino más frecuentes del tubo digestivo, con una prevalencia del 10 al 15% de la población mundial (1). En Argentina la prevalencia de SII es de aproximadamente un 12%, siendo más frecuente en mujeres (15%) que en hombres (2).
De acuerdo a los criterios ROMA IV el SII se diagnostica cuando existe dolor abdominal recurrente, al menos 1 día por semana, en los últimos 3 meses, asociado con 2 o más de los siguientes criterios: dolor relacionado con la defecación; asociado a un cambio en la frecuencia y/o la consistencia de las heces (3).
La etiología del SII es compleja y aún se desconoce; se han identificado factores que podrían ser responsables del desarrollo de la enfermedad como la hipersensibilidad visceral, trastornos en la motilidad del tracto gastrointestinal y alteraciones del eje intestino cerebro desencadenadas por factores psicosociales, como también ser secundario a cuadros infecciosos gastrointestinales (2). En los últimos años se incluyó como parte de esta cadena a las alteraciones en la composición y/o función de la microbiota intestinal, definida como disbiosis (4).
Bifidobacteria faecalibacterium
Existen múltiples vías directas e indirectas que mantienen una intensa interacción bidireccional entre el intestino y el sistema nervioso central, que involucran los sistemas endocrinológico, inmunitario, neurológico y metabólico. La comunicación se realiza, principalmente, a través del nervio vago y también de múltiples terminaciones nerviosas intestinales del sistema nervioso periférico. Las alteraciones en el eje
microbiota-intestino-cerebro suelen estar asociadas a ciertas patologías psiquiátricas (desde la ansiedad y la depresión hasta el autismo) e intestinales (síndrome de intestino irritable) y a la presencia de una microbiota aberrante en los individuos que las padecen. (Ver Figura 1) (5). Este desequilibrio de la microbiota se evidencia principalmente en el desarrollo del SII postinfeccioso (SII-PI), que actualmente se reconoce como el predictor más fuerte para el desarrollo del SII (6).
La disbiosis generada en el SII tiene múltiples repercusiones negativas tales como daño de la barrera intestinal, activación del sistema inmune local y sistémico, menor producción de metabolitos antiinflamatorios con alteración de los mecanismos de defensa del tracto gastrointestinal, además de alteración del sistema nervioso entérico e inflamación crónica (7).
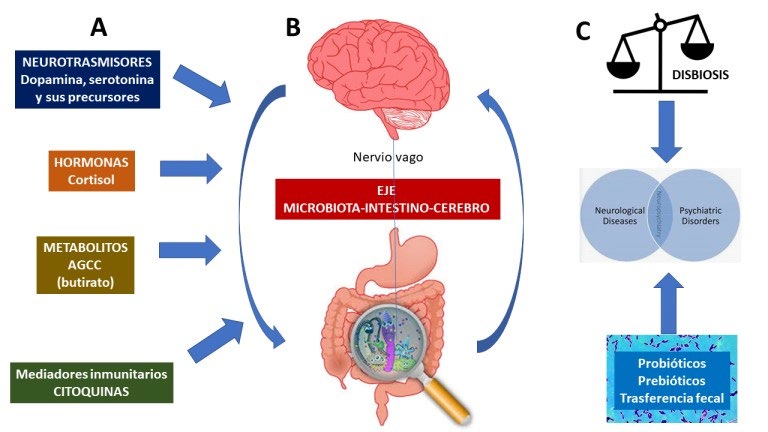
Figura N° 1: Patogénesis de la disbiosis en las alteraciones del eje intestino-cerebro
Para comprender lo antes mencionado es necesario saber que la microbiota gastrointestinal normal está conformada por un conjunto de microorganismos (bacterias, hongos, arqueas, virus y parásitos) que residen en nuestro cuerpo y participan de funciones metabólicas, nutricionales, inmunológicas y estructurales.
Pertenecen a 4 divisiones o filos previamente conocidos como: Firmicutes, Bacteroidetes, Actinobacteria y Proteobacteria. (8). Sin embargo, recientemente ha habido una reclasificación taxonómica a: Bacillota, Bacteroidota, Pseudomonadota y Actinomycetota respectivamente (Ver figura N°2) (9). El 90% de todos los tipos filogenéticos (filotipos) de bacterias colónicas pertenecen a sólo 2 de las 70 divisiones conocidas (phyla) en el dominio Bacteria: Bacillota y Bacteroidota.
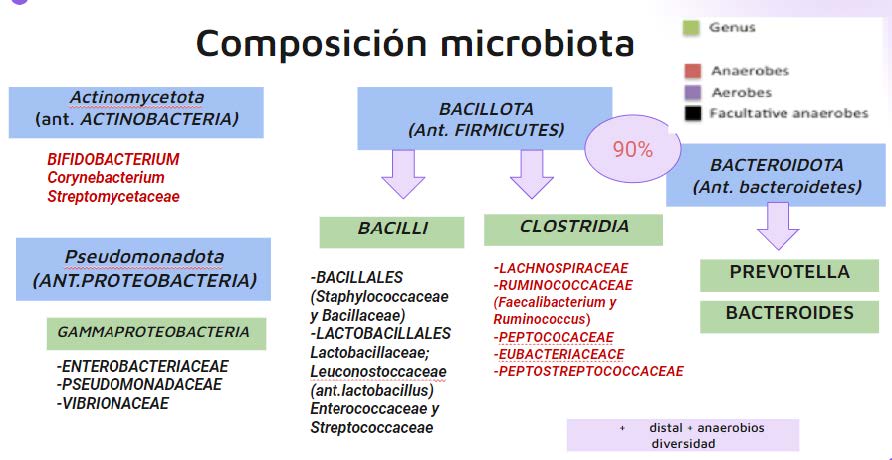
Figura N°2: Clasificación de filos bacterianos. Fuente: elaboración propia. (10)
Estas varían su composición y van aumentando su abundancia hacia los segmentos más distales del tracto gastrointestinal (8).
Si bien no existe un consenso sobre la definición de “microbiota saludable”, la diversidad, riqueza y estabilidad de la misma se consideran factores importantes para mantener homeostasis y sus funciones, particularmente durante la exposición a factores estresantes (10).
En el caso de los pacientes con SII, se observa una disminución de lactobacilos y bifidobacterias, e incluso mayor inestabilidad de la microbiota en una misma persona a lo largo del tiempo (11) (Ver figura N°3)

Figura N° 3: modificado de Disbiosis en SII. Fuente: Pittayanon, R. et al. 2019 (13)
Partiendo de este modelo multifactorial generador del SII, se podría plantear el tratamiento del SII en tres niveles. El primero, un enfoque tradicional o periférico que busca solucionar el síntoma principal (dolor, diarrea, constipación). El segundo sería el central, con la utilización de psicofármacos y/o terapias psicológicas, y el tercero la modulación de la microbiota intestinal con dieta, prebióticos, probióticos, simbióticos y antibióticos, cuyo objetivo es impactar sobre la composición y/o funciones de la microbiota intestinal (4).
Los probióticos se definen como “microorganismos vivos que, cuando se administran en cantidades adecuadas, confieren un beneficio para la salud del huésped” (12).
Los mismos deben de cumplir una serie de características para su uso como ser microorganismos no patógenos ni tóxicos, sin efectos adversos; capaces de atravesar los tramos altos del tubo digestivo manteniendo su supervivencia (resistir a la secreción gástrica, biliar, vaciamiento gástrico, motilidad intestinal) y tener capacidad de adherencia y de colonización del epitelio intestinal para seguir los efectos sobre la salud deseados; contener el número adecuado de microorganismos viables (efecto dosis-dependiente) para lograr el efecto beneficioso demostrado; incluir el género, especie y cepa específica. Este último es un requisito esencial para cualquier microorganismo que se pretenda comercializar, ya que los efectos beneficiosos sólo pueden atribuirse a las cepas estudiadas, y no a la especie o a todo un grupo de probióticos (efecto cepa-específico) (14).
Los mecanismos de acción de los probióticos a nivel intestinal incluyen la modulación de la microbiota intestinal por competencia e inhibición de la adhesión de patógenos al epitelio intestinal por la producción de bacteriocinas, ácidos grasos de cadena corta (AGCC) y biosurfactantes; mejora en la función de barrera intestinal, aumentando la capa de moco y la producción de proteínas de uniones estrechas; efectos antiinflamatorios a través de la supresión de citoquinas proinflamatorias; mejora de la inmunidad intestinal estimulando la producción de IgA secretora.
Los mecanismos implicados en la modulación de la microbiota intestinal dependen de la capacidad de las cepas probióticas o combinaciones de cepas para inhibir, desplazar o interferir en el proceso de adhesión de cepas patógenas. (19)
Además, los probióticos participan en la regulación endocrina y neurológica del intestino (16). Las señales procedentes de la microbiota intestinal modulan aspectos de la homeostasis a través de vías de comunicación neuronal, endocrinas e inmunitarias entre el intestino y el cerebro. En conjunto, esto ha establecido el concepto de eje microbiota-intestino-cerebro.
En circunstancias normales, el nervio vago es activado por microbios intestinales y metabolitos que responden a la dieta, como los AGCC, o factores endocrinos, enzimas y neurotransmisores como la serotonina, la dopamina, la acetilcolina, el glutamato, el ácido γ-aminobutírico (GABA) y la noradrenalina. Cada uno de estos factores pueden verse afectados por alteraciones en la composición de la microbiota y están implicados en la patología del SII, como se muestra en la (Ver Figura N° 1). En el SII, la fisiopatología implica una alteración de la composición de la microbiota intestinal, un deterioro de la integridad de la mucosa intestinal y una inflamación de bajo grado, varios de estos factores también pueden desencadenar fluctuaciones en la actividad del sistema nervioso entérico (SNE), con el consiguiente efecto en el cerebro.
En los pacientes con SII, las manifestaciones fisiológicas están estrechamente relacionadas con los neurotransmisores, incluyendo la motilidad gastrointestinal anormal, las anomalías sensoriales viscerales, las anomalías sensoriales centrales, la ansiedad y la depresión. Estos neurotransmisores no solo regulan el flujo sanguíneo, sino que también influyen en el movimiento intestinal, la absorción de nutrientes, la inmunidad natural del sistema gastrointestinal y la microbiota (18) (Ver figura N° 1 y 4).
Consideramos el uso de probióticos como una herramienta de relevancia en el tratamiento
del SII. Si bien existen múltiples trabajos, guías y consensos internacionales al respecto, a nivel nacional la evidencia es inconsistente y diversa. Por tal motivo realizamos una búsqueda bibliográfica que unifique la información existente como herramienta valiosa, teniendo como objetivo examinar las recomendaciones propuestas por guías y consensos internacionales avalados científicamente sobre el uso de probióticos en el SII. Los objetivos específicos fueron (i) Identificar los diferentes géneros, cepas y especies recomendadas en cada país o región (ii) Resumir las recomendaciones disponibles para mejorar las opciones terapéuticas existentes.
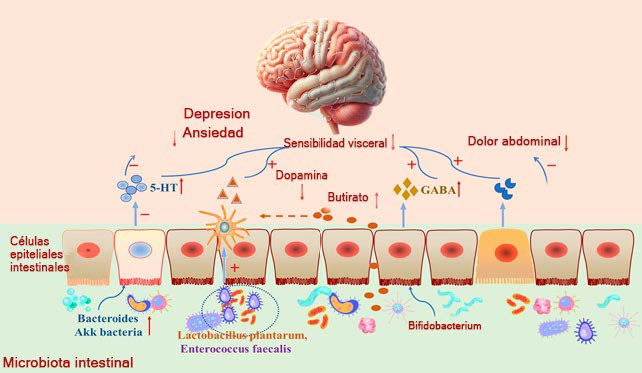
Figura N° 4: Neurotransmisores en el Eje Microbiota-Intestino-Cerebro en SII.Modificada de Minijia Chen, et al. 2022
Materiales y Métodos
Se realizó un estudio de revisión descriptiva, que incluyó búsquedas bibliográficas de registros web científicos de acceso libre y gratuito tales como “Pubmed”, “Scielo”, “Redalyc”, “Nutrients”, Elsevier, mediante palabras clave como “guías de tratamiento
SII”; “Probióticos”; “SII”;” microbiota en SII” tanto en inglés como en español. La misma se realizó entre mayo y octubre del año 2023. Se tuvieron en cuenta Guías y/o Consensos Internacionales de Gastroenterología de Organismos que identifiquen como parte del tratamiento del SII en adultos el uso de probióticos, con fecha de publicación no mayor a 7 años, a excepción de 1 consenso encontrado.
Se incluyeron en el análisis: Primer Consenso de Centroamérica y del Caribe para el SII, Consenso Latinoamericano, Recomendaciones para el manejo del SII de Francia, Guía de manejo de SII de Polonia, Guía Práctica para el Manejo del SII Canadiense, Guía Clínica de Diagnóstico y Tratamiento para el SII de México, Guía para el Tratamiento del SII de Italia, Guía Prácticas Clínica Basadas en la Evidencia para el SII de Japón, Actualización de las Directrices para el SII de Alemania, Guía de Práctica Clínica para el Diagnóstico y Tratamiento del SII de Colombia, Guía de actuación y documento de consenso de España, Guía de Actuación y Documento de Consenso sobre el Manejo de Preparados con Probióticos y/o Prebióticos y las Directrices de la Organización Mundial de Gastroenterología (21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31,32).
Se excluyeron Guías que no mencionaron los probióticos como parte del tratamiento de dicha patología por falta de evidencia y aquellas que recomendaban la utilización de probióticos multicepas (Guía Clínica del SII de Rusia, Guía del Colegio Americano de Gastroenterología para SII de EEUU y Guía de Tratamiento para el SII Británica). Los datos recolectados del género, especie y cepa de cada probiótico se agruparon según guía o consenso de cada país en una base de datos Excel destinada para tal fin.
Resultados
Se incluyeron 15 búsquedas bibliográficas inicialmente, de las cuales se excluyeron 3, por recomendar el uso de probióticos multicepas y/o excluir el uso de los mismos como parte del tratamiento del SII, quedando la muestra finalmente conformada por 12 Guías y Consensos.
Los géneros Bifidobacterium y Lactobacillus fueron los encontrados con mayor frecuencia en la bibliografía analizada representando el 83% y 75% respectivamente, contrariamente a Clostridium y Propionibacterium (8,3% cada uno).
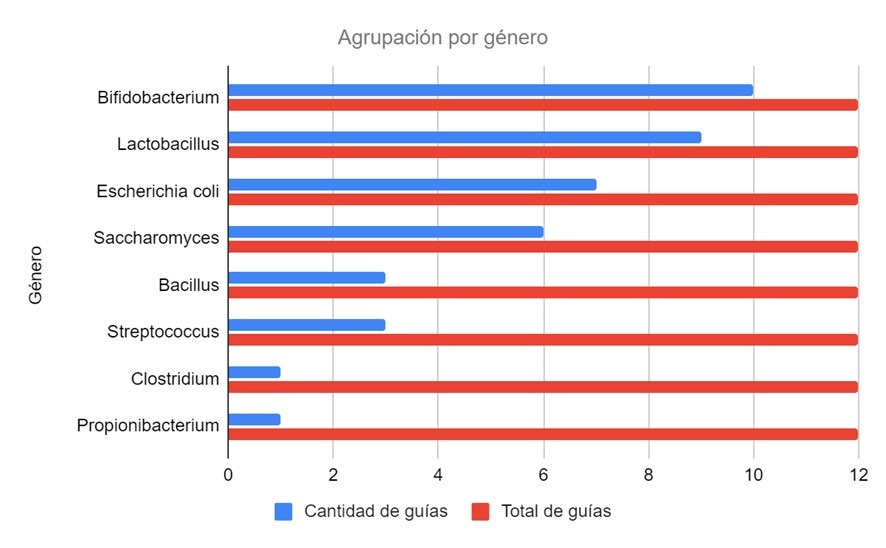
Gráfico N°1: Frecuencia de géneros bacterianos en probióticos para SII. Fuente: elaboración propia.
En cuanto a las especies, se encontró que Bifidobacterium longum y Lactobacillus plantarum son las recomendadas con mayor frecuencia, representando el 75% de la muestra total, seguidas por Escherichia coli y Bifidobacterium bifidum con 58,33% el 50% respectivamente.
Gráfico N°2: Frecuencia de especies bacterianas en probióticos para SII.Fuente: Elaboración propia
Cabe destacar que no todas las guías refieren las cepas, con lo cual la recomendación de las 3 variables juntas no pudo establecerse en el total de la muestra. A pesar de ello, al menos 9 guías/consensos nos brindaron la información completa, siendo así que Bifidobacterium longum 35624, Lactobacillus plantarum 299v, Escherichia coli DSM17252 y Bifidobacterium bifidum MIMBb75 tuvieron una frecuencia de 75%, 67%, 58% y 50% respectivamente.
Tabla N°1: Frecuencia de cepas en probióticos para SII Fuente: elaboración propia
En cuanto a la relación de cada probiótico con mejoras en la sintomatología del SII, las cepas Bifidobacterium longum 35624, Lactobacillus plantarum 299v y Escherichia coli DSM 17252 reportaron disminución en la distensión abdominal y flatulencias, en tanto Bifidobacterium bifidum MIMBb75, Saccharomyces boulardii CNCM I-745, Saccharomyces cerevisiae CNCM I-3856 disminuyeron el dolor abdominal y presentaron mejoría en la consistencia de las heces.
A su vez, se menciona que las cepas Saccharomyces cerevisiae CNCM I-3856 (29) y Escherichia coli DSM17252 (28) fueron más eficaces que el placebo para los síntomas típicos del SII.
Las cepas mencionadas pueden ayudar a reducir los síntomas del síndrome del intestino irritable mejorando la evaluación global de los síntomas, la severidad del dolor abdominal y distensión abdominal, el efecto sobre la persistencia de los síntomas, y la calidad de vida (25). Se sugiere el uso de cepas probadas, en lugar de probióticos como grupo, para reducir síntomas generales del SII como la hinchazón y diarrea. (24)
Discusión
Existen diversas aproximaciones en el abordaje terapéutico del SII, sin que se defina una clara estrategia dominante. Múltiples trabajos abordan el uso de probióticos como uno de los pilares del tratamiento para el SII, con una variabilidad en los resultados clínicos (15).
La Asociación Americana de Gastroenterología (AGA) recomienda el uso de probióticos sólo en el contexto de un ensayo clínico sin recomendaciones sólidas en adultos sintomáticos con SII (36). La revisión técnica se basó en 76 ensayos controlados aleatorizados (ECA) que utilizaron 44 cepas probióticas diferentes o combinaciones. Para la mayoría de los estudios que informaron un beneficio, los datos se derivaron de un solo ECA. La revisión sistemática de Ford et al, analiza la eficacia de los probióticos en el SII, y si bien sugieren que ciertas cepas individuales (Lactobacillus plantarum, E. coli y Enterococcus faecium) como las combinaciones de cepas (Bifidobacterium longum, Bifidobacterium bifidum, Bifidobacterium lactis, Lactobacillus acidophilus, Lactobacillus rhamnosus y Streptococcus thermophilus) mejoran los síntomas generales, no pueden determinar la superioridad de ninguna cepa en particular (20).
Por otro lado, una reciente revisión sistemática, considera que los probióticos alivian la sintomatología general del SII, especialmente el dolor y la distensión abdominal. En términos de géneros probióticos con mayor evidencia se refieren a Lactobacillus, Bifidobacterium y Bacillus. Y en cuanto a especie, el más efectivo fue Bifidobacterium bifidum al presentar beneficios en menor dosis y tiempo de tratamiento (33).
En relación con la utilización de probióticos monocepa o multicepas, numerosos estudios analizan las diferentes combinaciones (35), afirmando que estos últimos podrían presentar mayores beneficios (4).
En el trabajo de Fjeldheim, H., los probióticos de múltiples cepas tuvieron el potencial de mejorar los síntomas del SII, y aunque ninguno de los ensayos incluidos utilizó la misma mezcla de probióticos, se observaron algunas tendencias con respecto a la eficiencia de diferentes especies. La especie Lactobacillus acidophilus, estuvo presente en todos los suplementos que demostraron beneficios (n:6), Streptococcus thermophilus en cuatro de los estudios analizados y Bifidobacterium breve y Bifidobacterium longum en tres de los referidos. (34)
A su vez la revisión sistemática de Ruiz Sanchez, et al, menciona otras especies del mismo género con posibles beneficios en el tratamiento. Bifidobacterium animalis subsp. lactis mejoró el dolor abdominal y la consistencia de la materia fecal, mientras que Bifidobacterium bifidum demostró mejoras en la reducción de dolor y distensión como también en la urgencia evacuatoria. A su vez, en concordancia con lo analizado, Bifidobacterium infantis redujo el dolor abdominal, la distensión y la dificultad evacuatoria, por lo cual el beneficio parecería estar más asociado al género que a la especie (33). Otros estudios encontraron evidencia moderada para el uso del género Escherichia, una certeza baja para Lactobacillus y Lactobacillus plantarum 299V, y una certeza muy baja para los probióticos combinados (36).
Los probióticos más estudiados hasta el momento son del género Lactobacillus y Bifidobacterium, coincidiendo con las cepas más recomendadas en la bibliografía tanto en formato monocepas como multicepas.(14;30).
De acuerdo a la bibliografía consultada en nuestro trabajo, la cepa con mayor grado de evidencia como parte del tratamiento en el SII fue Bifidobacterium longum 35624, con efectos positivos en los síntomas globales y en la hipersensibilidad visceral (4,35), si bien se puede observar la variabilidad de resultados y dificultad de individualizar una única recomendación como tratamiento del SII.
Consideramos importante destacar la relevancia y particularidad de nuestro estudio al comparar las recomendaciones de guías y consensos internacionales sobre el uso probióticos como parte del tratamiento en SII.
El análisis realizado establece un marco de referencia valioso para futuros estudios e invita a profundizar y ampliar la búsqueda de documentos internacionales y nacionales, e incluir como objeto de estudio las recomendaciones de probióticos multicepas, sumando el uso de prebióticos/simbióticos como coadyuvantes para mejorar el abordaje nutricional en SII. Los estudios futuros deberán evaluar la suplementación con probióticos para la mejora de síntomas en SII, teniendo en cuenta factores confusores y considerando que estarán disponibles suplementos probióticos más individualizados y personalizados como aquellos de nueva generación, siendo Akkermansia, Bacteroides y Faecalibacterium los microorganismos que se proponen como relevantes para futuras investigaciones (34).
Conclusiones
El tipo de cepa no se reporta en todas las guías y consensos evaluados. Aun así, Bifidobacterium longum 35624 (n: 9) fue la cepa encontrada con mayor frecuencia, coincidiendo con la especie y género que brindaron mayor evidencia.
La mejora de síntomas es poco específica en la bibliografía en cuanto al tipo de especie, género y cepa. A pesar de ello, en todas las guías en que fueron incluidas, Bifidobacterium longum 35624, Lactobacillus plantarum 299v y Escherichia coli DSM 17252 mostraron mejorar la distensión abdominal y flatulencias.
La evidencia hasta ahora analizada sugiere que los probióticos no tienen contraindicaciones ya que son organismos vivos con eficacia y seguridad ampliamente demostradas. Es necesario establecer parámetros concretos desde la práctica clínica, para poder indicar de manera segura qué especies, y cepa específica, dosis de probióticos y tiempo del tratamiento. Para concluir, los probióticos son una opción prometedora para mitigar algunos síntomas del SII; sin embargo, la calidad y cantidad general de evidencia es baja. Por lo tanto, aún se necesitan estudios para emitir recomendaciones de fortaleza.
Referencias bibliográficas
- Valdovinos-Díaz MA. Probiotics in Irritable Bowel Syndrome: Are they Ready for Clinical Practice? Acta Gastroenterológica Latinoamericana.2021;51(3):123-134.
- Coriat BJ, Azuero OAJ, et al. Uso de probióticos en el síndrome de intestino irritable y enfermedad inflamatoria intestinal: una revisión de la literatura. Rev Colomb Gastroenterol. 2017;32(2):141-155.
- Mearin F, Ciriza C, et al. Guía de práctica clínica: síndrome del intestino irritable con estreñimiento y estreñimiento funcional en adultos: concepto, diagnóstico y continuidad asistencial. (Parte 1 de 2) Aten Primaria. 2017 Jan;49(1):42–55.
- Bustos Fernandez LM, Hanna Jairala I. Tratamiento actual del síndrome de intestino irritable: una nueva visión basada en la experiencia y la evidencia. Acta Gastroenterol Latinoam. 2019;49(4):381-393.
- De la Fuente del Rey M, Álvarez Calatayud G. Eje microbiota-intestino-cerebro. Su relación en el binomio salud/enfermedad. Disponible en:
https://www.elprobiotico.com/eje-microbiota-intestino-cerebro/. - Otero RW, Otero PL, et al. Síndrome de intestino irritable (SII): Nuevos conceptos en 2023. Medicina. 2022 Nov;44(3):347–371.
- Ringel Y, Ringel-Kulka T. The Intestinal Microbiota and Irritable Bowel Syndrome. J Clin Gastroenterol. 2015 Nov-Dec;49 Suppl 1.
- Basain Valdés MC, Valdés Alonso MC, et al. Alteraciones en la microbiota intestinal por la dieta y su repercusión en la génesis de la obesidad. MEDISAN. 2015;19(12):1536-1545.
- Suárez E. Los cambios en la nomenclatura taxonómica: irritantes pero reveladores. An Microbiota Probióticos Prebióticos. 2023;4(2):213-219.
- Fritz EC, Bhandari V. The Human Neonatal Gut Microbiome: A Brief Review. Front Pediatr. 2015;3:30.
- Man, F., Bustos Fernández L.M., et al. Síndrome de intestino irritable: ¿un trastorno funcional?. Acta Gastroenterológica Latinoamericana, vol. 43, núm. 4, diciembre, 2013, pp. 321-334 Sociedad Argentina de Gastroenterología Buenos Aires, Argentina.
- Hill C, Guarner F, Reid G, et al. Declaración de consenso de la Asociación Científica Internacional de Probióticos y Prebióticos sobre el alcance y uso apropiado del término probiótico. Nat Rev Gastroenterol Hepatol.2014;11:506–514.
- Pittayanon R, Lau JT, Yuan Y, et al. Microbiota intestinal en pacientes con síndrome del intestino irritable: una revisión sistemática. Gastroenterología. 2019 Jul;157(1):97-108. doi: 10.1053/j.gastro.2019.03.049.
- García LG, Palacios Bermejo A, et al. Probióticos, prebióticos, simbióticos, postbióticos conceptos
generales. Anales de Microbiota Probióticos Prebióticos.
2024;5(1):137-139. Disponible en:
https://semipyp.es/wp-content/uploads/2024/02/AMPP-5-1.pdf. - Ramakrishna BS. Probiotic-induced changes in the intestinal epithelium: implications in gastrointestinal disease. Trop Gastroenterol. 2009. Apr-Jun;30(2):76-85.
- Lin Chang,1 Anthony Lembo. American Gastroenterological Association Institute Technical Review on the Pharmacological Management of Irritable Bowel Syndrome.Gastroenterology 2014;147:1149–1172.
- Heng-Li Niu, et al. The efficacy and safety of probiotics in patients with irritable bowel syndrome: Evidence based on 35 randomized controlled trials. International Journal of Surgery 75 (2020) 116–127.
- Vergara Alvira, M. S., Ahumada Ossa, L. M., & Poveda Espinosa, E. (2022). Estrés, depresión, ansiedad y el hábito alimentario en personas con síndrome de intestino irritable. Revista Colombiana De Gastroenterología, 37(4), 369–382.
- Simon E, Călinoiu LF, Mitrea L, Vodnar DC. Probiotics, Prebiotics, and Synbiotics: Implications and Beneficial Effects against Irritable Bowel Syndrome. Nutrients. 2021;13(6):2112. doi: 10.3390/nu13062112.
- Ford AC, Harris LA, Lacy BE, et al. Systematic review with meta-analysis: the efficacy of prebiotics, probiotics, synbiotics and antibiotics in irritable bowel syndrome. Aliment Pharmacol Ther. 2018;48(10):1044-1060.
- Galdámez Estrada JA, Aguilar Paiz L, et al. Primer consenso centroamericano y del Caribe del síndrome de intestino irritable. Acta Gastroenterológica Latinoamericana. 2023;53(2):137–163. doi: 10.52787/agl.v53i2.272.
- Valenzuela J, et al. Un Consenso Latinoamericano Sobre El Síndrome Del Intestino Irritable. Gastroenterol Hepatol. 2004;27(5):325-343.
- Sabaté JM. Recommandations sur la prise en charge du Syndrome de l’Intestin
Irritable (SII) 2022. Disponible en:
https://www.fmcgastro.org/texte-postu/postu-2022/recommandations-sur-la-pris e-en-charge-du-syndrome-de-lintestin-irritable-sii/. - Moayyedi P, Andrews CN, MacQueen G, et al. Canadian Association of Gastroenterology Clinical Practice Guideline for the Management of Irritable Bowel Syndrome (IBS). J Can Assoc Gastroenterol. 2019;2(1):6-29.
- Valdovinos MA, Montijo E, et al. The Mexican consensus on probiotics in gastroenterology. Rev Gastroenterol Mex. 2017 Apr-Jun;82(2):156-178. doi:
- Barbara G, Cremon C, et al. Italian guidelines for the management of irritable bowel syndrome: Joint Consensus from the Italian Societies of:
- Gastroenterology and Endoscopy (SIGE), Neurogastroenterology and Motility
- (SINGEM), Hospital Gastroenterologists and Endoscopists (AIGO), Digestive Endoscopy (SIED), General Medicine (SIMG), Gastroenterology, Hepatology and Pediatric Nutrition (SIGENP) and Pediatrics (SIP). Dig Liver Dis. 2023 Feb;55(2):187-207. doi: 10.1016/j.dld.2022.11.015.
- Su GL, Ko C, et al. AGA Clinical Practice Guidelines on the Role of Probiotics in the Management of Gastrointestinal Disorders. Gastroenterology. 2020;159(2):697–705. doi: 10.1053/j.gastro.2020.05.039.
- Update S3-Leitlinie Reizdarmsyndrom: Definition, Pathophysiologie, Diagnostik und Therapie. Gemeinsame Leitlinie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) und der Deutschen Gesellschaft für Neurogastroenterologie und Motilität (DGNM). Z Gastroenterol 2021; 59: 1323–1415.
- Alvarado, et al.Guía de práctica clínica para el diagnóstico y tratamiento del síndrome de intestino irritable en población adulta. Revista
Colombiana de Gastroenterología [en linea]. 2015, 30(1), 43-56[fecha de Consulta 29 de Septiembre de 2024]. ISSN: 0120-9957 - Álvarez Calatayud G, Mateos Lardiés AM, coordinadores. Guía de actuación y documento de consenso sobre el manejo de preparados con probióticos y/o prebióticos en la farmacia comunitaria SEFAC-SEPyP. 1ª ed. SEPyP y SEFAC;2018.
- Directrices Globales de la Organización Mundial de Gastroenterología (Probióticos y Prebióticos). Febrero 2023.
- Cristina Ruiz-Sánchez, et al. Evaluation of the efficacy of probiotics as treatment in irritable bowel syndrome. Endocrinol Diabetes Nutr. 2024;71:19-30.irritable bowel syndrome: In memory of Professor Witold Bartnik. Prz. Gastroenterol. 2018;13(4):259-288. doi: 10.5114/pg.2018.78343.
- Fjeldheim H, et al. Probiotics in Irritable Bowel Syndrome: An Up-to-Date Systematic Review. Nutrients 2019, 11(9), 2048 .
- Fukudo S, Okumura T, et al. Evidence-based clinical practice guidelines for irritable bowel syndrome 2020. J Gastroenterol. 2021 Mar;56(3):193-217. doi:
10.1007/s00535-020-01746-z. - Coriat BJ, Azuero OAJ, et al. Uso de probióticos en síndrome de intestino irritable y enfermedad inflamatoria intestinal: una revisión de la literatura. Rev Colomb Gastroenterol. 2017;32(2):141-155.




No comments! Be the first commenter?